
- •Кафедра химии Лабораторные работы
- •Электрохимические методы анализа
- •Лабораторная работа № 1 Потенциометрическое кислотно-основное титрование
- •1.3 Теоретические основы метода
- •1.4 Порядок выполнения работы
- •1.5 Обработка полученных результатов
- •1.6 Результаты работы
- •Вопросы для защиты лабораторной работы
- •Лабораторная работа № 2 Определение хлорид-ионов методом прямой потенциометрии
- •2.3 Теоретические основы метода
- •2.4 Порядок выполнения работы
- •2.5 Обработка полученных результатов
- •2.6 Результаты работы
- •Вопросы к защите лабораторной работы
Министерство образования Республики Беларусь
Учреждение образования
МОГИЛЕВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ПРОДОВОЛЬСТВИЯ
Кафедра химии Лабораторные работы
по дисциплине «Аналитическая химия»
по теме:
Электрохимические методы анализа
Специальность 1 - 49 01 02 «Технология хранения и переработки животного сырья»
Специализация: 1 - 49 01 02 02 Технология молока и молочных продуктов
Проверил Выполнили
Автушенко В.В. студенты группы ТЖМ – 101
___________________________ _____________________________
_____________________________
_____________________________
«_____» ______________ 2011 г. «_____» ______________ 2011 г.
Могилев 2011
Лабораторная работа № 1 Потенциометрическое кислотно-основное титрование
1.1 Цель работы: освоить методику потенциометрического кислотно-основного титрования, определить содержание сильной кислоты, слабой кислоты или их смеси в анализируемом растворе.
1.2 Приборы и реактивы: универсальный милливольтметр, электроды (хлорсеребряный и стеклянный), бюретка объемом 25 мл, пипетки объемом 10 мл, стакан, мерная колба объемом 100 мл, мешалка, стандартный раствор гидроксида натрия с концентрацией 0,1 моль/л.
1.3 Теоретические основы метода
Потенциометрические методы основаны на измерении электродвижущих сил (ЭДС):
ΔЕ = Е1 – Е2
где ΔЕ – электродвижущая сила, Е1 и Е2 – потенциалы электродов исследуемой цепи.
Один электрод является электродом сравнения, а второй электрод – индикаторным. Электроды сравнения имеют устойчивый во времени потенциал, не зависящий от концентрации ионов в анализируемом растворе. В качестве электродов сравнения чаще всего используют электроды второго рода – хлорсеребряный и каломельный. Потенциал индикаторного электрода зависит от концентрации определяемого иона. Эта зависимость выражается уравнением Нернста:
![]()
где Е° – стандартный потенциал окислительно-восстановительной системы; R – газовая постоянная, равная 8,31441 Дж∙моль–1∙К–1; T – абсолютная температура, К; F – постоянная Фарадея, равная 96485 Кл·моль–1, n – число электронов, принимающих участие в реакции, aox, ared – активности соответственно окисленной и восстановленной форм.
В данной работе в качестве электрода сравнения используется хлорсеребряный электрод, а в качестве индикаторного – стеклянный.
Хлорсеребряный электрод (рисунок 1) представляет собой серебряную проволоку или пластину (1), покрытую слоем AgCl и помещенную в раствор KCl (2). Уравнение Нернста для хлорсеребряного электрода имеет вид:
![]()
Как видно из уравнения, потенциал хлорсеребряного электрода зависит от активности хлорид-ионов. Обычно используется насыщенный раствор KCl.
Стеклянный электрод (рисунок 2) представляет собой тонкостенный стеклянный шарик (1), заполненный раствором HCl или каким-либо буферным раствором (2). Внутрь шарика помещают хлорсеребряный электрод (3). Достоинствами стеклянного электрода являются простота работы, применимость в широких диапазонах рН, быстрое установление равновесия. К недостаткам можно отнести хрупкость конструкции и усложнение работы при переходе к сильно щелочным и сильно кислым растворам.
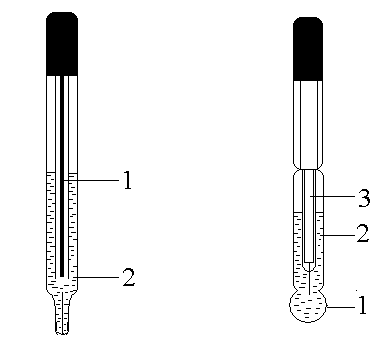
|
Рисунок 1 – хлорсеребряный электрод |
Рисунок 2 – стеклянный электрод |
Потенциометрическое титрование основано на определении точки эквивалентности по результатам потенциометрических измерений. Вблизи точки эквивалентности происходит резкое изменение (скачок) потенциала индикаторного электрода. В кислотно-основном потенциометрическом титровании протекает реакция нейтрализации, в ходе которой резко меняется концентрация ионов водорода в анализируемом растворе, что и фиксируется изменением потенциала стеклянного электрода. Измерение рН производится прибором рН-метром.
