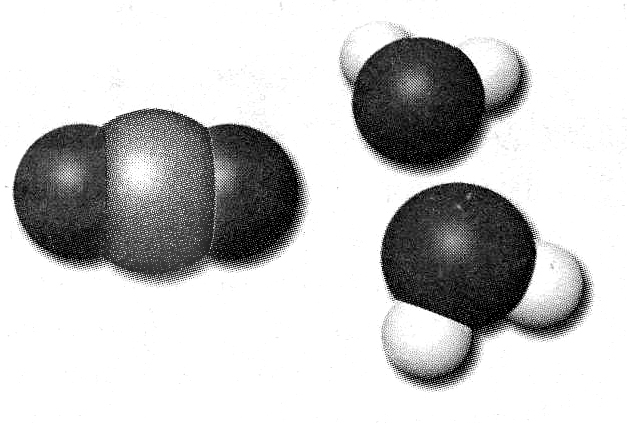- •Ключевые вопросы.
- •Раздел 2 Структурно – логические схемы.
- •1Есть вещества (гелий, неон и др) –молекулы которых состоят из одного атома.
- •1. Масса веществ вступивших в реакцию равна массе веществ, образовавшихся в ее результате.
- •Раздел 3. Обучающие тесты.
- •1.Введение.Вещество.
- •2.Чистые(индивидуальные) вещества и смеси. Разделение смесей.
- •3.Физические и химические явления. Определение предмета химии.
- •4.Химические элементы. Атомы. Периодическая система химических элементов
- •5.Молекулярный и немолекулярный состав веществ. Молекулы. Химические формулы. Закон постоянства состава.
- •6.Классификация веществ. Простые и сложные вещества. Аллотропия.
- •7.Относительная атомная и молекулярная масса. Качественный и количественный состав вещества.
- •8.Закон сохранения массы веществ. Уравнения химических реакций. Типы химических реакций.
- •Раздел 4. Творческие задания. Задачи.
- •Раздел 5. Ответы.
- •1.Введение.Вещество.
- •2.Чистые(индивидуальные) вещества и смеси. Разделение смесей.
- •3.Физические и химические явления. Определение предмета химии.
- •4.Химические элементы. Атомы. Периодическая система химических элементов
- •5. Молекулы. Химические формулы. Закон постоянства состава.
- •6.Классификация веществ. Простые и сложные вещества. Аллотропия.
- •7.Относительная атомная и молекулярная масса. Качественный и количественный состав вещества.
- •8.Закон сохранения массы веществ. Уравнения химических реакций. Типы химических реакций.
- •5.2. Ответы к творческим заданиям и задачам (раздел 4).
- •Лист самоконтроля.
- •5.1. Обучающие тесты (раздел 3).
- •1.Введение. Вещество.
- •2.Чистые (индивидуальные) вещества и смеси. Разделение смесей.
- •3.Физические и химические явления. Определение предмета химии.
- •4.Химические элементы. Атомы. Периодическая система химических элементов
- •5. Молекулы. Химические формулы. Закон постоянства состава.
- •6.Классификация веществ. Простые и сложные вещества. Аллотропия.
- •7.Относительная атомная и молекулярная масса. Качественный и количественный состав вещества.
- •8.Закон сохранения массы веществ .Уравнения химических реакций. Типы химических реакций.
- •5.2. Ответы к творческим заданиям и задача. (раздел 4).
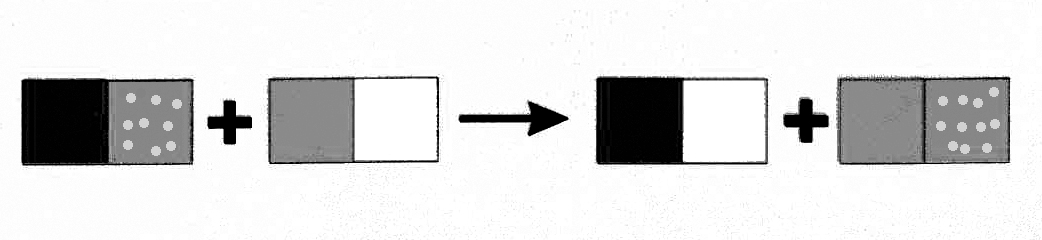
1. Масса веществ вступивших в реакцию равна массе веществ, образовавшихся в ее результате.

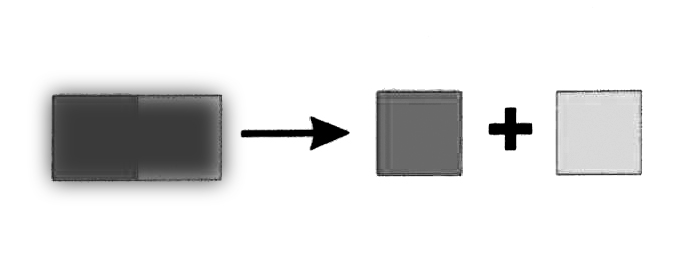
Атомы не исчезают в «никуда», не возникают из «ниоткуда».
Они перегруппировываются в результате реакции. Массы атомов сохраняются.

До реакции |
После реакции |
|
|
Масса всех атомов до и после реакции одинакова |
|
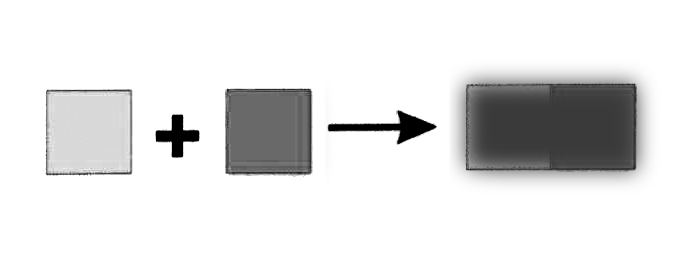
2. Уравнения химических реакций
а) химический язык
-
«Буквы»
(информация о химических элементах и атомах)
«Слова»
(информация о химических веществах)
«Предложения»
(информация о химических реакциях)
Химические символы
Химические формулы веществ
Схемы и уравнения химических реакций
С- химический элемент углерод
O2 – простое вещество кислород
Схема:
СH4 + O2CO2 + H2O
Уравнение:
СH4 + 2O2CO2 + 2H2O
Н – химический элемент водород
СH4 – сложное вещество метан
О –химический элемент кислород)
H2O – сложное вещество вода
б)химические цифры
-
Индексы
Коэффициенты
Что означает
Примеры
Что означает
Примеры
Показывают число атомов конкретного химического элемента в веществе и всегда постоянно
Запись формулы вещества:
 P2
O5
P2
O5индексы
Означает, что в одной молекуле вещества содержится 2 атома фосфора и 5 атомов кислорода.
Читается: «пэ два о пять»
Число молекул вещества для данной реакции.
В разных уравнениях для вещества может иметь разное значение.
2P2 O5
читается «два пэ два о пять»
3P2 O5
читается «три пэ два о пять»
Показывает число групп атомов в составе вещества. Постоянно для каждого вещества.
Запись формулы вещества:
Fe(NO3)2
индексы
Означает, что в составе вещества на один атом железа приходится две группы атомов NO3.
В группе атомов NO3 на один атом азота приходится три атома кислорода.
Читается «феррум эн о три трижды».
Общее число атомов:
Железа – 1 атом
Азота – 1 атом * 2 группы = 2 атома
Кислорода – 3 атома* 2 группы = 6 атомов.
Запись FeN2O6 не применяется в уравнениях, т.к. теряется смысл состава групп (изучим позднее).
Число молекул одного вещества, приходящееся на число молекул другого вещества. Для разных веществ может иметь разное значение.
CuSO4•5H2O
Читается «купрум эс о четыре на пять аш два о»
Означает, что на один состав CuSO4 приходится 5 молекул воды..
CuSO4•H2O
Читается «купрум эс о четыре на аш два о»
3CaO•P2O5
Читается «три кальций о на пэ два о пять»
Общее число атомов:
Кальция – 3
Фосфора – 2
Кислорода - 8

Коэффициенты (коэффициент «1» не пишется)

СН4 + 2О2 = СО2 + 2Н2О
Индексы (индекс «1» не пишется)
б) составление химических уравнений
-
Последовательность действий
Пример:
1
Выяснить, какие вещества реагируют и что с ними происходит.
«При горении красного фосфора…»
Реагируют фосфор и кислород.
2
Записать формулы реагирующих веществ в левой части уравнения
Соблюдаем закон постоянства состава
(сохраняем качественный и количественный состав веществ)
Формула красного фосфора: Р,
Формула кислорода: О2,
«Реагируют» обозначаем знаком «+»
Запись выглядит так:
P + O2
3
Записать формулы образовавшихся веществ в правой части уравнения Соблюдаем закон постоянства состава
(надо расставить индексы в веществах)
На данном этапе формулы даются готовые, впоследствии научимся их составлять.
Образуется при горении одно вещество:
P2 O5
4
В образованной схеме между левой и правой частями ставим направление превращения «→», но не «=»
P + O2 → P2 O5
5
Расставить коэффициенты.
Число атомов каждого химического элемента слева и справа должно быть одинаковым.
После расстановки коэффициентов знак «→» можно заменить на знак «=», то есть из схемы превращения веществ составить уравнение химической реакции.
Индексы в веществах не меняем.
Уравняем количество атомов кислорода. Слева их 2, справа 5. Наименьшее общее кратное этих чисел -10. То есть: общее число атомов кислорода слева и справа должно быть 10.
Для O2 - коэффициент 5,
для P2 O5 - коэффициент 2
P +5 O2 → 2 P2 O5
Уравняем количество атомов фосфора. Слева – 1 атом, справа 4. Общее число атомов фосфора слева и справа – НОК чисел 1 и 4 = 4.
Для P – коэффициент 4, для P2O5 коэффициент остаётся найденным ранее – 2.
4P +5 O2 → 2 P2 O5
4P +5 O2 =2 P2 O5
3. Типы химических реакций.
Признак классификации реакций |
Химические реакции: |
|||
Число и состав реагирующих и образующихся веществ |
соединения |
разложения |
замещения |
обмена |
Существуют и другие признаки классификации |
Одни и те же реакции можно классифицировать по разным признакам. |
|||
|
Типы реакций по числу и составу реагирующих и образующихся веществ |
|||
Название типа реакции |
соединения |
разложения |
замещения |
обмена |
Принцип определения типа реакции |
Из двух (трех) веществ образуется одно |
Из одного вещества образуется два или несколько новых (других) |
Атомы простого вещества замещают атомы какого-либо элемента в сложном веществе |
Два сложных вещества обмениваются своими составными частями |
Число исходных и образующихся веществ |
2(3)→1 |
1→2(3) |
2→2 |
2→2 |
Состав исходных веществ |
Простые или сложные |
Сложное |
Одно простое, другое сложное |
Сложные |
Состав образующихся веществ |
Сложное |
Простые или сложные |
Одно простое, другое сложное (*возможно и оба сложных) |
Сложные
|
Упрощенные схемы числа и состава веществ |
|
|
|
|
Упрощенная буквенная схема |
А + В →С |
А → В + С |
А + ВС→АС +В (для данного этапа изучения) |
АВ + ав →Ав + аВ |
Примеры уравнений реакций |
2Н2 +О2 = 2 Н2О СаО + Н2О = Са(ОН)2 |
2KMnO4 → K2MnO4+MnO2 + O2 |
Ca +2 HCl = CaCl2 + H2 |
H2SO4 + Ba(NO3) 2 =
BaSO4 + 2HNO3 |