
- •Методичні вказівки
- •Кременчук 2006
- •1 Електрохімічні процеси
- •1.1 Окислювально-відновлювальні реакції
- •Контрольні питання
- •1.2 Електродні потенціали
- •Контрольні питання
- •1.3 Електроліз
- •1.4 Корозія металів
- •Контрольні питання
- •2 Розрахунок рН розчину
- •Розрахунок рН та рОн
- •Контрольні питання
- •3 Жортскість води
- •Контрольні питання
- •4 Визначення розсіювання біогенних елементів
- •Кларки мікроелементів у літосфері та осадових породах (h 10 –3)
- •Ранжирування значень кк і кр для еталонного об'єкта
- •Побудова графіка біогеохімічного спектра
- •Контрольні питання
- •5 Визначення біогеохімічних циклів
- •Контрольні питання
- •6 Буферні розчини
- •Список літератури
2 Розрахунок рН розчину
Під час розв'язування задач за визначенням [Н+] і рН у розчинах слабких електролітів - використовуємо закон розбавлення Оствальда:
C α2
K =
при α
0,1;
або К = С α2
,
=
при α
0,1;
або К = С α2
,
1- α
звідки
α =
![]() .
.
Константи дисоціації К слабких електролітів наведені в довідковій таблиці. У розчинах одноосновних кислот:
[H+] = α С = С = КС .
У сильно розведених розчинах слабких електролітів ступінь дисоціації може досягти такого значення, нехтування яким призведе до значної похибки, тому варто використовувати формулу:
Сα2 [Н+]2
К
 = = , звідки
= = , звідки
1-α C-[H+]
[H+]2 + K[H+] – KC = 0
 -
K +
K2
+ 4KC
-
K +
K2
+ 4KC
[ H+]
=
H+]
=
2
У розчинах слабких основ (однокислотних), міркуючи аналогічно:
[OH -] = α С = КС
Наближені формули для розрахунку [Н+] і [ОН-] у водних розчинах кислот і основ наведені в таблиці 2.1.
Кw- іонний добуток води.
У сильних електролітах наближені обчислення можна вести за формулами таблиці , а в точних - враховувати іонну силу
Таблиця 2.1
Розрахунок рН та рОн
-
Електроліт
[H + ]
[OH- ]

 Вода
Вода
[H + ]= Kw
[OH- ]= Kw
Сильна кислота
[H + ]=CHAn
[OH- ]=Kw/[H + ]=Kw/CHAn
Сильна основа
[H + ]=Kw/[OH -]= =Kw/CKtOH
[OH- ]=CKtOH
Слабка кислота
[H + ]= KHAn CHAn
[OH- ]=Kw/[H + ]=
=Kw/
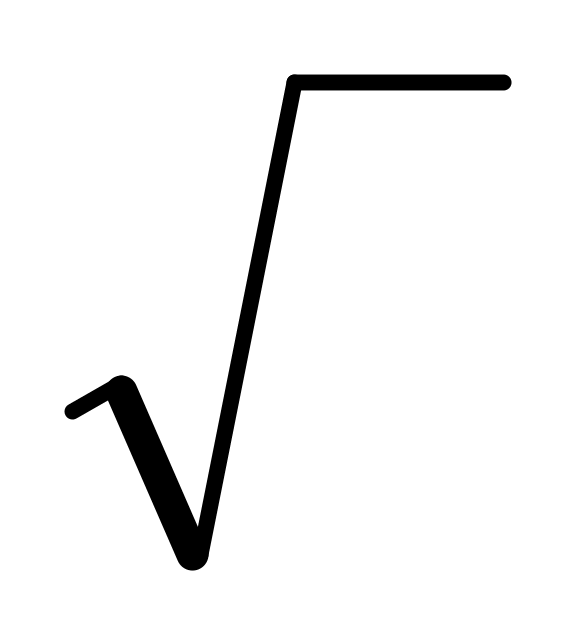 KHAn
CHAn
KHAn
CHAnСлабка основа
[H + ]=Kw/[OH -]=
Kw/ KKtOHCKtOH
[OH- ]= KKtOHCKtOH
CHAn ,KHAn - концентрація та константа дисоціації кислоти,
CKtOH,KKtOH- концентрація та константа дисоціації основи
Приклад 1 Обчислити рН 0,1М розчину мурашиної кислоти, К = 1,8*10-4.
Розв'язок:
[H+] = KC = 1,8 . 10-4 . 0,1 = 4,2 . 10-3 моль/л
РН = 3 – lg4,2 = 2,38
Приклад 2 Обчислити рН 0,25М розчину хлорної кислоти.
Рішення: НС1О4 - сильний електроліт, іонна сила розчину: С = 0.25. Середній коефіцієнт активності: .
0.5z2 I 0.5*1* 0.25
l
 gf
= - = -
= - 0.1667
gf
= - = -
= - 0.1667
1 + I 1 + 0.25
f = 0.681
Активність іонів водню дорівнює:
a (H+) = [H+] * f = 0.25 * 0.681 = 1.7 * 10-1 моль/л
pH = 1 – lg1.7 = 1 – 0.23 = 0.77
Контрольні питання
81-100 Розрахуйте концентрацію водневих іонів і РН водяних розчинів
81.1.Розчин отриманий розведенням водою 200 мл 12 %-го розчину HN03 до 2л.
2.0,1 н розчин NH40H.
3. Розчин отриманий розчиненням 1г NaOH у 250 мл 0,2 н розчини СНзСООН.
82.1. Розчин, отриманий розведенням водою 50 мл 5%-го розчину H2S04 до 500 мл.
2. Розчин, у 50 мл якого міститься 2.4 г СНзСООН.
3. Розчин, отриманий розчиненням 3.2 г NH4N03 у 200 мл 0.1 н розчину NH40H.
83.1. 0.1 н розчин NaOH, ступінь дисоціації якого - 84 %.
2. Розчин мурашиної кислоти 0.46%-й концентрації (густина дорівнює 1).
3. Розчин, отриманий змішуванням 200 мл 0.2 н NH40H з 200 мл розчину, що містить 2.14 г NH4C1.
84.1. Розчин, отриманий розведенням водою 100 мл 4%-го розчину НС1 до 500 мл.
2. 0.2 н розчин NH40H.
3. Розчин, отриманий змішуванням 800 мл 0.1 н розчину СНзСООН з 200 мл О.2 н розчину NaOH.
85.1. Розчин, отриманий розведенням водою 10 мл 10%-го розчину H2S04 до 200 мл.
2. Розчин, у 50 мл якого міститься 0.3 г СНзСООН.
3. Розчин, отриманий змішанням 200 мл О,2 н розчину NH40H з 300 мл О,1 н розчину NH4C1.
86.1. Розчин, отриманий розведенням водою 25 мл 14%-го розчину NaOH до 500 мл.
2. Розчин оцтової кислоти 0,6 %- ої концентрації ( густина 1г/см3).
3. Розчин, отриманий розчиненням 2 г NaOH у 500 мл 0,2 н розчини НСООН.
87.1. Розчин, отриманий розведенням водою 20 мл 27%-го розчину КОН до 600 мл.
2. Розчин мурашиної кислоти, у 25 мл якого міститься 0,115 г HCOOH.
3. Розчин, отриманий змішуванням 50 мл 0,2 н розчину CH3COONa з 50 мл О,1 н НС1.
88.1. 0,1 н розчин НС1 ступінь дисоціації якого дорівнює 91%.
2. Розчин, отриманий розведенням водою 5 мл 1 н розчину NH40H до 50 мл.
3. Розчин, отриманий змішуванням 100 мл 0,2 н розчину СНзСООН з 100 мл розчину, що містить 1,64 г СНзСООNа.
89.1. Розчин, отриманий розчиненням 1,12 г КОН у 200 мл води.
2. Розчин, у 250 мл якого міститься 1,5 г СНзСООН.
3. Розчин, отриманий змішуванням 400 мл 0,1 н розчину HCOONa з 100 мл 0,2 н розчину НС1.
90.1. Розчин, отриманий розведенням водою 10 мл 49%-го розчину НNОз до 500 мл.
2. Розчин мурашиної кислоти, у 250 мл якого міститься 1,15 г НСООН.
3. Розчин, отриманий змішуванням 80 мл 0,1 н розчину NH40H з 20 мл 0,2 н розчину НС1.
91.1. 0,1 н розчин НС1.
2. 0,2 н водяний розчин NH40H.
3. Розчин, отриманий змішанням 1 л розчину, що містить 0,56 г КОН і 500 мл 0,1 н розчину СНзСООН.
92.1. Розчин, отриманий розведенням 10 мл 5%-го розчину H2S04 до 100 мл.
2. Розчину мурашиної кислоти 0,23 %-й концентрації (густина 1).
3. Розчину, отриманого при змішанні 70 мл 0,2 н розчини NH40H з 30 мл 0.4 н розчину НС1.
93.1. Розчин отриманий розведенням водою 100 мл 4 %-го розчину НС1 до 1 л.
2. Розчину, у 750 мл якого міститься 4,5 г СНзСООН.
3. Розчину, отриманого змішанням 30 мл 0,1 н розчину СНзСООН і 29 мл 0,2 н розчину СНзСООNа.
94.1. 0,002 н розчин HN03 .
2. 0,01 н розчин оцтової кислоти, ступінь дисоціації якої в цьому розчині 4,2%
3. Розчину, отриманого змішуванням 75 мл 0,1 н розчину NH40H з 95 мл 1 н розчину NH4C1.
95.1. 0,005 н розчин у HN03 .
2. 0,015 н розчину NH4C1.
3. Розчину, отриманого змішуванням 300 мл 0,05 н розчину NH40H з 200 мл 0,1 н розчину NH4C1.
96.1. Розчину, отриманого розведенням 10 мл 49%.-го розчину HN03 до 500 мл.
2. Розчину, у 200 мл якого міститься 1,2 г СНзСООН.
3. Розчину, отриманого розчиненням 2 г NaOH у 500 мл 0,2 н розчину СНзСООН.
97.1. Розчину, отриманого розведенням 200 мл 12 %-го розчину HN03 до 2 л.
2. Розчину мурашиної кислоти, у 100 мл якої міститься 0,46 г кислоти.
3. Розчину, отриманого розчиненням 2 г гідроксиду натрію в 500 мл 0,2 н розчину мурашиної кислоти.
98.1. Розчину, отриманого при змішанні 30 мл 0,1 М розчину оцтової кислоти і 50 мл 0,3 М розчину ацетату калію.
2. 0,11%-ному розчині гідроксиду барію.
3. Розчину, отриманого розведенням 150 мл 25 %-го розчину НС1 до 2,5 л.
99.1. Розчину, отриманого розчиненням 1,12 г КОН у 200 мл води.
2.0,01 н водного розчину аміаку.
3. Розчину, отриманого розчиненням 3,2 г NH4NO3 у 100 мл 0,08 н розчину NH40H .
100.1. Розчину, отриманого при змішуванні 30 мл 0,2 М розчини оцтової кислоти і 50 мл О,6 М розчину ацетату натрію.
2. 0,075 н розчину Н2S04.
3. Розчину, отриманого розведенням 50 мл 12%-го розчину NaOH водою до 3 л.
