
4. Другие кинетические законы окисления материалов
В большинстве случаев рост толстых продуктов взаимодействия материалов с окислителем протекает не по линейному и параболическому закону и его описывают уравнением:
hn = kτ,
где n < 1 или n > 2, или 1< n <2.
При n < 1, как правило, на поверхности металлов формируется незащитная газопроницаемая, но теплозащитная пленка. Из-за протекания экзотермической реакции окисления температура неконтролируемо увеличивается на границе раздела фаз металл-оксидная пленка, что приводит к ускоренному (катастрофическому) его окислению и, возможно, к взрывной реакции.
При n > 2 диффузия реагентов тормозится в большей степени, чем это следует при зависимости сопротивления этого процесса только от роста толщины оксидной пленки. Причины зависимости удельного сопротивления диффузии реагентов через толстую оксидную пленку от длительности изотермической выдержки могут быть самыми разнообразными. Например, коагуляция вакансий и образование пустот в оксидной пленке (рис. 3а) или образование пустот на границе раздела фаз металл – оксидная пленка (рис. 3б), когда контролирующей стадией процесса является диффузия катионов металла через пленку. В последнем случае пустоты образуются из-за того, что потеря металла полностью не компенсируется пластической деформацией толстой оксидной пленки на металлическую поверхность.
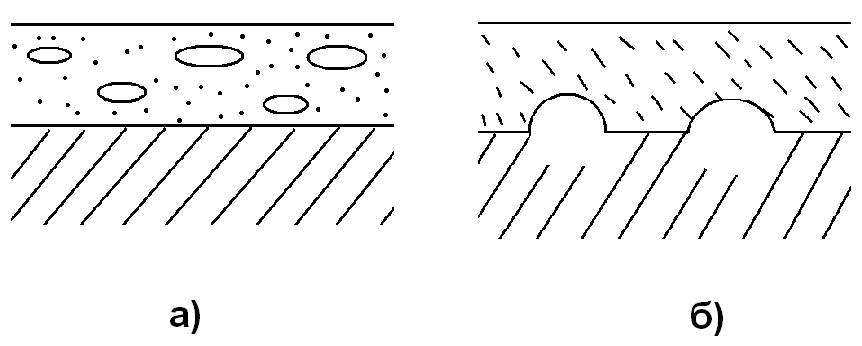
Рис. 3. Оксидная пленка с образовавшимися внутри нее пустотами (а) и пустотами на границе её раздела с металлом (б)
В случае если первоначально процесс окисления металлического материала может протекать с образованием защитной оксидной пленки с показателем n ≥ 2 в кинетическом уравнении, а с увеличением длительности изотермической выдержки происходит разрушение (растрескивание, осыпание) оксидной пленки, то n становится ≤ 1 (рис. 4).
Значительные осложнения при обработке экспериментальных данных и последующего выявления контролирующей стадии процесса окисления вносит периодическое растрескивание, приводящее к потере защитных свойств пленки и вновь зарождение и рост защитного слоя пленки.
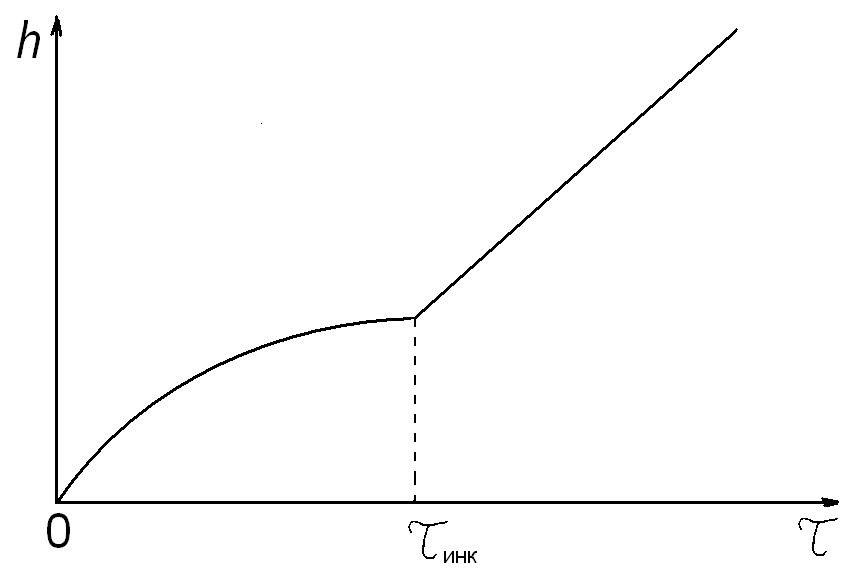
Рис. 4. Типичная кинетическая кривая изменения толщины провзаимодействовавшего с окислителем металла, когда первоначально растущая на его поверхности защитная пленка после инкубационного периода (τинк) теряет свои защитные свойства
Основные причины растрескивания защитных оксидных пленок:
1) колебание температуры, что вызывает возникновение внутренних напряжений вследствие различия коэффициента термического расширения плёнки и металлической основы;
2) неравномерность металлической поверхности изделий приводит к образованию отрывающего усилия из-за внутренних напряжений сжатия;
3) образование пустот на границе раздела металлическая основа-защитная пленка из-за коагуляции вакансий, которые образуются, когда рост пленки происходит за счет диффузии катионов металла через нее;
4) механические напряжения, возникающие при работе детали или конструкции (например, при постоянных или переменных нагрузках, ударах и др.);
5) возникновение внутренних напряжений вследствие образования новых фаз или фазового перехода оксидов пленки, сопровождающееся изменением ее объема и различием: а) коэффициентов термического расширения различных фаз; б) межатомного взаимодействия между фазами, чем – внутри них.
Кинетика роста оксидных пленок на металлах является функцией от содержания в них примесей, геометрической формы образцов, длительности изотермического окисления. Вместе с тем, ориентировочно считают, что в различных температурных интервалах процесс изотермического окисления металлов можно описать кинетическими законами, приведенными в табл. 1.
Табл. 1. Кинетические законы роста оксидных пленок на металлах
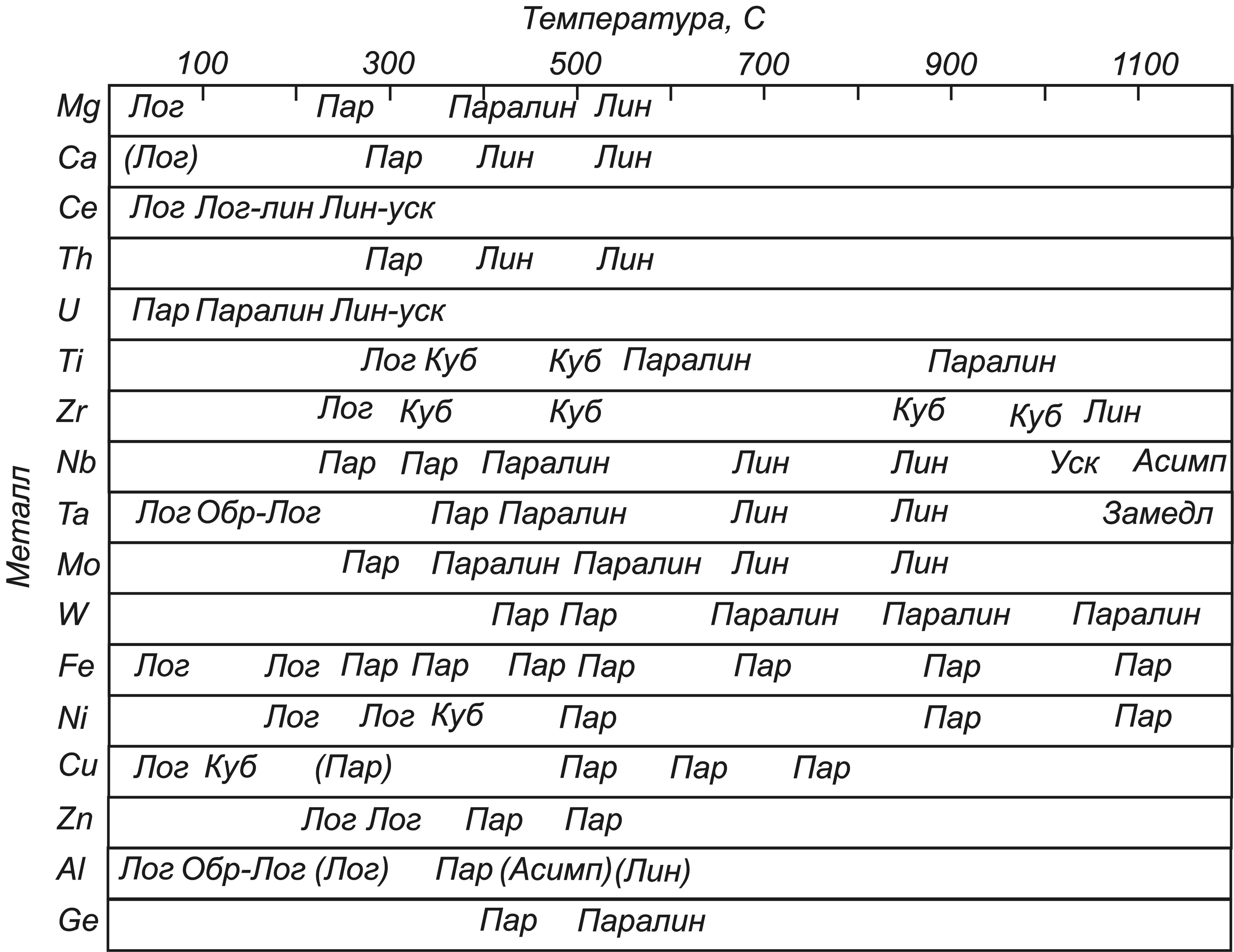
Следует отметить, что по показателю степени кинетического уравнения нельзя судить о величине скорости процесса, как и утверждать, что скорость окисления того металла будет меньше, у которого больше показатель степени в кинетическом уравнении. Данный показатель указывает только на степень торможения или ускорения процесса окисления материала с увеличением времени его нахождения в агрессивной газовой среде при изотермических условиях и постоянном парциальном давлении окислителя (рис. 5).
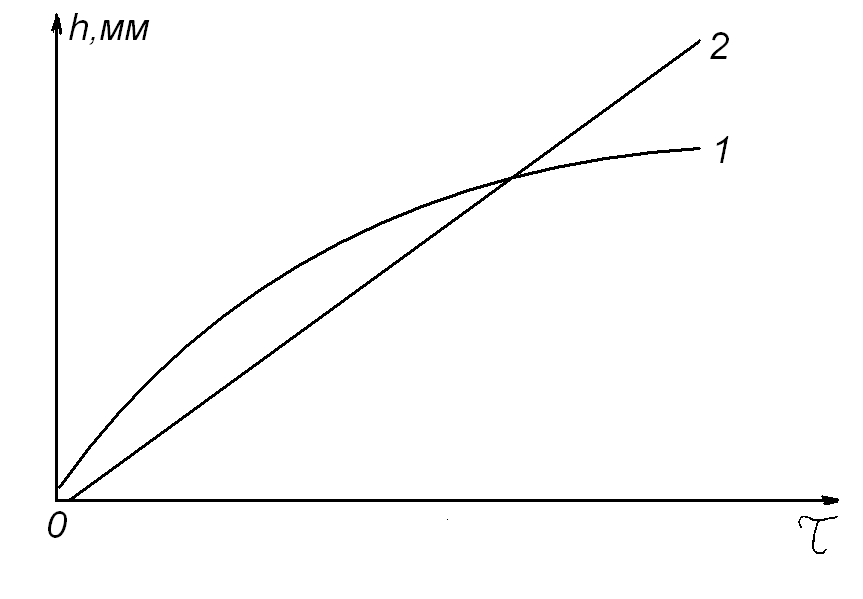
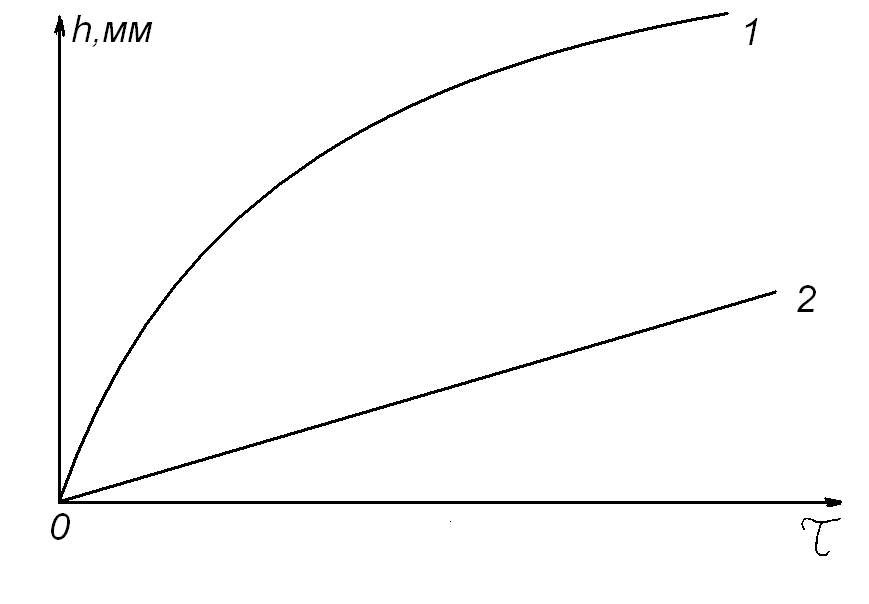
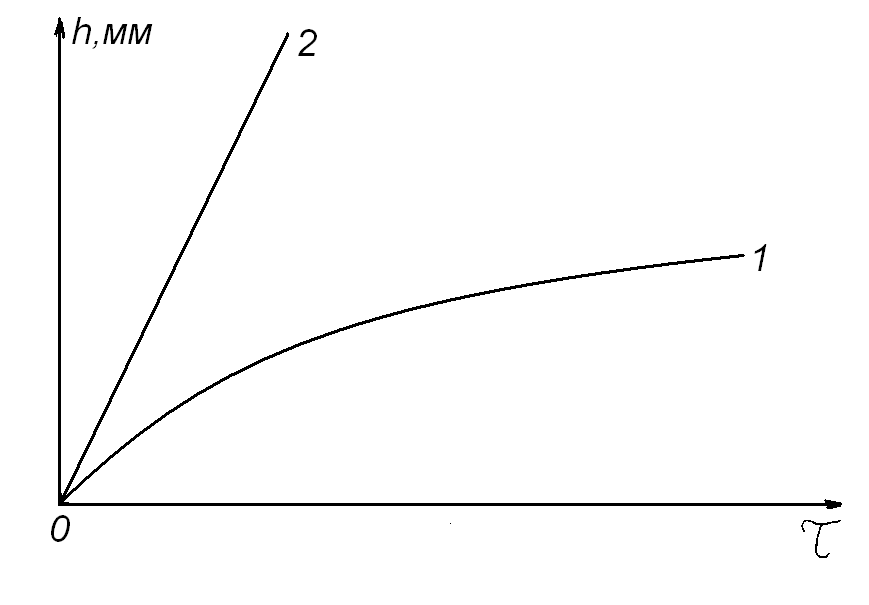
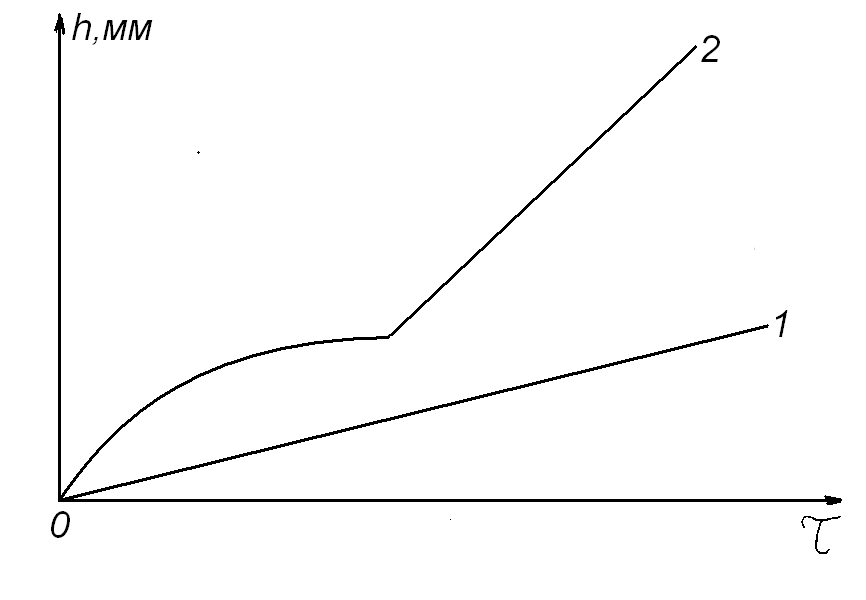
Рис. 5. Примеры возможного вида экспериментальных кинетических кривых при изотермическом окислении различных металлов, РО2 = const
