
Газовая коррозия
Газовая коррозия – самопроизвольное окисление металлов в газовой среде при высоких температурах.
Первопричина окисления материалов в газовой среде – их термодинамическая неустойчивость при данном парциальном давлении окислителя и температуре.
Жаростойкость – способность материала сопротивляться коррозионному воздействию газов при высоких температурах.
Жаропрочность – способность материала сохранять при высоких температурах механические свойства: длительную прочность и сопротивление ползучести.
I. Термодинамика газовой коррозии материалов
Принципиальная возможность или невозможность самопроизвольного протекания процесса окисления материалов в газовой среде определяется по знаку изменения энергии Гиббса (ΔGТ). По абсолютной величине этого изменения определяется величина движущей силы этого процесса.
Для наиболее распространенного процесса газовой коррозии – окисления компактного металла кислородом с образованием твердофазной оксидной плёнки
![]() ,
,
изменение энергии Гиббса определяется следующим образом:
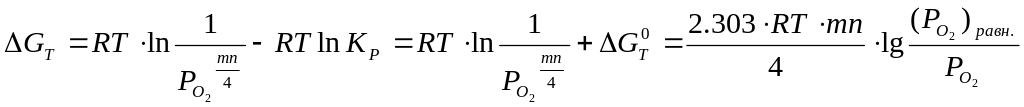 ,
,
где
![]() - стандартное изменение энергии Гиббса
(
- стандартное изменение энергии Гиббса
(![]() при
при
![]() =
1 атм.), Дж/моль; R
– газовая постоянная, 8,314 Дж/(К∙моль);
T – абсолютная
температура, К;
- парциальное давление кислорода в
газовой среде, атм;
=
1 атм.), Дж/моль; R
– газовая постоянная, 8,314 Дж/(К∙моль);
T – абсолютная
температура, К;
- парциальное давление кислорода в
газовой среде, атм;
![]() - равновесное давление кислорода, т.е.
давление, соответствующее равновесному
состоянию системы «металл – твёрдофазная
оксидная плёнка – кислород», атм; m
– число атомов металла в молекуле
оксида; n –
валентность металла;
- равновесное давление кислорода, т.е.
давление, соответствующее равновесному
состоянию системы «металл – твёрдофазная
оксидная плёнка – кислород», атм; m
– число атомов металла в молекуле
оксида; n –
валентность металла;
![]() - константа химического равновесия.
- константа химического равновесия.
Протекание реакции возможно только при > .
Более благородным металлом, по сравнению с другими, принято называть металл, имеющий меньшее сродство к окислителю, которое оценивается по величине ΔGT или (Ро2)равн. Чем меньше ΔGT и (Ро2 )равн, тем больше сродство металла к окислителю.
Для предотвращения процесса окисления металлов необходимо создавать такие внешние условия, при которых парциальное давление окислителя не превышало бы равновесного давления при данной температуре.
Однако не следует забывать, что могут протекать, например следующие реакции:
![]() ,
,
![]() ,
,
![]() ,
,
Оксидные пленки на ряде металлов (А1, Cr, Mg, Be и др.) образуются при всех реально достижимых в вакуумных камерах парциальных давлениях кислорода из-за очень низкого значения (Ро2)равн для систем «металл-оксид-кислород».
При окислении металла низшие оксиды в многофазной плёнке всегда является внутренними её слоями.
При окислении сплава слой оксида металла, имеющего большее сродство к окислителю, всегда будет сопряженной фазой с металлической основой, а внешним слоем – оксид более благородного металла.
Таким образом, термодинамические расчёты позволяют определить:
1) будет ли протекать процесс окисления металлического материала;
2) движущую силу этого процесса;
3) наиболее вероятный фазовый состав продуктов взаимодействия металлического материала с окислителем;
4) расположение оксидных слоёв в плёнке.
II. Кинетика высокотемпературного окисления металлов
Несмотря на то, что термодинамика дает возможность определить, насколько изучаемая система отдалена от состояния равновесия, какие продукты взаимодействия твердофазных материалов с окислителем могут образовываться, она не дает ответ на весьма важный и с теоретической, и особенно с практической стороны вопрос: с какой скоростью будет протекать термодинамически возможный коррозионный процесс? Рассмотрением этого вопроса, а также установлением влияния различных факторов на скорость процесса окисления материалов занимается кинетика.
Сплошные пленки являются разделяющим барьером между материалом и газовой средой, а, следовательно, они являются защитными. Образующиеся защитные пленки не прекращают процесс взаимодействия металлической основы с окислителем, т.е. они только в существенной степени замедляют процесс окисления основного металла. Степень защитных свойств оксидных пленок, растущих на поверхности различных твердофазных материалов, существенно отличается. Чем меньше скорость роста пленки, тем больше ее защитные свойства, а, следовательно, выше жаростойкость материала, на поверхности которого растет данная пленка.
Рост толстых защитных плёнок на поверхности материалов при высоких температурах осуществляется в основном за счёт объёмной диффузии1 реагирующих компонентов.
Движущей силой роста тонких пленок является разница электрических потенциалов, реализующихся на границах раздела металлический материал-пленка, пленка-газ. Атомы окислителя, адсорбированные на твердофазной поверхности, захватывают электроны от металла. Устанавливается отрицательный заряд на кислородных ионах и положительный на катионах металла, которые расположены на внешней и внутренней поверхностях раздела фаз соответственно. Под действием большой напряженности поля (более 8∙105 В/м) массоперенос осуществляется за счет миграции заряженных частиц через пленку.
Движущей силой роста толстых пленок является разность химических потенциалов металл (окислитель), реализующихся на границах раздела металлической основы и химического соединения, последнего и газовой среды.
Суммарный процесс роста защитной пленки состоит из следующих отдельных стадий (рис. 1):
а) переход атомов металла в форме ионов и электронов из металлической фазы в пленку:
Ме → Меn+ + ne
б) перемещение ионов Меn+ и электронов в слое пленки;
в) перенос окислителя к внешней поверхности химического соединения через граничный газовый слой;
г) диссоцативная адсорбция окислителя на внешней поверхности химического соединения:
О2 → Ок адс + Ок адс
д) ионизация адсорбированного окислителя:
Ок адс + хе → Окх
е) перемещение ионов окислителя через пленку химического соединения;
ж) реакция образования химического соединения:
хМеn+ + nOкх- → МехОкn
Контролирующей стадией, определяющей скорость окисления металлического материала, является у последовательных стадий (а, в, г, д, ж) наиболее замедленная, а у параллельных (б, е) – та стадия, которая имеет наибольшую скорость протекания.
Знание контролирующей стадии необходимо, чтобы управлять процессом окисления материалов. Остальными стадиями при выявлении механизма окисления материалов можно пренебречь.
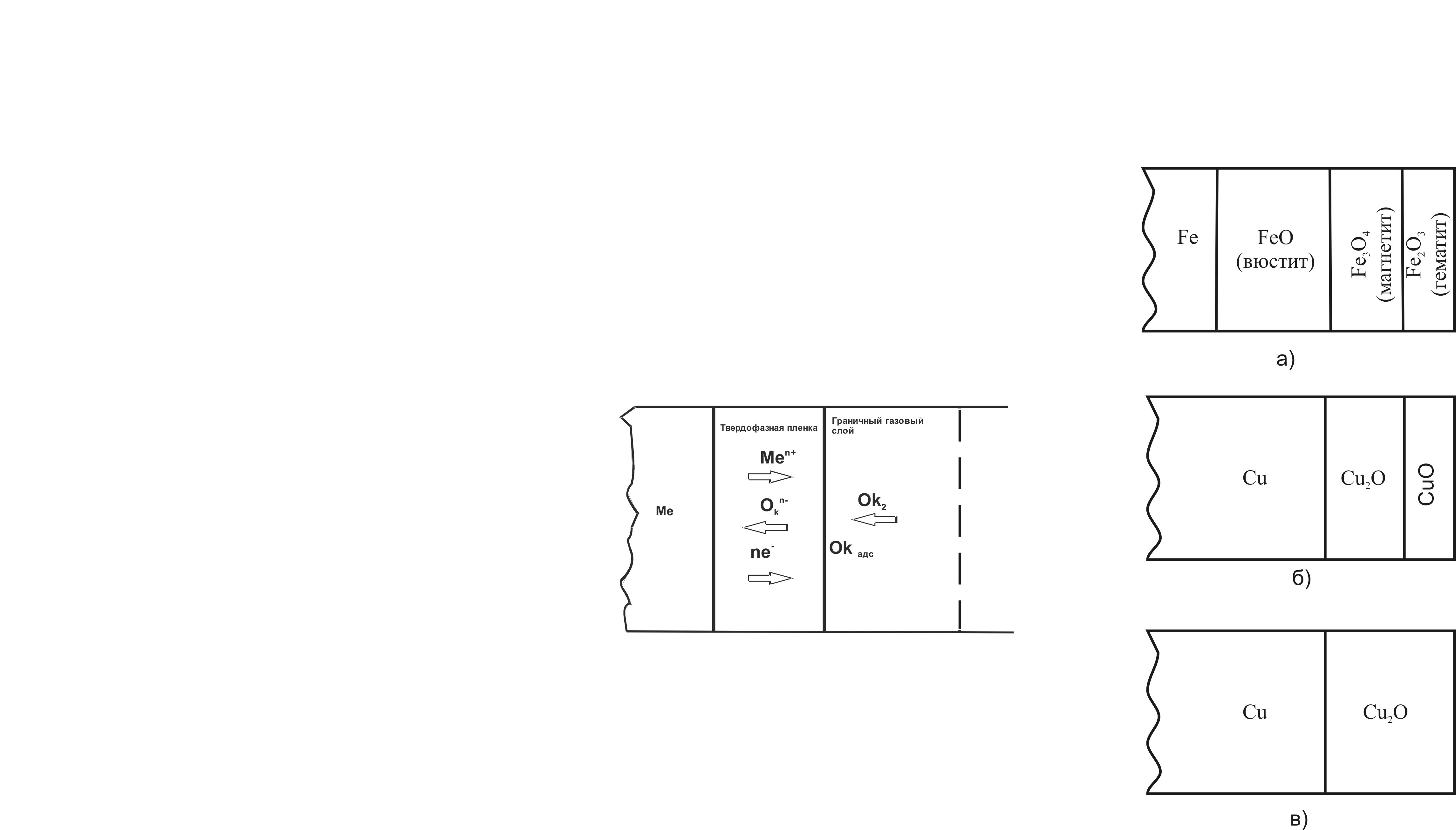
Рис. 1. Схема роста однослойной защитной пленки на металле.
Так как при окислении металлов и сплавов в окислительной газовой среде при высоких температурах на их поверхности формируются нестехиометрические2 ионные соединения, то оксидные пленки классифицируют как полупроводники (n- и p-типа).
К полупроводникам n-типа относятся оксиды с избытком (δ) металла (Меn+δOmn/2) или с недостатком (δ’) кислорода (МеnOmn/2-δ’) по сравнению со стехиометрическим содержанием их в оксиде МеnOmn/2. Для того, чтобы в химическом соединении мог находиться избыточный металл (Ме) или недостаток кислорода по сравнению со стехиометрическим содержанием их в соответствующем оксиде, Вагнер постулировал существование катионов внедрения (Мемm+) или вакансий по кислороду (VO2-q) с компенсирующим для электронейтральности пленок количеством квазисвободных электронов (е-) в зоне проводимости.
Рост защитных толстых пленок из оксидов с избытком металла протекает в основном за счет диффузии катионов металла по междоузлиям, и поэтому реакция образования оксида протекает на границе раздела фаз «оксидная пленка-газ», а рост – с недостатком кислорода происходит в основном за счет диффузии ионов кислорода по вакансиям, и поэтому реакция протекает вблизи границы раздела фаз «металл - оксидная пленка».
Если рост пленки осуществляется при контролирующей стадии диффузии окислителя через оксидную пленку появляются относительно большие механические напряжения, которые могут привести к растрескиванию. Последнее связано с тем, что формирование нового оксида происходит на границе двух твердых фаз, а отношение объема оксида к объему металла, пошедшего на образование этого оксида в ряде случаев больше единицы (Vox/VMe > 1).
К полупроводникам p-типа относятся оксиды с недостатком металла (Men-δ”Omn/2) или с избытком кислорода (MenOmn/2+δ””).
Для того чтобы в химическом соединении мог находиться избыточный кислород или недостаток металла, по сравнению с их стехиометрическим содержанием в соответствующем оксиде, Вагнер постулировал существование анионов внедрения (Oq-м) или вакансий по металлу (Vn-Men+) с компенсирующим для электронейтральности пленок количеством вакансий электронов (V+e-).
Основные кинетические законы окисления металлов
