
3. Залежність поверхневої енергії та поверхневого натягу від параметрів та стану систем
Поверхнева енергія та поверхневий натяг залежать від температури, природи середовищ, що контактують, природи та концентрації розчинених речовин.
Залежність від температури
При підвищеннї температури значення індивідуальних рідин на межі з повітрям лінійно зменшується до температур, близьких до критичної. При критичній температурі зникає різниця між граничними фазами і поверхневий натяг становиться рівним нулю. Для більшості неполярних рідин температурна залежність має вигляд:
Т = 0 – ·Т,
де Т і 0 – поверхневий натяг при температурі Т і за стандартних умов, Т – різниця температур, − стала.
=
−(–![]() ),
),
де – − температурний коефіцієнт.
Але поверхневий натяг є лише частиною повної поверхневої енергії, яка має ще одну складову − звۥязану енергію q, яка візначається за рівнянням Гіббса-Гельмгольца:
q
= Т(–![]() ).
).
Згідно з цим рівінянням, звۥязана енергія збільшується при підвищенні температури.
Повна поверхнева енергія U = q + s не залежіть від температури, оскільки одна її складова збільшується, друга − зменшується при підвищенні температури.
Залежність від природи середевищ
Для рідин неорганічної природи та органічних рідин з симетричною структурою молекул (бензен, ССІ4) величина залежіть від величини сили притягання між молекулами, які, в свою чергу, визначаються їх полярністю.
П = −1/e + 2,
де e − діелектрична проникність середовища.
В той же час, органічні полярні гомологи (кислоти, спирти, аміни) при кількості атомів Карбону > 3 мають стале значення , що зумовлено орієнтацією молекул полярними групами в рідину, а неполярними – в газову фазу.
У системах рідина-рідина (р-р) на величину р-р дуже впливає природа фаз, що межують. Міжфазний натяг є наслідком дії силових полів обох рідких фаз і підкоряється закону адитивності. Виразом цієї закономірності є правило Г.Н. Антонова: поверхневий натяг р-р на межі розділу між двома взаємно малорозчинними рідинами, що знаходяться в рівновазі, дорівнює різниці поверхневого натягу 1 та 2 двох насичених розчинів цих рідин, на межі з паром розчинника:
р-р = 1 – 2,
де 1 і 2 поверхневі натяги насичених розчинів речовини 2 в речовині 1 та речовини 1 в речовині 2.
При зближенні властивостей рідин, що межують, збільшується їх взаємна розчинність і значення міжфазного натягу зменшується. В граничному випадку – при необмеженій розчинності рідин – міжфазна межа зникає.
Якщо молекули однієї з рідин містять одночасно полярні й неполярні групи (наприклад: спирти, аміни, органічні кислоти), то вони здатні орієнтуватись в поверхневому шарі полярною групою в сторону більш полярної фази. В цьому випадку правило Антонова не зберігається.
Радянським вченим Петром Олександровичем Ребіндером було показано, що поверхневий натяг в системах рідина − газ і рідина − рідина визначається різницею полярностей середовищ. Цей висновок формулюють як правило Ребіндера:
Чим більше різниця полярностей фаз, тим більше поверхневий натяг на границі їх поділу.
Залежність поверхневого натягу розчинів від концентрації розчиненої речовини
Поверхневий натяг розчинів, як правило, відрізняється від чистого роз-чинника. Залежність розч =f(Cрозч. реч.) Т = соnst назівается ізотермою поверхневого натягу. Знак похідної d/dС вказує на характер залежності від С. Для водних розчинів розрізняють три основніх типи ізотерми.
Р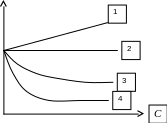 ис.
2. Вплив розчинених речовин на поверхневий
натяг води:
ис.
2. Вплив розчинених речовин на поверхневий
натяг води:
1 – розчин поверхнево- інактивної речовини; 2 − розчин поверхнево-неактивної речовини; 3– розчин полярної органічної речовини; 4 – розчин міцело-утворюючої поверхнево-активної речовини
Крива 2 показує залежність розч =f(Cрозч. реч.) для розбавлених розчинів низькомолекулярних неелектролітів або слабких електролітів. До них відносяться, наприклад, низькомолекулярні цукри − глюкоза, фруктоза, слабкі органічні електроліти з коротким радикалом − мурашина, аміноацетатна кислоти та ін. Поверхневий натяг майже не залежіть від концентрації. Такі речовини називають поверхнево − неактивними (ПІН). Ці речовини рівномірно розподіляються між поверхнею розділу та об’ємом розчину, для них Г = 0.
Крива 1 зображує цю залежність в розчинах сильних неорганічних електролітів − солей, кислот, основ. Іони цих сполук добре гидратуются внаслідок того, що енергія взаємодії між молекулами води й ними більше, ніж між молекулами води (Ен2о-іон> Ен2о-н2о). Внаслідок високої Егідр іони інтенсивно втягуються в глибину розчину. Тому в розчинах сильних електролітів поверхневий шар складається переважно з молекул води та розчроз-ка. Посилення полярних властивостей сприяє збільшенню . Речовини, розчинення яких викликає підвищення поверхневого натягу рідин, називають поверхнево-інактивными речовинами (ПІР). Для ПІР (d/dС) > 0.
Криві 3 і 4 характеризують залежність = f(С) для розчинів органічних речовин, що знижують поверхневий натяг води. Для них характерно негативне значення d/dС.
Речовини, при розчиненні яких знижується поверхневий натяг на границі розділу фаз, називають поверхнево-активними речовинами (ПАР).
Здатність речовини знижувати поверхневий натяг міжфазної поверхні називають поверхневою активністю.
До ПАР відносять органічні сполуки з несиметричною будовою молекул, що складаються з полярних і неполярних груп. Полярна група з досить інтенсивним силовим полем, має спорідненість до полярної фази. Полярні властивості мають такі групи: –СООН, –ОН, –NН2, –NО2, –СНО, –SО2Н та ін. Усі вони здатні до гідратації і є гідрофільними. Неполярною частиною молекул ПАР є гідрофобний вугле-водневий ланцюг або радикал, наприклад, −С6Н13 (гексил), −С8Н17 (октил), –С16Н33 (цетил) –С10Н21 (децил) та ін. Молекули з гідрофільною та гідрофобною групами називають дифільними.
М олекули
ПАР зображують кружком (полярна група)
з прямою чи хвилястою лінією (вуглеводневий
радикал).
олекули
ПАР зображують кружком (полярна група)
з прямою чи хвилястою лінією (вуглеводневий
радикал).
Завдяки дифільній будові молекули ПАР самовільно утворюють орієнтований моношар на поверхні розділу фаз відповідно до умови зменшення енергії Гиббса системи: полярні групи («голови») молекул розташовуються у водяній (полярної) фазі, а гідрофобні радикали («хвости») витісняються з водяного середовища і переходять у менш полярну фазу, наприклад у повітря. Причиною такої орієнтації є те, що енергія взаємодії молекул води більше, ніж з гідрофобними частинами молекул ПАР: Ен2о-ПАР < Ен2о-н2о.
Крива 3 характеризує залежність від С для водних розчинів полярних органічних речовин з вуглеводневими ланцюгами не дуже великої довжини (октил, гексил) і слабкодисоціюючими групами: алифатичних спиртів, амінів, жирних кислот. Для таких речовин зменшення в області малих концентрацій має лінійний характер, а потім йде за логарифмічним законом.
Зараз терміном ПАР позначають речовини з високою поверхневою активністю. Особливо велике практичне значення мають міцелоутворюючі ПАР, наприклад, мила. Всі вони мають довгий гідрофобний радикал (цетил, децил) У розчинах таких сполук з підвищенням концентрації до деякої критичної величини, яка називається критичною концентрацією міцелоутворення (ККМ), можуть самовільно утворюватися міцели – агрегати з орієнтованих молекул. Поверхневий натяг міцелярних розчинів визначається головним чином індивідуальними молекулами ПАР, оскільки міцели майже не знижують розчину. Цим пояснюється різке зниження поверхневого натягу в області концентрацій до ККМ і майже стала величина при міцелоутворенні (крива 4).
Зниження поверхневого натягу в розчинах всіх ПАР зумовлено тим, що полярна група ПАР занурена в полярне середовище, а вуглеводнений радикал знаходиться в неполярній фазі (при цьому система розчинник – ПАР має мінімальну енергію Гиббса). Дифільні молекули ПАР самовільно накопичуються на міжфазних границях, тому їх концентрація в поверхневих шарах завжди значно більше, ніж усередині фаз. Молекули ПАР слабкіше взаємодіють з молекулами води, чим молекули води між собою, тому сумарна стягуюча сила на единицу довжини буде менше і поверхневий натяг розчину знижується в порівнянні з чистою рідиною.
Зниження поверхневого натягу в розчинах при введенні ПАР з недовгим гідрофобним радикалом визначається за допомогою рівняння Шишковського:
0 − = ln(1+bC),
де 0 та − поверхневі натяги чистого розчинника та розчина ПАР, і b − емпіричні константи, C − концентрація ПАР, моль/л. Величина мало залежіть від природи ПАР и дорівнює 0,2 при 20 С. Константа b є мірою поверхневої активности речовини, яка визначається графічним методом. Значення константи b зростає у 3 −3,5 рази при переході до кожного наступного гомологу.
Приклад 2. Розрахувати поверхневий натяг для водних розчинів масляної кислоти для наступних концентрацій (моль/л): 0,007; 0,021; 0,05; 0,104 і побудувати графік розч = f(Cрозч. реч.); розч = 75,510−3 н/м. Константи в рівнянні Шишковського дорявнюють = 12,610−3 і b = 21,5.
Розвۥязання:
і − ?
0 − = ln(1+bC);
і = 0 − 2,3lg(1+bC) = 75,510−3 − 2,312,610−3 lg(1 + 21,5С);
1 = 75,510−3 − 2,312,610−3 lg(1 + 21,50,007) = 0,075 − 0,029lg1,15 = 0,075 − 0,0290,06 = 0,073 н/м.
2 = 0,075 − 0,029lg1,45 = 0,075 − 0,0290,16 = 0,071 н/м.
3 = 0,075 − 0,029lg2,075 = 0,075 − 0,0290,34 = 0,065 н/м.
4 = 0,075 − 0,029lg3,23 = 0,075 − 0,0290,52 = 0,060 н/м.
2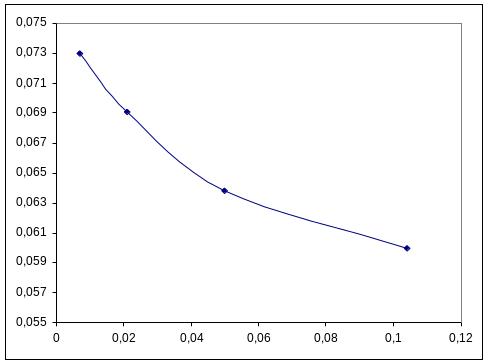 .
графік розч
= f(Cрозч.
реч.)
− ?
.
графік розч
= f(Cрозч.
реч.)
− ?
Поверхневий натяг рідин визначають експериментально. Методи виміру поверхневого натягу на рідких (рухливих) поверхнях розділу підрозділяють на три основні групи: 1) статичні (методи капілярного підняття та лежачої чи висячої краплі); 2) напівстатичні (методи максимального тиску пухирця (краплі), відриву кільця або пластинки; 3) динамічні (методи капілярних хвиль та ін.).
Наприклад, при використанні метода підняття рідини в капілярі користуються рівнянням
= 0,5hrg,
h − висота підняття рідини, м; r − радиіус капіляра, м; g − прискорення вільного падіння, м/с2; − густина рідини, кг/м3.
Для виміру поверхневого натягу індивідуальних рідин придатні всі методи. Для розчинів результати вимірів різними методами можуть сильно відрізнятися через повільне встановлення рівноважного розподілу розчинених речовин між поверхнею й об’ємом розчину. Це особливо відноситься до розчинів міцелоутворюючих і високомолекулярних ПАР (білкові речовини, вищі гомологи мил). Для правильного вибору методу дослідження необхідно враховувати кінетику встановлення рівноважних, тобто найменших, значень поверхневого натягу.
Поверхневий натяг і міжмолекулярні взаємодії усередині фаз зумовлюють капілярні явища, процеси змочування і розтікання краплі рідини на твердій чи рідкій поверхні, а також явища когезії й адгезії.
