
Лекція № 2 Фізико-хімія міжфазних поверхонь в дисперсних системах
Загальні уявлення про поверхневі явища
Природа поверхневої енергії Гіббса. Поверхневий натяг
Залежність поверхневої енергії та поверхневого натягу від параметрів та стану системи
2. Загальні уявлення про поверхневі явища
Явища, що спостерігаються на границі між двома контактуючими фазами в дисперсній системі, називаються поверхневими. Їх можна розділити на дві основні групи:
− явища, що пов’язані зі зміною форми поверхонь розділу (змочування, розтикання, капілярні, адгезія тощо);
– адсорбційні явища, в основі яких лежить зміна складу поверхневого шару.
Причиною поверхневих явищ є особливе розташування молекул в шарах, що безпосередньо прилягають до поверхні розділу. Ці шари різко відрізняються за фізіко-хімічними характеристиками (питомою енергією, густиною, вۥязкостю, електричною провідностю та ін.) від властивостей фаз в глибині їх обۥєму. Відмінності повۥязані з певною орієнтацією молекул в поверхневих шарах і їх іншим енергетичним станом (наявністю надлишку поверхневої енергії) порівняно з молекулами в обۥємі.
Властивості поверхні розділу тим більше впливають на поведінку системи в цілому, чим більше питома поверхня системи. Цим пояснюється домінуюча роль поверхневих явищ у властивостях високодисперсних систем.
Розглянемо дію молекулярних сил на молекулу в глибині та на поверхні рідини на прикладі двофазної системи рідина − газ (повітря). В обۥємах фаз сили взаємного притягання для кожної молекули в середньому однакові у всіх напрямках, повністю скомпенсовані та їх рівнодіюча дорівнює нулю. Це означає, що самовільне переміщення молекул рідини або газу всередині фази в будь-якому напрямку не пов’язане з виділенням або поглинанням енергії.
С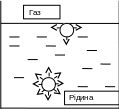 или,
які діють на молекулу в поверхневому
шарі нескомпенсовані, оскільки сумарні
сили притягання в обۥємі
рідини значно більше, ніж в обۥємі
повітря. Притяганням
з боку молекул повітря можна нехтувати,
а рівнодіюча сил для поверхневих молекул
рідини напрямлена вниз перпендикулярно
до
її
поверхні.
или,
які діють на молекулу в поверхневому
шарі нескомпенсовані, оскільки сумарні
сили притягання в обۥємі
рідини значно більше, ніж в обۥємі
повітря. Притяганням
з боку молекул повітря можна нехтувати,
а рівнодіюча сил для поверхневих молекул
рідини напрямлена вниз перпендикулярно
до
її
поверхні.
Рис. 1. Схема виникнення поверхневої енергії
Рівнодіюча сил для поверхневих молекул, віднесена до одиниці площі поверхні називається внутрішнім тиском рідини. Величина внутрішнього тиску рідин, особливо полярних, дуже велика, порядка 108 Па, наприклад, для води він складає 14,8108 Па. Як правило, внутрішній тиск тим більший, чим вища полярність речовини.
Внутрішній тиск втягує молекули рідини з поверхні в глибіну обۥєму, зменшуючи площу поверхні до мінімально можливої за даних умов.
3. Природа поверхневої енергії Гіббса. Поверхневий натяг
Для збільшення поверхні рідини потрібно подолати силу внутрішнього тиску і виконати певну механічну роботу. Отримана енергія зосереджується в поверхневих молекулах і називається вільною поверхневою енергією.
Робота, яку треба здійснити над системою для збільшення поверхні на одиницю площі (1 м2) за оборотних умов називається поверхневим натягом – .
При
Р,Т
= const
–Аоб
= Gпов,
=
![]() =
=
![]() ;
;
при
V,T
= const – Аоб
= Fпов,
=
=
![]() ,
,
де Gпов та Fпов збільшення поверхневої енергії (енергії Гіббса або енергії Гельмгольца).
Таким чином, поверхневий натяг – це питома вільна поверхнева енергія, яка характеризує різницю в інтенсивністі міжмолекулярних взаємодій на міжфазній границі. У твердих тіл вона найчастіше більше, ніж у рідин (табл. 1).
Таблиця 1. Поверхневий натяг деяких речовин на межі з повітрям
-
Речовина
Т,К
·103, Дж/м2
Речовина
Т,К
·103, Дж/м2
Не(р)
3
0,22
Н2О(тв)
270
120,0
N2(p)
80
8,27
Нg(р)
298
473,5
С6Н12(р)
298
17,9
МgО(тв)
298
740
С6Н6(р)
298
282
АІ(тв)
298
1909
НСООН (р)
298
36,6
Fe(тв)
298
39599
Н2О(р)
298
72,0
W(тв)
298
6814
Існує кореляція між поверхневим натягом рідини і теплотою її випаровування. Теплоти випаровування для рідин складають 30÷50 кДж/моль, а − 3,55 кДж/моль, отже, складає 10÷20 % від роботи, що необхідна для повного відривання молекул від рідкої фази.
З термодинаміки відомо, що самовільно протікають процеси, для яких G = ·S < 0 або F = ·S < 0.
Внаслідок великої питомої поверхні всі мікрогетерогенні системи мають величезний запас поверхневої енергії G. Для індивідуальних речовин є сталим, тому самовільно відбуваються процеси, які супроводжуються зменшенням міжфазної поверхні. Саме цим пояснюється кулеподібна форма дрібних краплин рідини, що знаходяться у вільному стані в аерозолях, туманах, емульсіях, злипання твердих частин дисперсної фази (коагуляція), злипання крапель в емульсіях або пухирьків газу в пінах (коалесценція), зростання кристалів, кругла чи овальна форма ягод та плодів.
Приклад 1. Визначити, в скількі разів зменшиться запас вільної поверхневої енергії водяного туману, якщо радіус його крапель збільшиться з 10−6 м до 1,210−3 м при 288 К.
Розвۥязання:
Gۥпов /Gпов − ?
Вважаємо, що краплі сферичної форми, тоді Sпит = 3/r
Gۥпов /Gпов = ·Sۥпит/·Sпит= 3/rۥ: 3/r =1,210−3:10−6 = 1,2103.
Відповідь: вільна енергія туману зменшиться в 1,2103 разів.
