
- •080401.65 «Товароведение и экспертиза товаров»,
- •260902.65 «Конструирование швейных изделий»,
- •Учебно-методическим
- •Предисловие
- •План лабораторных занятий по химии
- •Техника безопасности при работе в лаборатории химии общие правила проведения работ
- •Правила техники безопасности
- •Правила противопожарной безопасности
- •Меры первой помощи при несчастных случаях
- •Лабораторная работа № 1 получение и свойства неорганических соединений
- •Лабораторная работа № 2 молярная масса. Химический эквивалент
- •Лабораторная работа № 3 Основные закономерности протекания химических процессов
- •Лабораторная работа № 4 растворы
- •Лабораторная работа № 5 гидролиз солей. Произведение растворимости
- •Лабораторная работа № 6 Окислительно-восстановительные реакции
- •Лабораторная работа № 7 гальванические элементы. Коррозия металлов
- •Лабораторная работа № 8 электролиз
- •Лабораторная работа № 9
- •Лабораторная работа № 10
- •Часть 1. P-элементы III и IV групп (Алюминий. Углерод)
- •Часть 2. P-элементы V группы (Азот. Фосфор)
- •Часть 3. P-элементы VI группы (Сера)
- •Часть 4. Водород и р-элементы VII группы (Водород. Галогены)
- •Лабораторная работа № 11
- •Часть 1. D-элементы VI и VII групп (Хром. Марганец)
- •Часть 2. D-элементы VIII группы (Железо. Кобальт. Никель)
- •Лабораторная работа № 12 комплексные соединения
- •Лабораторная работа № 13 Поверхностные явления. Дисперсные системы
- •Лабораторная работа № 14 определение качественного и количественного состава веществ
- •Часть 1. Определение качественного состава веществ
- •Часть 2. Определение количественного состава веществ
- •Лабораторная работа № 15 качественный Элементный анализ органических соединений
- •Лабораторная работа № 16 Предельные и непредельные ациклические углеводороды
- •Лабораторная работа № 17 Ароматические углеводороды (арены)
- •Лабораторная работа № 18 Галогенопроизводные углеводородов
- •Лабораторная работа № 19 гидроксильные соединения (спирты. Фенолы)
- •Лабораторная работа № 20 карбонильные соединения (альдегидЫ. КетонЫ)
- •Лабораторная работа № 21 карбоновые кислоты и их производные
- •Лабораторная работа № 22 липиды (жиры и жироподобные соединения)
- •Лабораторная работа № 23 углеводы (моно-, ди- и полисахариды)
- •Лабораторная работа № 24 Азотсодержащие органические соединения
- •Часть 1. Амины, азосоединения
- •Часть 2. Аминокислоты. Белки
- •Лабораторная работа № 25 высокомолекулярные синтетические соединения (полимеры)
- •Приложения
- •1. Единицы измерения физических величин
- •2. Фундаментальные физические постоянные
- •3. Давление насыщенного водяного пара (р) в равновесии с водой
- •080401.65 «Товароведение и экспертиза товаров»,
- •260902.65 «Конструирование швейных изделий»,
- •445677, Г. Тольятти, ул. Гагарина, 4.
Лабораторная работа № 13 Поверхностные явления. Дисперсные системы
Цель работы
Изучение влияния природы адсорбента, адсорбтива и растворителя на адсорбцию; приобретение навыков разделения смеси веществ методами хроматографии; изучение способов получения и свойств коллоидно-дисперсных систем.
Оборудование и реактивы
Воронки, колбы, карандаш, линейка, мерные цилиндры, проекционный фонарь, пробирки, пробиркодержатель, пульверизатор, спички, спиртовка, стеклянные палочки, фильтровальная и хроматографическая бумага, химический стакан.
Активированный уголь (к), каолин / глина (к); дистиллированная вода; растворы: уксусная кислота СН3СООН (50 ммоль/л; 100 ммоль/л; 200 ммоль/л), гидроксид натрия NaOH (0,1 М), аммиак NH3 (конц.), хлорид железа (III) FeCl3 (2%), сульфат алюминия Al2(SO4)3 (конц.), гексацианоферрат (II) калия K4[Fe(CN)6]; водный раствор эозина и метиленового синего, спиртовой раствор метиленового синего; фенолфталеин.
Экспериментальная часть
Опыт 1. Измерение адсорбции уксусной кислоты на активированном угле
В три сухие пронумерованные колбы налейте по 50 мл раствора СН3СООН следующих концентраций: 50 ммоль/л; 100 ммоль/л; 200 ммоль/л. В каждую колбу внесите по 1 г измельченного активированного угля и содержимое колб перемешивайте в течение 20 мин., после чего отфильтруйте через сухие складчатые фильтры. Первую порцию фильтрата объемом 5 мл в каждом случае отбрасывайте. Из каждого фильтрата пипеткой отберите пробу объемом 10 мл, добавьте по 3–4 капли фенолфталеина и титруйте 0,1 М раствором NaOH до появления устойчивого слабо-розового окрашивания. По данным титрования рассчитайте равновесную концентрацию С(СН3СООН) в каждом фильтрате по формуле:
С(СН3СООН) = С(NaOH) • V(NaOH) / V(СН3СООН)
А дсорбцию
рассчитайте по формуле:
дсорбцию
рассчитайте по формуле:
а = 0,05 • (С0 – С)/m,
где С0 – исходная концентрация СН3СООН (ммоль/л); С – равновесная концентрация СН3СООН (ммоль/л); 0,05 – объем СН3СООН, взятой для адсорбции (л); m – масса адсорбента (г).
Постройте график зависимости адсорбции от равновесной концентрации уксусной кислоты (изотерму адсорбции): a = f(C).
Полученные данные запишите в таблицу:
Колба |
С0(СН3СООН), ммоль/л |
V(СН3СООН), мл |
V(NaОН), мл |
С(СН3СООН), ммоль/л |
a, ммоль/л |
1 |
50 |
10 |
|
|
|
2 |
100 |
10 |
|
|
|
3 |
200 |
10 |
|
|
|
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
Опыт 2. Влияние природы адсорбента и адсорбтива на адсорбцию
В одну пробирку поместите немного каолина, в другую – немного активированного угля. В каждую пробирку добавьте по 5 мл водного раствора смеси эозина и метиленового синего. Содержимое пробирок взбалтывайте 2–3 мин. и затем отфильтруйте. Запишите окраску фильтратов.
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
Опыт 3. Влияние природы растворителя на адсорбцию
В одну пробирку налейте 10 мл водного раствора метиленового синего, в другую – такой же объем и равной концентрации спиртовой раствор метиленового синего.
В каждую пробирку внесите на кончике шпателя примерно равную массу активированного угля; содержимое взболтайте и отфильтруйте. Сравните интенсивность окраски фильтратов.
________________________________________________________________________________
________________________________________________________________________________
Опыт 4. Разделение смеси веществ методом бумажной хроматографии
В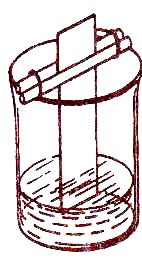 ырежьте
из хроматографической бумаги полоску
2–3 см шириной и 8–10 см длиной. На
расстоянии 1 см от нижнего края по
линейке карандашом проведите тонкую
линию (линия старта).
ырежьте
из хроматографической бумаги полоску
2–3 см шириной и 8–10 см длиной. На
расстоянии 1 см от нижнего края по
линейке карандашом проведите тонкую
линию (линия старта).
В центр линии тонким капилляром нанесите раствор (диаметр пятна 3–4 мм), содержащий катиона Cu2+ и Fe3+. Высушив бумагу на воздухе, закрепите ее с помощью двух соединенных резиновыми колечками стеклянных палочек и опустите в стакан с дистиллированной водой (рис. 8). Глубина погружения полоски бумаги 2–3 мм.
При поднятии воды на высоту 6–7 см выньте полоску из стакана и отметьте карандашом линии подъема растворителя (линия фронта).
В
Рис. 8. Камера для
хроматографирования
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
Опыт 5. Получение золя гидроксида железа (III) методом конденсации
В пробирку налейте 10 мл дистиллированной воды и нагрейте до кипения. В кипящую воду добавляют 5 капель раствора FeCl3 и продолжайте нагревание до появления красно-бурого золя. В соответствии с правилом избирательной адсорбции Панета–Фаянса:
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
схема строения мицеллы:
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
Для наблюдения эффекта Фарадея–Тиндаля через пробирку с золем пропустите луч света проекционного фонаря под углом 90.
________________________________________________________________________________
Опыт 6. Получение золя гидроксида железа (III) методом пептизации (диспергирования)
В пробирку налейте 2 мл раствора FeCl3 и прибавьте по каплям раствор NH3 до полного осаждения Fe(OH)3. Слейте жидкость над полученным осадком и промойте его приливая дистиллированную воду и повторяя декантацию до полного удаления аммиака. К промытому осадку добавьте 5 мл дистиллированной воды и 5–10 капель насыщ. раствора FeCl3, смесь перемешайте 10 мин. Схема строения мицеллы:
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
Наблюдайте, образуется ли эффект Фарадея–Тиндаля:
________________________________________________________________________________
Опыт 7. Коагуляция золя гидроксида железа (III) электролитами
К коллоидно-дисперсным системам, полученным в опытах 5 и 6, добавьте по несколько капель конц. раствора Al2(SO4)3. Коагуляцию, по правилу Шульце–Гарди, вызывают ионы
________________________________________________________________________________
Запишите наблюдения и составьте уравнения реакций. Наблюдайте, образуется ли эффект Фарадея–Тиндаля:
________________________________________________________________________________
________________________________________________________________________________
Вывод: __________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
Контрольные задания
1. Написать формулу мицеллы золя иодида серебра, полученного добавлением 40 мл раствора AgNO3 с концентрацией 0,02 моль/л к 50 мл раствора KI с концентрацией 0,001 моль/л.
2. Написать формулу мицеллы золя гидроксида алюминия, полученного из осадка пептизацией раствором гидроксида натрия.
3. Сравнить свойства коллоидно-дисперсных систем и истинных растворов.
4. Какими воздействиями можно вызвать пептизацию осадка?
5. Перечислить основные применения коллоидных ПАВ.
6. Какой из электролитов Na2SO4 или MgCl2 будет обладать большей коагулирующей способностью для золя иодида серебра, полученного смешением равных объемов раствора иодида калия с концентрацией 0,01 моль/л и раствора нитрата серебра с концентрацией 0,015 моль/л?
7. Какие ионы электролитов Na2SO4 и K3[Fe(CN)6] являются коагулирующими для гидрозоля гидроксида железа (III) полученного методом гидролиза?
8. Воздействием каких факторов можно вызвать коагуляцию лиофобных золей?
9. Что называется кинетической и агрегативной устойчивостью золей?
10. Назвать методы очистки коллоидно-дисперсных систем от примесей: а) растворенных низкомолекулярных веществ, б) грубодисперсных примесей.
11. Описать принцип работы и области применения ультрафильтра.
12. Что такое диализ и для каких целей его применяют. Как устроен простейший диализатор?
13. Что называется границей раздела фаз? По какому принципу классифицируют границы раздела фаз?
14. Объяснить характер влияния природы адсорбента и адсорбтива на адсорбцию.
15. Привести примеры наиболее часто использующихся в практике адсорбентов.
16. Что такое поверхностно-активные вещества? Привести примеры.
17. Что такое поверхностное натяжение?
18. Привести примеры дисперсных систем с жидкой дисперсионной средой.
19. Привести примеры дисперсных систем с газообразной дисперсионной средой.
20. Привести примеры дисперсных систем с твердой дисперсионной средой.
Пример. Может ли образоваться осадок Mg(OH)2, если смешать равные объемы 0,5 М раствора MgCl2 и 0,1 М раствора NaOH?
Решение
При сливании двух равных объемов суммарный объем раствора увеличится вдвое, а концентрация уменьшится вдвое, то есть концентрация раствора MgCl2 будет равной 0,5 / 2 = 0,25 моль/л, а концентрация NaOH – равной 0,1 / 2 = 0,05 моль/л. Mg2+ + 2ОH– Mg(OH) 2 ПР[Mg(OH)2] = [Mg2+][OH–]2 = 5,00 • 10–12 Находим произведение концентраций ионов [Mg2+ ][OH–]2 = 0,25 • 0,052 = 6,25 • 10–4. Сопоставляя полученную величину 6,25 • 10–4 с табличным значением ПР = 5,00 • 10–12, находим, что рассчитанное произведение концентраций ионов превышает ПР[Mg(OH)2], т. е. раствор пересыщен и осадок должен образоваться. |
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
