
- •080401.65 «Товароведение и экспертиза товаров»,
- •260902.65 «Конструирование швейных изделий»,
- •Учебно-методическим
- •Предисловие
- •План лабораторных занятий по химии
- •Техника безопасности при работе в лаборатории химии общие правила проведения работ
- •Правила техники безопасности
- •Правила противопожарной безопасности
- •Меры первой помощи при несчастных случаях
- •Лабораторная работа № 1 получение и свойства неорганических соединений
- •Лабораторная работа № 2 молярная масса. Химический эквивалент
- •Лабораторная работа № 3 Основные закономерности протекания химических процессов
- •Лабораторная работа № 4 растворы
- •Лабораторная работа № 5 гидролиз солей. Произведение растворимости
- •Лабораторная работа № 6 Окислительно-восстановительные реакции
- •Лабораторная работа № 7 гальванические элементы. Коррозия металлов
- •Лабораторная работа № 8 электролиз
- •Лабораторная работа № 9
- •Лабораторная работа № 10
- •Часть 1. P-элементы III и IV групп (Алюминий. Углерод)
- •Часть 2. P-элементы V группы (Азот. Фосфор)
- •Часть 3. P-элементы VI группы (Сера)
- •Часть 4. Водород и р-элементы VII группы (Водород. Галогены)
- •Лабораторная работа № 11
- •Часть 1. D-элементы VI и VII групп (Хром. Марганец)
- •Часть 2. D-элементы VIII группы (Железо. Кобальт. Никель)
- •Лабораторная работа № 12 комплексные соединения
- •Лабораторная работа № 13 Поверхностные явления. Дисперсные системы
- •Лабораторная работа № 14 определение качественного и количественного состава веществ
- •Часть 1. Определение качественного состава веществ
- •Часть 2. Определение количественного состава веществ
- •Лабораторная работа № 15 качественный Элементный анализ органических соединений
- •Лабораторная работа № 16 Предельные и непредельные ациклические углеводороды
- •Лабораторная работа № 17 Ароматические углеводороды (арены)
- •Лабораторная работа № 18 Галогенопроизводные углеводородов
- •Лабораторная работа № 19 гидроксильные соединения (спирты. Фенолы)
- •Лабораторная работа № 20 карбонильные соединения (альдегидЫ. КетонЫ)
- •Лабораторная работа № 21 карбоновые кислоты и их производные
- •Лабораторная работа № 22 липиды (жиры и жироподобные соединения)
- •Лабораторная работа № 23 углеводы (моно-, ди- и полисахариды)
- •Лабораторная работа № 24 Азотсодержащие органические соединения
- •Часть 1. Амины, азосоединения
- •Часть 2. Аминокислоты. Белки
- •Лабораторная работа № 25 высокомолекулярные синтетические соединения (полимеры)
- •Приложения
- •1. Единицы измерения физических величин
- •2. Фундаментальные физические постоянные
- •3. Давление насыщенного водяного пара (р) в равновесии с водой
- •080401.65 «Товароведение и экспертиза товаров»,
- •260902.65 «Конструирование швейных изделий»,
- •445677, Г. Тольятти, ул. Гагарина, 4.
Лабораторная работа № 7 гальванические элементы. Коррозия металлов
Цель работы
Изучение процессов, протекающих в гальванических элементах.
Оборудование и реактивы
Милливольтметр, U-образная трубка, пробирки, химические стаканы, фильтровальная бумага.
Пластинки и кусочки меди, железа, олова, цинка; алюминиевая и медная проволока, стальная пластинка и скрепки; дистиллированная вода, растворы: серная кислота H2SO4 (1 М), хлорид калия KCl (насыщ.) и 1 М сульфат меди (II) CuSO4, сульфат железа (II) FeSO4, сульфат ртути (II) HgSO4, сульфат цинка ZnSO4; ферроксилиндикатор (водный раствор хлорида натрия NaCl, гексацианоферрата (III) калия K3[Fe(CN)6] и фенолфталеина).
Ряд напряжений металлов: Cs, Li, Rb, K, Ba, Sr, Ca, Na, La, Mg, Be, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Cu, Ag, Pd, Hg, Pt, Au
Экспериментальная часть5
Опыт 1. Сравнение химической активности металлов
Поместите кусочки меди и железа в пробирки, заполненные, соответственно 1 М растворами солей железа (II) и меди (II).
________________________________________________________________________________
________________________________________________________________________________
Выпишите значения стандартных электродных потенциалов сравниваемых металлов. ________________________________________________________________________________
________________________________________________________________________________
О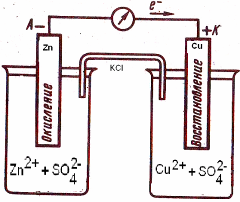 пыт
2.
Гальванический
элемент
пыт
2.
Гальванический
элемент
В два стакана налейте равные объемы 1 М растворов ZnSO4 и CuSO4. Растворы соедините жидкостным мостиком (марлевый жгутик в стеклянной трубке, смоченный раствором KCl).
Погрузите пластинки цинка и меди в растворы ZnSO4 и CuSO4 соответственно, а затем присоедините к гальванометру (рис. 5).
О
Рис. 5. Схема
гальванического элемента
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
Опыт 3. Выявление микрогальванопар при коррозии стали
На стальную пластинку положите полоску фильтрованной бумаги, смоченную раствором ферроксилиндикатора. Через 30 мин. бумагу снимите и наблюдайте анодные («турнбулева синь») и катодные участки (розовая окраска фенолфталеина).
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
Опыт 4. Влияние образования гальванических пар на течение хим. процессов
В пробирку с 1–2 мл 1 М раствора H2SO4 внесите кусочек цинка. Медной проволокой коснитесь кусочка цинка в пробирке. Объясните изменение интенсивности выделения водорода и на каком из металлов он выделяется? Каково направление перехода электронов в паре Zn–Cu?
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
Опыт 5. Контактная коррозия
В три пробирки налейте по 2–3 мл 1 М раствора H2SO4 и по 2–3 капли раствора K3[Fe(CN)6]. В первую пробирку опустите конторскую стальную скрепку со вставленным в нее кусочком меди, во вторую – скрепку с кусочком олова и в третью – скрепку с кусочком цинка.
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
На основании проведенных опытов и теоретических предпосылок, отметьте, какой из металлов (медь, олово или цинк) лучше защищает железо от коррозии.
Опыт 6. Коррозия амальгамированного алюминия
Кусок алюминиевой проволоки (5–6 см) внесите наполовину в раствор HgSO4 на 1–2 мин. Вынутую из раствора проволоку промойте водой и слегка оботрите фильтровальной бумагой. Через несколько минут образовавшийся Al(OH)3 снимите фильтровальной бумагой и погрузите проволоку целиком в пробирку с водой. Сравните отношение к воде участка проволоки, с которого снята оксидная пленка, участка, на котором сохранился защитный слой оксида алюминия.
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
Вывод: _________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
Контрольные задания
1. Цинковые пластинки погружены в растворы солей NaCl, NiСl2, MgSO4, Pb(NO3)2. В каких случаях будет протекать реакция вытеснения цинком других металлов?
2. Найти знаки электродов, образованных стандартными электродами:
Mg|Mg2+||Al3+|Al; Sn|Sn2+||H+|½H2; Ag|Ag+||Au3+|Au
3. Составить схемы двух гальванических элементов, в одном из которых цинк являлся катодом, в другом – анодом. Написать уравнения реакций, происходящих при работе этих элементов и вычислить стандартные значения э.д.с.
4. Составить схемы двух гальванических элементов, в одном из которых алюминий являлся катодом, в другом – анодом. Написать уравнения реакций, происходящих при работе этих элементов и вычислить стандартные значения э.д.с.
5. Какие реакции протекают у электродов, образованных железом и оловом, погруженных в растворы хлоридов двухвалентных металлов, которые соединены солевым мостиком?
6. Какие реакции протекают у электродов, образованных магнием и цинком, погруженных в растворы хлоридов двухвалентных металлов, которые соединены солевым мостиком?
7. Составить схемы двух гальванических элементов, в одном из которых медь являлась катодом, в другом – анодом. Написать уравнения реакций, происходящих при работе этих элементов и вычислить стандартные значения э.д.с.
8. В каком направлении будут перемещаться электроны во внешней цепи следующих гальванических элементов: а) Mg|Mg2+||Pb2+|Pb; б) Pb|Pb2+||Cu2+|Cu; в) Cu|Cu2+||Ag+|Ag, если все растворы электролитов одномолярные? Какой металл будет растворяться в каждом из этих случаев?
9. Как изменится э.д.с. гальванического элемента Pb|Pb2+|| Ag+|Ag, если в раствор, содержащий ионы свинца, добавить сероводород?
10. Можно ли в водном растворе восстановить соль железа (III) до соли железа (II): а) бромидом калия; б) иодидом калия?
12. Можно ли восстановить олово (IV) в олово (II) с помощью приведенных ниже реакций? Ответ обосновать расчетом констант равновесия реакций.
а) SnCl4 + 2КI = SnCl2 + I2 + 2КСl
б) SnCl4 + Н2S = SnCl2 + S + 2HСl
13. Никелевые пластинки опущены в водные растворы перечисленных ниже солей. С какими солями никель будет реагировать: а) MgSO4; б) NаСl; в) CuSO4; г) АlСl3; д) ZnCl2; е) Pb(NO3)2?
14. Между какими из перечисленных ниже взятых попарно веществ (металл + водный раствор электролита) будет протекать реакция замещения: а) Fe + HCl; б) Ag + Cu(NO3)2; в) Сu + НСl; г) Zn + MgSO4.
15. Водный раствор Н2S обладает восстановительными свойствами. Какие из перечисленных ионов можно восстановить этим раствором: а) Fe3+ до Fe2+; б) Cu2+ до Сu+; в) Sn4+ до Sn2+?
16. Бромная вода (раствор брома в воде) – часто используемый в лабораторной практике окислитель. Какие из перечисленных ионов можно окислить бромной водой: а) Fe2+ до Fe3+; б) Сu+ до Сu2+; в) Мn2+ до МnO4–; г) Sn2+ до Sn4+?
17. На раствор сульфата меди (II) действуют хлоридом калия или иодидом калия. В каких случаях медь (II) будет восстанавливаться до меди (I)?
18. Какие из приведенных реакций могут самопроизвольно протекать при действии водного раствора перманганата калия на серебро?
а) МnО4– + Аg = МnО42– + Аg+; б) МnО4– + 8H+ + 5Аg = Мn2+ + 5Аg+ + 4H2O.
19. Какие из приведенных реакций могут самопроизвольно протекать в нейтральном водном растворе?
а) МnО4– + Cl– = МnО2 + Cl2
б) МnО4– + Br– = МnО2 + Br2
в) МnО4– + I– = МnО2 + I2
20. Какие из приведенных ниже реакций могут протекать самопроизвольно?
а) H3PO3 + SnCl2 + H2O = 2HCl + Sn + H3PO4
б) H3PO4 + 2HI = H3PO3 + I2 + H2O
в) H3PO3 + 2AgNO3 + H2O = 2Ag + 2HNO3 + H3PO4
Пример. В каком направлении будут перемещаться электроны во внешней цепи при работе гальванического элемента Ag|AgNO3(0,001M)||AgNO3(0,1M)|Ag. Определите э.д.с. этого элемента?
Решение
Стандартный электродный потенциал системы Ag+/Ag равен 0,80 В. Обозначив потенциал левого электрода через φ1, а правого – через φ2, находим:
φ1 = 0,80 + 0,059 lg 0,001 = 0,80 + 0,059(−3) = 0,62 B
φ2 = 0,80 + 0,059 lg 0,1 = 0,80 − 0,059(−1) = 0,74 B
Вычисляем э.д.с. элемента:
E = φ2 − φ1 = 0,74 − 0,62 = 0,12 В
Поскольку φ1 < φ2, то левый электрод будет служить отрицательным полюсом элемента и электроны перемещаются во внешней цепи от левого электрода к правому.
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
