
- •Характеристика объектов окружающей среды
- •Химический состав, классификация и некоторые особенности природных вод
- •Состав поверхностых вод суши
- •Характерные интервалы концентрации биогенных элементов в поверхностных водах суши (в скобках пдк, мг/л)
- •Зависимость содержания nh3 от рН воды при разных температурах
- •Состав подземных вод
- •Состав воздуха и атмосферных осадков
- •Химический состав почв.
- •Группы водосборной площади Днепра
- •Химический состав донных отложений
- •Общая схема анализа и основные этапы
- •Характеристика методов анализа
- •Особенности анализа воздуха
- •Отбор проб
- •Подготовка проб к анализу.
- •Особенности анализа почв и донных отложений.
- •Отбор проб и их подготовка к анализу
- •Основные этапы анализа
- •Особенности анализа природной воды. Виды проб и техника их отбора
- •Отбор проб с водных объектов
- •Консервация, транспортировка и хранение проб воды
- •Определение химических ингредиентов в растворённом состоянии, коллоидно-дисперсной форме и взвесях
- •Концентрирование микрокомпонентов
- •Зависимость количества экстракций n для 99 % извлечения веществ от коэффициента разделения (d) и кратности концентрирования (vвод./vорг.)
- •Удаление веществ, которые мешают анализу
- •Автоматизация анализа природных вод
- •Статистическая обработка результатов анализа
- •Зависимость t от n при различных р
Характерные интервалы концентрации биогенных элементов в поверхностных водах суши (в скобках пдк, мг/л)
-
Feобщ
0,1 – 2
Siобщ
1 – 10
Рорг
0,01 – 0,2
(не установл.)
Рнеорг
0,01 – 5
(не установл.)
Nорг
0,2 – 2
(не установл.)
NO3-
0 – 2
(10,0)
NO2-
0 – 0,5
(1,0)
NH4+ + NH3
0,02 – 1,5
(NH4+ - 2,0; NH3 – 0,08)
Наименее стойкой формой азота в условиях природных вод являются ионы NO2-, которые в зависимости от рН, Еh, концентрации О2 и активности водных бактерий, легко окисляются в NO3- или восстанавливаются в NН4+. Увеличение концентрации NO2- и особенно NН4+ является одним из признаков загрязнения природных вод.
Неорганические формы азота при больших концентрациях проявляют токсичные действия. При этом особую токсичность проявляет аммиак NH3, ПДК которого является наиболее низкой среди всех форм неорганического азота.
Соотношение между содержанием NH3 и значительно менее токсичными ионами NН4+ зависит от рН и температуры воды (табл. 3). Из таблицы видно, что при повышении общей концентрации аммонийного азота скопление значительного количества особенно токсичных для рыб NH3 можно ожидать при рН ≥ 9 и при высоких t.
Таблица 3
Зависимость содержания nh3 от рН воды при разных температурах
t 0C |
pН |
||
6 |
8,5 |
10 |
|
25 |
0,05 |
13,4 |
83,1 |
15 |
0,02 |
6,7 |
70,1 |
5 |
0,01 |
3,3 |
51,7 |
Источниками поступления соединений азота в природные воды являются минеральные удобрения и дожди, которые смывают их с почвы.
В дождевой воде содержатся также продукты окисления азота электрическими разрядами в атмосфере и промышленные азотосодержащие газовые выбросы. Значительное количество соединений азота попадает также в природные воды с коммунально-бытовыми стоками.
Уменьшению концентрации неорганических соединений азота в природных водах способствует процесс денитрификации, который происходит при недостатке О2 и при наличии безазотистых органических соединений типа клетчатки, крахмала и т.д. На их окисление расходуется О2 нитратов и при этом азот выделяется в свободном состоянии.
4NO3- + 5C + 2H2О → 2↑N2 + ↑CO2 + 4 HCO3- (5)
Фосфор содержится в природных водах также в виде неорганических и органических (Рорг.) соединений. Концентрации этих соединений практически одинаковы, хотя их уровень значительно ниже, чем концентраций соединений азота (Табл. 2).
В отличие от азота, который содержится в водах в степенях окисления – 3, +3 и +5, фосфор проявляет степень окисления только + 5, т.е. неорганические соединения Р можно рассматривать как производные ортофосфорной кислоты или продуктов её конденсации. Поступают соединения Р в природные воды в процессе жизнедеятельности гидробионтов и при минерализации их остатков. Концентрация Р уменьшается вследствие употребления его соединений водными растениями. Эти процессы можно отобразить схемой
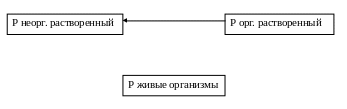
Важным антропогенным источником поступления неорганического Р (ортофосфатов, полифосфатов) в поверхностные воды суши являются смывание фосфорсодержащих удобрений дождём с с/х угодий, а также сточные воды прачечных комбинатов, что содержат соединения Р в составе моющих средств.
В зависимости от рН природной воды, ортофосфаты содержатся в ней в основном в форме ионов H2PO4- и HPO42- , часть которых при изменении рН от 5 до 10 изменяется от 97,9 % до 0,05 % и от 1,9 % до 99,6 % соответственно. Однако такая смена соотношения между различными формами Рнеорг. не влияет на результаты его определения наиболее распространённым фотометрическим методом в виде фосфорномолибденовой гетерополикислоты. Это обусловлено тем, что анализ выполняют в очень кислой среде, в которой в результате сдвига равновесия диссоциации ортофосфаты переходят в молекулы Н3РО4.
Кремний является постоянным компонентом природных вод, что связано с его присутствием в составе разнообразных минералов, с которыми контактируют воды. В поверхностных водах суши Si содержится в основном в виде мономерной малодиссоциирующей ортокремниевой кислоты H2SiO3 и поликремниевых кислот, а также в коллоидном состоянии X × SiO2 × УН2О, который часто является доминирующим. Содержание соединений кремния в поверхностных водах суши (табл. 2) ~ соответствует растворимости мономерной ортокремниевой кислоты, которая составляет ~ 6 мг/л. Значительное уменьшение концентрации соединений кремния, особенно в вегетационный период, свидетельствует о его интенсивном употреблении водными организмами. Многие из них строят свой скелет из кремния. Кроме того, кремниевая кислота как наиболее слабая может вытесняться из воды более сильной угольной кислотой.
Определение Si, аналогично Р, базируется на реакциях образования гетерополикислот. Поэтому Si, содержание которого в природных водах значительно превышает содержание Р, может мешать определению последнего.
Железо в виде растительных соединений, коллоидов и суспензий поступает в поверхностные воды суши вследствие химического выветривания горных пород, которое сопровождается их механическим разложением и растворением. Значительные количества соединений железа поступают также с подземными стоками и с сточными водами предприятий металлургической и металлообрабатывающей промышленности. С другой стороны, в природных водах происходят биологические и физико-химические процессы, которые сопровождаются употреблением водными растениями соединений железа и его осаждения в виде, в основном, гидроксида Fe(OH)3.
В состав неорганических и органических соединений природных вод Fe может входить при степенях окисления + 2 или + 3. Соединения Fe (+ 2) образуются при низких значениях рН и Еh, когда доминируют процессы деструкции органических соединений и вода обедняется на содержание растворённого О2. Такие условия возникают в природных слоях воды, особенно зимой во время замерзания. Fe (+ 2) в таких условиях содержится в форме Fe2+, [FeOH]+, [FeCO3]0 и комплексных соединений с органическими веществами. Соотношение этих форм зависит от рН воды и концентрации неорганических и органических лигандов.
Fe (+ 2) необходимое в организме человека для синтеза гемоглобина (суточная потребность 5 – 20 мг) и токсичное действие его не выявлено. Однако при содержании ионов Fe2+ > 0,5 мг/л вода приобретает своеобразный металлический вкус, поэтому его присутствие в водах является нежелательным.
При повышении рН и Еh железо (+ 2) окисляется растворённым в воде кислородом до Fe (+ 3), поэтому более характерной для поверхностных вод суши с рН ≥ 6 и Еh > 200 – 300 мВ является наличие соединений Fe (+ 3). В соответствии с расчётами с использованием ПР Fe(OH)3 и констант стойкости растворённых гидрокомплексов состава [FeOH]2+, [Fe2(OH)2]4+, [Fe(ОН)3]0 практически все Fe при этих условиях должно быть связано в гидрокомплекс [Fe(ОН)3]0 и его концентрация не может превышать 0,017 мг/л. Однако по данным рис. 6 выплывает, что для поверхностных вод суши характерной является более высокая концентрация железа, которая может достичь 2 мг/л и даже больше, особенно в летний период. Это свидетельствует о связывании ионов Fe (+ 3) в хорошо растворимые комплексы в органическими лигандами. Данные табл. 4 свидетельствуют о том, что в водах Fe3+ бывает в форме комплексов с лигандами молекулярной массы около 10 тыс.
Таблица 4
Средняя степень связывания Fe (+ 3) в комплексные соединения в природных водах
Молекулярная масса комплексов, тыс |
≥ 100 |
100 - 10 |
10 - 1 |
≤ 1 |
связывание |
29,0 |
32,7 |
25,3 |
13,0 |
Связывание ионов Fe (+ 3) в стойкие комплексы с органическими лигадами часто мешает количественному определению его валового содержания, особенно фотометрическими и кинетическими методами. Поэтому для правильных результатов Fe необходимо определять по возможности в сильнокислых растворах, где его комплексы с органическими соединениями природных вод разрушаются. Значительно лучше перед определением Fe разрушить органические соединения методом «мокрого сжигания» или дихотомическим окислением.
В данных на табл. 2 видно, что только общее содержание Fe и NH3 могут превысить ПДК.
Микроэлементы. К этой группе относятся соединения металлов и некоторых неметаллов (Br, J, B), содержание которых в поверхностных водах суши обнаруживается в пределах нескольких десятков и меньше мкг/л (табл. 5). Некоторые из них – Mn, Zn, Cu, Mo и Co входят в состав так называемых биометаллов, которые являются катализаторами и составными частями биохимических процессов в организме человека, животных и растений и без которых живые существа не могут развиваться. Так, например, ионы Mn2+ которые всегда присутствуют в природных водах, берут участие в биоциклах. Недостаток Mn в организме человека приводит к деформации костей и хрящей и нарушает функцию сворачиваемости крови. Суточная потребность Mn для человека составляет 2 – 9 мг. Ионы Zn также играют важную роль в организме человека. Все жизненные процессы на уровне клеток в той или иной мере зависят от наличия ионов Zn. Недостаток Zn в организме приводит к выпадению волос, потере аппетита, появлению ревматизма и в целом ослаблению иммунитета. Суточная потребность Zn для человека составляет 15 мг.
Таблица 5
Содержание микроэлементов в поверхностных водах суши и биометаллах
Объекты |
Микроэлементы |
Содержание, м кг/л |
ПДК |
Промышленные загрязнения |
Cd |
≤ 0,0001 |
(0,01) |
Pb |
0,0001 – 0,005 |
(0,1) |
|
Cr |
0,0001 – 0,005 |
(0,1) |
|
Ni |
0,0005 – 0,01 |
(0,1) |
|
Биометаллы |
CO |
0,0001 – 0,01 |
(0,1) |
Mo |
0,0005 – 0,01 |
(0,5) |
|
Cu |
0,002 – 0,05 |
(0,1) |
|
Zn |
0,003 – 0,10 |
(1,0) |
|
Mn |
0,002 – 1,0 |
(1,0) |
Другие микроэлементы: Cd, Pb, Hg, Cr и т.д. являются антропогенными загрязнителями и проявляют сильные токсичные свойства. Например, ионы Pb2+, которые поступают в воду в результате геологических процессов, а также с выхлопными газами автомобилей и свинецсодержащих трубопроводов и аппаратуры, особенно при длительном контакте с водами являются особенно токсичными для кроветворных энзимов и нарушают деятельность нервной системы. Аналогично Hg2+ свинец нарушает работу желудка и лёгких, накапливается в костях, центральной нервной системе и волосе. При содержании Pb в крови уже 0,4 мг/л выявляются симптомы отравления. Особенно опасными для жизни являются микроконцентрации радионуклидов Sr, Ce, Pl и др. радиоактивных элементов. Необходимо отметить, что биометаллы при превышении ПДК также являются токсичными для водных организмов и др. живых существ.
В природных водах значительная часть микроэлементов входит в состав взвесей и коллоидов, в результате чего при увеличении мутности воды их количество в взвесях и коллоидах увеличивается и может достичь 100 %. При этом в состав взвесей входят преимущественно катионы металлов, которые способны образовывать малорастворимые оксиды, например, MnO2, а также гидроксиды, например свинца, Co, Ni, Cu и др. Амфотерные элементы, которые в природных водах содержатся в виде анионов, например МоО42-, и анионы неметаллов адсорбируются на взвесях хуже. При повышении рН воды сорбция микроэлементов увеличивается, однако взвеси разной химической природы и степени дисперсности выявляют неодинаковые сорбционные особенности относительно разных элементов.
По химическому составу растворенные формы микроэлементов в водах могут быть достаточно разнообразными. Так, в зависимости от рН воды и концентрации неорганических и органических лигандов в растворе могут быть незакомплексованные ионы металлов, гидроксокомплексы, карбонатные, сульфатные и хлоридные комплексы, а также координационные соединения ионов металлов со многими органичными лигандами. Некоторые из доминирующих форм, содержание которых может превышать > 1 % являются расчетными с использованием констант стойкости комплексных соединений и отвечают наиболее характерным для природных вод концентрациям лигандов.
В водах для большинства ионов металлов – микроэлементов, кроме ионов Mn, наиболее характерным является комплекс с органическими лигандами. В этом аспекте особенно выделяется Hg, которая практически полностью, более чем на 99 % связана в сульфатные и гуматные комплексы. Значительная часть металлов связывается в карбонатные и гидрокарбонатные комплексы. Вхождение металлов в состав назакомплексованных катионов и гидрокомплексов является менее характерным.
Для марганца, в отличие от других металлов, наиболее распространёнными формами в поверхностных водах суши являются аква-ионы Mn2+ и комплексы состава [MnCO3]0 и [Mn(ФК)n]z-, причем соотношение между этими формами зависит от рН воды. И действительно, в зимне-весенний период, когда интенсивность фотосинтеза незначительная в воде увеличивается содержание СО2, что приводит к снижению её рН, соответственно доминирующей формой являются ионы Mn2+ и их концентрация может даже превысить ПДК. Наоборот, в тёплое время года в условиях интенсивного фотосинтеза рН воды увеличивается и при этом ионы Mn2+ окисляются растворённым в воде О2, что приводит к осаждению MnO2.
Комплексные соединения микроэлементов с органическими лигандами природных вод характеризуются высокими молекулярными массами (табл.6). Однако распределение ионов металлов между комплексами с лигандами различной молекулярной массы неодинаковы. Так например, для ионов Hg (II) характерным является образование комплексов с молекулярной массой < 10 тыс., для ионов Pb > 10 тыс, а комплексы других микроэлементов имеют наиболее характерные молекулярные массы от 1 до 100 тыс.
Комплексные соединения ионов металлов с органическими лигандами природных вод являются достаточно стойкими и характеризуются константами стойкости в пределах 104 - 1012. Крепкое связывание ионов металлов в комплексы с органическими веществами – лигандами природного происхождения часто мешает их количественному определению. Поэтому для получения надёжных результатов при определении валового содержания ионов металлов в водах органические соединения необходимо заблаговременно уничтожить. Однако отдельные формы микроэлементов можно определить специальными методами без непосредственного уничтожения органических соединений.
Таблица 6
Молекулярные массы комплексных соединений микроэлементов
Микрокомпонент |
Молекулярная масса, тыс. |
|||
> 100 |
100 - 10 |
10 – 1 |
< 1 |
|
Mn2+ |
15,1 |
26,3 |
31,0 |
27,6 |
Cu2+ |
15,0 |
23,2 |
43,8 |
18,0 |
Cd2+ |
25,7 |
22,7 |
14,0 |
37,6 |
Pb2+ |
36,7 |
30,6 |
15,2 |
17,5 |
Hg2+ |
5,7 |
6,4 |
43,6 |
44,3 |
Следует заметить, что определение концентраций отдельных форм ионов металлов в природных водах имеет важное эколого-токсикологическое значение. На многих примерах установлено, что токсичность незакомплексованных ионов и гидроксокомплексов тяжелых металлов для гидробионтов значительно выше, нежели токсичность их комплексных соединений с другими лигандами, особенно с высокомолекулярными органическими соединениями природного происхождения (гумусовыми веществами).
В то же время токсичность металлоорганических соединений, например триметилхлорид олова, диэтилхлорид свинца и т.д., значительно выше, за токсичность незакомплексованных ионов этих металлов. В связи с этим возникает серьёзная проблема, относительно взаимосвязи между ПДК ионов металлов, установленными путём действия неорганических солей металлов на биологические тест - объекты, и общим содержанием этих металлов в природных водах. Очевидно, что нормы ПДК для тяжёлых металлов являются в полной мере условными, потому, что в реальной природной воде концентрация токсичных форм и интенсивность их действия на гидробионты может быть не адекватной параметрам, установленным в исследованиях с простыми солями металлов.
Органические вечества. Кроме неорганических веществ, растворены и суспендированы органические соединения природного и антропогенного происхождения и являются неотъемлемыми компонентами природных вод и играют важную роль в формировании их химического состава. Как показано выше, природные органические вещества являются одним из основных источников нахождения в природных водах неорганических форм азота и фосфора, без которых существование и развитие водных организмов невозможно. С другой стороны, сами органические соединения также употребляются гидробионтами и выделяются в воду в процессе их жизнедеятельности и отмирания. Много органических соединений природных вод способны образовывать и ионами металлов стойкие комплексы и этим сами способствуют их переходу в растворимые формы, которые доступны для употребления гидробионтами. Особенную роль в этих процессах играют гуминовые и фульвокислоты, которые хорошо вымываются водой с донных грунтов.
Много органических соединений различных классов поступают в природные воды со сточными водами предприятий органического синтеза, а также с коммунально-бытовыми и с/х стоками. Такие соединения, особенно отходы химических производств, часто являются очень токсичными и их содержание в природных водах необходимо тщательно контролировать.
Несмотря на особое значение органических соединений для формирования качества природных вод, методы их контроля разработаны значительно хуже, нежели для главных ионов. Поэтому характеристика состава природных вод по содержанию органических соединений в целом является менее содержательной, чем по содержанию других ингредиентов.
Содержание органических соединений в поверхностных водах суши можно охарактеризовать тремя группами показателей.
Первая группа показателей адекватна сумме всех органических соединений природных вод или сумме отдельных классов таких соединений. Это интегральные показатели. При этом содержание органического вещества выражают в форме Сорг., т.е. связанного органического углерода в мг/л. В очевидном большинстве органических соединений природных вод С составляет ~ 50 % их массы, поэтому величину Сорг. умножают на 2 и находят содержание органического вещества (мг/л). В поверхностных водах суши содержание С орг. в зависимости от типа водного объекта (речка, водохранилище, озеро и т.д.) и времени года составляет от 1 – 2 до 30 – 50 мг/л. Органическое вещество природных вод характеризуют также другими показателями – содержанием органического азота (Nорг.) и органического фосфора (Рорг.). Наиболее распространённые значения этих показателей приведены в табл. 2:
Nорг. = 0,2 – 2 мг/л.
Рорг. = 0,01 – 0,2 мг/л.
К другой группе показателей, которые характеризуют органическое вещество природных вод, входят наиболее распространённые органические соединения природного происхождения. Сред них необходимо назвать гуминовые и фульвокислоты, белковоподобные соединения, свободные и связанные аминокислоты, амины, карбоновые и оксикарбоновые кислоты, карбонильные соединения, сложные эфиры, и углеводные. Наиболее характерные концентрации этих соединений в поверхностных водах суши приведены в таблице 7. Для удобства сравнение концентраций белковоподобных веществ, аминокислот и аминов (мкг N/л), а также органических кислот и сложных эфиров, которые выражают в микромолях экв/л., пересчитано и дано в табл. 7 в мг С/л. Такой просчёт даёт приблизительные результаты, поскольку различные органические соединения имеют различную молекулярную массу, а процентное содержание N2 и С в них также не одинаково. Например, для белков и аминокислот белкового происхождения мг С/л = 1,7 мг N/л, а для аминов мг С/л = 3,4 мг N/л. Для алифатичных карбоновых кислот С2 – С7, которые наиболее распространены их этого класса соединений в поверхностных водах суши, средняя молекулярная масса составляет М = 95, а среднее содержание углерода составляет 55 %, поэтому мг С/л = С моль/л × 95 × 1000 × 55 / 100 = = С моль/л × 5,2 × 104.
Таблица 7
Характерные интервалы концентраций органических соединений природного происхождения в поверхностных водах суши в мг С/л.
I |
Карбонильные соединения |
0,02 – 2 |
II |
Сложные эфиры |
0,5 - 8 |
III |
Органические кислоты |
0,5 – 15 |
IV |
Углеводные |
0,1 – 2 |
V |
Сахарные |
0,05 – 2 |
VI |
Амины |
0,03 – 3 |
VII |
Свободные аминокислоты |
0,04 – 0,5 |
VIII |
Связанные аминокислоты |
0,04 – 5 |
IX |
Белки |
0,02 – 5 |
X |
Фульвокислоты |
0,5 – 10 |
XI |
Гумиковые кислоты |
0,02 – 2 |
Для сложных эфиров зависимость примерно такая. Содержание других органических веществ в воде, которые приведены в табл. 7, выражают в мг С/л. Несмотря на приближенный характер этих данных, можно сделать вывод, что основную массу органических веществ незагрязнённых и слабозагрязнённых поверхностных вод суши составляют карбоновые кислоты, гумусовые вещества, сложные эфиры и карбонильные соединения (1,5 – 30 мг С/л). Сумма других органических соединений природного происхождения значительно меньше и составляет 0,2 – 12 мг С/л
Третью группу показателей органических веществ природных вод составляют соединения антропогенного происхождения, содержание которых в первую очередь зависит от интенсивности загрязнения вод и изменяется в очень широких пределах – от аналитического нуля до нескольких мг/л. Среди наиболее важных групп органических соединений антропогенного происхождения, для которых разработаны надёжные аналитические методы определения на уровне ПДК, следует назвать ароматические углеводороды (бензол, толуол, стирол, фенолы, нафталин и т.д.) галогенорганические соединения (хлороформ, дихлорэтан, дихлофос и т.д.), азотсодержащие соединения (амины, пиридиновые основы, полиакриламид, капролактан и т.д.), органические кислоты, метанол, бензиловый спирт, бензилацетат, масла, нефтепродукты, красители, синтетические ПАВы и т.д. Количество органических соединений различных классов, что попадают в природные воды со сточными водами промышленных предприятий, с/х комплексов и коммунально-бытовых учреждений, постоянно возрастает и определение их содержания в природных экосистемах является одним из сложных заданий экологического мониторинга.
