
- •Список сокращений
- •Содержание
- •Часть 1. Понятие о малых дозах радиации ......................................14
- •Часть 2. Радиационно-индуцированная нестабильность генома (ринг) и малые дозы радиации ………...............................75
- •Предисловие
- •От автора
- •Часть 1. Понятие о малых дозах радиации
- •1.1. Большое, малое и низкое
- •1.2. Микродозиметрическая теория «малых доз» радиации
- •1.2.1. Чувствительные мишени (“sensitive volume”) биологических систем
- •1.2.2. Разработка понятия о малых дозах радиации в микродозиметрии. Конкретные величины малых доз для излучений с различной лпэ
- •1.2.3. Целесообразность использования микродозиметрических построений о малых дозах радиации в практике радиобиологии и радиационной медицины
- •1.3. Радиобиологический подход к понятию «малые дозы» радиации
- •1.4. Медицинский (эпидемиологический) подход к понятию «малые дозы» радиации
- •1.5. Новая граница «малых доз» радиации в XXI в. — 100 мГр
- •1.5.1. Комитет по биологическим эффектам ионизирующей радиации ан сша (beir)
- •1.5.2. Министерство энергетики сша (doe — Department of Energy)
- •1.5.3. Документ нкдар о немишенных эффектах ионизирующей радиации от 2006 г.
- •1.5.4. Физический факультет в Гарварде (Harvard Physics Department) и Медицинский радиологический центр в Обнинске
- •1.5.5. Институт безопасности развития атомной энергетики ран (ибраэ ран) и др.
- •1.5.6. Понятие о малых дозах радиации в мкрз
- •1.6. «Малые» и «низкие» дозы в соответствии с конъюнктурой исследований
- •1.7. Понятие малой мощности дозы
- •1.8. Чего придерживаться
- •Часть 2. Радиационно-индуцированная нестабильность генома (ринг) и малые дозы радиации.
- •2.1. Спонтанный мутагенез
- •2.2. Феноменология ринг
- •2.3. Гипотетические механизмы индукции и передачи ринг
- •2.3.1. Инициация ринг: непосредственные повреждения днк или эпигенетические механизмы
- •2.3.2. Индукция ринг активными формами кислорода
- •2.3.3. Ринг и теломеры
- •2.3.4. Дефектность имеющихся теорий о механизмах ринг в свете сути этого феномена
- •2.4. Устоявшиеся обыденно-научные представления о ринг
- •2.4.1. Кармела Мазерсилл с соавторами
- •2.4.2. Дж. Б. Литтл
- •Подпись к рис. 2.4.1
- •2.4.3. Другие авторитетные зарубежные исследователи
- •2.4.4. Авторы из России, Белоруссии и Украины
- •2.5. Почему для ринг при малых дозах радиации складывается конъюнктура в современной радиобиологии и радиационной эпидемиологии
- •2.5.1. Парадоксальность биологического действия ионизирующего излучения
- •2.5.2. Кластерный эффект ионизирующих излучений и малые дозы радиации
- •2.5.3. Ничтожная вероятность индукции канцерогенных мутаций при непосредственном воздействии излучения на гены-мишени в области малых доз
- •2.6. Дозовые закономерности индукции ринг in vitro
- •2.6.1. Факты
- •2.6.2. Те, кто искал дозовый порог для ринг, обычно его и находили
- •2.6.3. Аномалии клеточных систем in vitro
- •2.7. Ринг in vivo
- •2.7.1. Трудность корректной регистрации ринг in vivo. Аберрации хромосом, обнаруживаемые спустя длительные сроки после облучения, не являются однозначным доказательством ринг
- •2.7.2. Экспериментальные подходы для выявления истинной ринг in vivo
- •2.7.3. Ринг in vivo при относительно корректных методических подходах. Возможные артефакты
- •2.8. Ринг после облучения in utero
- •2.9. Кажущиеся «исключения»
- •2.9.1. Линия tk6 лимфобластоидных клеток
- •2.9.3. Клетки HeLa
- •2.9.4. Линия ооцитов китайского хомячка (клетки cho)
- •2.9.5. Мыши линии balb/c
- •2.10. Ринг в документах международных организаций (мкрз, beir и нкдар)
- •Список использованных источников
2.3. Гипотетические механизмы индукции и передачи ринг
По сути, в задачу представленной монографии не входит пристальное рассмотрение всех теоретических вопросов современной молекулярно-клеточной радиобиологии, в том числе и теорий о том, каковы же механизмы РИНГ. Ибо к проблеме дозовой зависимости данного феномена это прямого отношения не имеет, мало доказано экспериментально и пока недостаточно отражено в соответствующих обзорах и документах. Тем не менее, попробуем проанализировать имеющиеся предположения и экспериментальные факты, поскольку и здесь встречаются натяжки и спекуляции.
Основное, что всегда пытались оттенить в обзорах по РИНГ, это отсутствие у клеток-потомков тех повреждений, которые можно зарегистрировать у облученных прародителей. Все неполадки (включая те, что ведут к гибели или к канцерогенезу) появляются как бы заново, ниоткуда, и «не у всех». И непонятно, какие первоповреждения могли их обусловить. Кроме того, на первый взгляд кажется, что нет такого типа конечных материальных повреждений, которые смогли бы обеспечить бесконечное разнообразие последствий. То есть получается, что РИНГ — это какая-то нематериальная категория, передающаяся из поколения в поколение непонятно каким путем. Вот для раковых клеток и клеток с генетическими синдромами ясно — там имеется наследственная обусловленность дефектов в репарации ДНК и т.п. Отсюда и нестабильность из поколения в поколение. Но если клетки нормальны, стабильны, и только спустя многие поколения после облучения обнаруживается всплеск нестабильности (повреждений, мутагенеза, гибели и пр.), причем, опять же, «не у всех», то трудно сказать, откуда этот всплеск взялся, если никаких сходных дефектов у прародителей не найдено.
2.3.1. Инициация ринг: непосредственные повреждения днк или эпигенетические механизмы
Эпигенотип клетки — это спектр функционирующих в данный конкретный момент генов. Активация генов, которая происходит без каких-либо изменений в их структуре («коде»), является примером эпигенетического изменения [РК4, РМ14] Именно таким, на первый взгляд не-материально-генетическим механизмом, пытаются объяснить индукцию РИНГ. Вот типичная обширная цитата [РМ2]:
«Генетическое наследование подразумевает передачу от родителей потомству записанной в ДНК информации, необходимой для воспроизведения определенных биологических структур. Под эпигенетическим наследованием подразумевают передачу информации о функциональном состоянии генетических программ для названных структур, т.е. о наследуемых изменениях активности какого-либо гена или совокупности генов после воздействия на клетки внутренних или внешних модифицирующих факторов.
По мнению авторов работы [РГ6]61, именно это имеет существенное значение в механизмах радиационно-индуцированной нестабильности генома: изменение свойственной необлученной клетке модели генной экспрессии, передача измененной модели дочерним клеткам и воспроизведение ее в последующих поколениях на эпигенетическом уровне».
Этот же автор писал в другой обзорной публикации [РМ1]:
«Если генетическое наследование подразумевает передачу от родителей потомству записанной в ДНК информации, необходимой для воспроизведения определенных биологических структур, то под эпигенетическим наследованием имеют в виду передачу информации о функциональном состоянии генетических программ для названных структур, т.е. о наследуемых изменениях активности какого-либо гена или совокупности генов после воздействия на родительские клетки внутренних или внешних модифицирующих факторов».
Обзоры [РГ6, РМ2] увидели свет уже достаточно давно — в 1995 г. и в 2001 г. соответственно. Можно привести пример и 1998 г. [AL21]. Так что гипотеза об эпигенетическом наследовании нестабильности генома уже с бородой, но строгие доказательства так и отсутствуют. А с середины 1990-х гг. вплоть до последних лет другие исследователи понимали механизм передачи несколько попроще и поближе к материальному. К примеру, И.И. Пелевина (с соавторами) в 1996 г. указывала относительно увеличения частоты клеток с микроядрами у потомков подвергавшихся радиационному воздействию клеток HeLa [РП6] (выделено мною. — А.К.):
«Поскольку клетки с микроядрами нежизнеспособны, можно полагать, что они возникают de novo у отдаленных потомков облученных клеток, через длительное время после воздействия ионизирующего облучения. По-видимому, в молекуле ДНК длительное время существуют нарушения, которые в определенный момент времени могут реализоваться в летальное для клетки событие».
«Причинами этой нестабильности могут быть неправильно репарированные повреждения ДНК; измененная последовательность оснований; микроделеции теломерных участков хромосом...».
Сходные воззрения имела в 1998 г. и другая исследовательница РИНГ, уже упоминавшаяся К. Мазерсилл (C. Mothersill) с соавторами. Отмечалось, что индукция свободных радикалов генерирует повреждения ДНК, являющиеся сигналами для активации отстроченного апоптоза и ошибочной репарации ДНК. Что и приводит к нестабильности генома [AM37].
Так что два автора, стоявшие у истоков исследования РИНГ in vitro — К. Мазерсилл (1986–1987 гг. с соавтором [AM45, AS20]) и И.И. Пелевина (1985–1991 гг.; с соавторами [РГ7, РГ8, РГ9, РТ1, РТ2, РТ3]), считали, что РИНГ индуцируется не чем-то там метафизическим, а реальными, ошибочно репарированными повреждениями геномной структуры ДНК в родительской популяции непосредственно облученных клеток.
Мы должны заметить, что российские авторы во главе с профессором И.И. Пелевиной стояли у мировых истоков изучения РИНГ, и еще вопрос, кто «первый»: профессор К. Мазерсилл или же профессор И.И. Пелевина. Так, уже в статье 1986 г. (Н.Я. Тапонайнен, В.Я. Готлиб, И.И. Пелевина) мы находим фразу с упоминанием нестабильности генома: «Регистрируемые нами нарушения могут возникать в результате нестабильности генома, вызванной облучением» [РТ3].
Проходило время, но взгляды на механизм индукции РИНГ через повреждения ДНК, похоже, изменялись мало (либо вовсе не изменялись). Мы находим опубликованное в разных российских журналах мнение о роли исходных, недорепарированных повреждений ДНК в индукции РИНГ в 1998 г. [РП7]62, в 2001 г. [РП8]63 и в 2005 г. [РА4]. Наглядная схема имела место в публикации 2001 г., и мы ее приводим, поскольку и сами разделяем данное мнение (рис. 2.3.1).
Автору настоящей монографии тоже всегда была ближе гипотеза, что РИНГ обусловлена тем, что в геноме родительских клеток после облучения все же индуцируются некие повреждения. Они таковы, что влияют на функционирование разобранной выше системы защиты — репарации — элиминации повреждений ДНК. Однако клетка может жить с ними какое-то время, в течение которого результаты дефектов накапливаются и передаются последующим поколениям. Пока не накопятся настолько, что проявляются фенотипически в случае сложившихся внешних и внутренних условий. Скажут: придерживайтесь определения РИНГ. Согласно ему (см. выше) в облученных родительских клетках просто не должны иметься те дефекты, что наблюдаются у потомства, всё обнаруживаемое, де, неклонируемо, смотрите, скажут, представленное тобой же выше определение из двух пунктов.
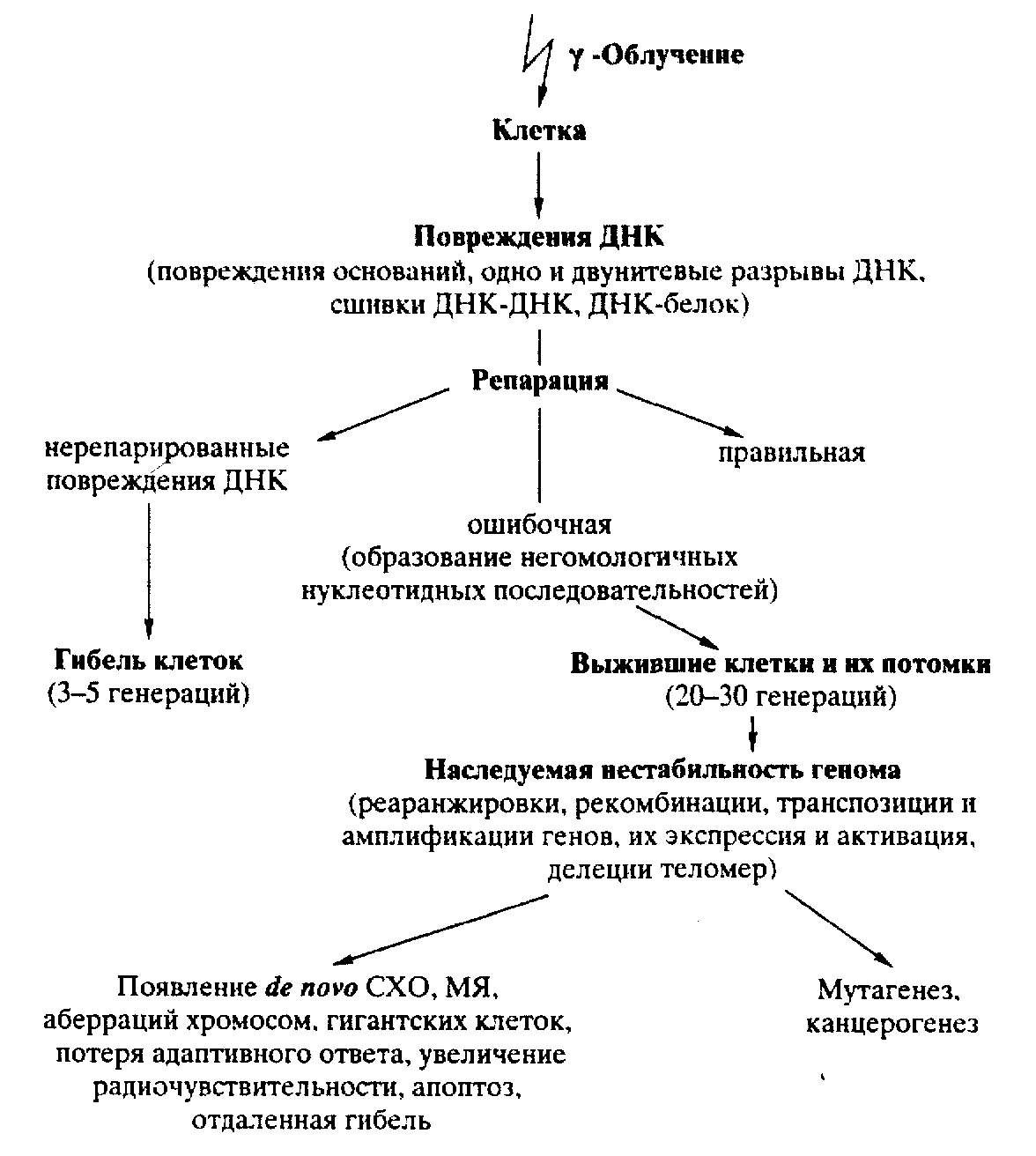
Рисунок 2.3.1. Схема инициации РИНГ редкоионизирующей радиацией путем образования ошибочно репарированных повреждений геномной структуры ДНК. По И.И. Пелевиной с соавторами, 2001 [РП8].
Ответим: а этих эффектов (гибели, индукции апоптоза, аберраций и пр., см. выше перечисление со ссылками) и нет у прародителей. У них есть только некие скрытые повреждения генома, которые со временем реализуются во все такие эффекты, возможно, накапливаясь на уровне ДНК в поколениях. Снова спросят: почему же тогда утверждают, что в родительских клетках вовсе ничего нет (к примеру, при малых дозах), а все появляется потом, что и страшно? Ответим: кто сказал, что нет? Разве возможно на нынешнем этапе проверить после облучения родительских клеток нативность и нормальность функционирования всех генов и групп генов, отвечающих за массу факторов репликации и репарации ДНК? Отсутствие регистрации повреждений в нестабильных клонах [AM34] в философском плане не означает, что их нет; ведь в каждом опыте изучается конечное (вернее, очень немногое) число показателей. Это следует исходя из ограниченности нашего экспериментального подхода; принимается положение, что все нормально, если не зарегистрировано то-то и то-то. Но по сути же ясно, что может быть нечто вовсе не исследованное.
Ведь неклонируемы конечные эффекты, показатели феномена РИНГ, а не его молекулярные причины.
Словом, по нашему мнению, вполне может быть, что склонность к нестабильности генома передается генетически, а не эпигенетически. Тем более, что имеются косвенные экспериментальные данные, указывающие на роль репарации ДНК в развитии РИНГ, в частности, на роль репарации однонитевых разрывов [AS45].
К похожему на наш выводу пришли в 2006 г. и японские исследователи [AS60], которые считают, что клетки-потомки «запоминают» начальные повреждения ДНК в облученной родительской популяции. Этими авторами было показано, что такая «память» вызывает отсроченные повреждения ДНК, которые, в свою очередь, активируют сверочные точки (DNA damage checkpoint), затем приводя к РИНГ. Японские исследователи полагают, что индуцированные излучением делеции большого размера дестабилизируют структуру хроматина, и это может передаваться многим генерациям клеток-потомков, обусловливая РИНГ [AS60].
* * *
Но все представленное также является гипотезой. И, поэтому, мы возвращаемся к вопросу об эпигенетических эффектах в современном представлении. Оказывается, что цитированные выше фразы об эпигенетическом наследовании все-таки не служат подтверждением того, что некоторые авторы уходят в своих научных теориях из области материального. Все-таки даже эпигенетическое наследование имеет основой структуры, связанные с ДНК.
Теоретически к основам эпигенетических изменений относят [РК4, РМ14, AU13]:
1) Наследование при репликации ДНК связанных с ней белков. Дочерние клетки получают от материнской часть белков и мРНК в виде готовых к функционированию и защищенных от нуклеаз информосом, способных через трансляционные продукты после митоза принять участие в формировании тканеспецифического эпигенотипа.
2) Наследование общей схемы метилирования или ацетилирования ДНК.
3) Наследование последовательностей ДНК с локальными конформационными перестройками.
Для раковых клеток эпигенетическая передача информации продемонстрирована достаточно отчетливо: гипер- и гипометилирование характерно для опухолевых клеток, обладающих гипермутабильным нестабильным геномом [РК4].
Что же касается феномена при действии облучения на нормальные клетки, то тут ситуация несколько странная. Имеется смешение понятий, что, правда, нас не удивляет, поскольку такие штуки не раз встречаются в современной радиобиологии, которой пытаются обосновать крайний вред любых доз радиации.
С одной стороны, есть гипотетическое эпигенетическое наследование РИНГ, которое было приведено выше, т.е., наследование не кода ДНК, не кодирующих последовательностей, а функционирования генов через косвенное воздействие передаваемых изменений в спектре метилирования (возможно, и ацетилирования) ДНК, в наследовании связанных с ДНК регуляторных белков и определенной структуры хроматина [РК4, РМ14].
С другой стороны, эпигенетическими эффектами называют любые эффекты, которые передаются не через геном. Вот, к примеру, «эффект свидетеля», когда поражение и РИНГ индуцируются в клетках, непосредственно не облученных, но контактирующих либо с облученными в составе ткани, либо со средой инкубации клеток, подвергавшихся радиационному воздействию. Вы будете смеяться, но это рассматривают как пример эпигенетической передачи РИНГ [AB9, AM48, AN3] (можно привести и другие примеры). Однако это «две большие разницы»: или эпигенетический механизм передачи нестабильности генома от клетки-прародителя к клеткам в поколениях, или «эпигенетический» путь передачи повреждающего сигнала от клетки к клетке в единой культуре через среду или контакт (т.е., не наследственно).
Казалось бы, ясно, но — не совсем. Возьмем два документа НКДАР. Оба пока не получили окончательного вида, несмотря на многолетние издания многочисленных доработанных проектов, и на их обложках написано типа что «это пока предварительно, для внутреннего пользования НКДАР» и чтобы пока не цитировали. А мы и не цитируем, мы просто называет данные документы, тем более что первый находится в свободном доступе в Интернете. Итак:
1) UNSCEAR Report 2003. “Epigenetic effects of exposure to ionizing radiation”, Fifty-first session Vienna, 27–31 January 2003. — 24 p.
2) UNSCEAR Report 2006. “Non-targeted and delayed effects of exposure to ionizing radiation”. Fifty-fourth session Vienna, 29 May to 2 June 2006. —101 p. [AU17] (и аналогично названная статья В.Ф. Моргана (W.F. Morgan) [AM32], который являлся консультантом НКДАР при составлении данного документа)64.
В первом документе есть раздел, посвященный тому, что НКДАР понимала по крайней мере в 2003 г. под эпигенетическими эффектами радиации. Представим аутентичный фрагмент проекта Отчета НКДАР-2003 (рис. 2.3.2).
У авторов данного документа НКДАР-2003 получается, что конечные эффекты и РИНГ, и «эффекта свидетеля» и пр., как бы не связаны с ядром и геномом. То есть, в данном случае «эпигенетический» и «немишенный» (неядерный) — синонимы. Получается путаница: РИНГ является примером эпигенетического эффекта радиации, причем механизм индукции и передачи РИНГ, опять же, «эпигенетический». В конечном счете непонятно, но все равно здорово.

Рисунок 2.3.2. Аутентичный фрагмент проекта документа НКДАР-2003 “Epigenetic effects of exposure to ionizing radiation”, Fifty-first session Vienna, 27–31 January 2003. — 24 p. (проект находится в свободном доступе в Интернете).
Ясно, что раз в НКДАР имеется путаница, то два разных понятия «эпигенетического» можно встретить и в публикациях отдельных авторов. Вот, к примеру, в весьма информативном обзоре Ю.Е. Дубровы по наследственным генетическим эффектам облучения в журнале «Генетика» за 2006 г. [РД2] мы встречаем следующее:
«Результаты многочисленных работ однозначно свидетельствуют о том, что «память» облученных клеток/организмов передается их потомкам эпигенетически».
И даны шесть ссылок, наиболее «свежие» из которых за 2003 г., когда непосредственных данных о параллельном исследовании РИНГ и метилирования ДНК еще не было (см. ниже табл. 2.3.1). В цитированных же источниках под «эпигенетическим» подразумевались любые немишенные эффекты радиации, но не, к примеру, метилирование с ацетилированием. Вот, и сам профессор Ю.Е. Дуброва в своем обзоре потом разбирал возможность индукции трансгенерационной РИНГ через повреждения ДНК от свободных радикалов, через РНК и пр.
Как видим, явное смешение понятий про «эпигенетическое» в [РД2] налицо.
Поэтому мы подчеркиваем, что следует отличать «эпигенетическое» как немишенное, и «эпигенетическое» как не затрагивающее непосредственно кодирующие участки ДНК, но изменяющее ее структуру/функционирование путем модификации спектра метилирования (или ацетилирования), т.е., «эпигенетическое», как связанное с эпигенотипом клетки [РК4, РМ14].
Выше мы назвали и второй документ НКДАР (три его проекта в процессе доработки: за 2004, 2005 и 2006 гг. и окончательный вариант 2009 г. [AU18]). Вроде бы там то же самое, что и в первом цитированном документе (где почтоянно «эпигенетическое»), и в нем мы имеем углубленное рассмотрение всех представленных на рис. 2.3.2 эффектов (преимущественно же — РИНГ). Возникает вопрос, насколько часто упоминается там термин «эпигенетический»? Всего один раз в следующем фрагменте:
“Similar replication dependency was also reported for radiation-induced mammary cancers in rats in which expression of epigenetic initiation required replication of irradiated mammary stem cells in the tissue microenvironment”.
То есть, единственное упоминание касается особенностей раковых клеток.
Столь бедная «эпигенетическим» ситуация в основном документе НКДАР по немишенному действию излучения, включая РИНГ и «эффект свидетеля», характерна: пока что подобный механизм индукции экспериментально строго не доказан65.
Автор представленной монографии и ранее, в 2004 и 2005 гг., обращал внимание на то, что построения о передаче РИНГ через, к примеру, эпигенетическое метилирование или ацетилирование являются только гипотезой, и что нельзя рассуждать, а тем более писать на данную тему как о чем-то доказанном [РК14, AK26]. И что (самоцитата): «В большинстве случаев упоминания об эпигенетическом механизме индукции и передачи РИНГ встречаются в обзорах, а не в экспериментальных работах» (2005 г.) [AK26].
Ранее мы не имели возможности подкрепить цитированное утверждение на фактах. Сделаем это здесь, представив все данные по поиску в Pubmed на сочетание: “Epigenetic+genomic instability+irradiation” вкупе с поиском соответствующих упоминаний в публикациях и документах международных организаций (табл. 2.3.1). Данные об эпигенетических особенностях нестабильных раковых клеток (таких данных много) опускаем. Опускаем еще нечто, не имеющее отношения к делу (см. ниже примечание к табл. 2.3.1). Оставшееся включено в эту несколько необычного вида таблицу, где вместо данных, а потом номеров ссылок, стоят просто ссылки.
Таблица 2.3.1. Эпигенетические механизмы индукции РИНГ в экспериментальных и теоретических работах*.
Экспериментальная работа по эпигенетическим эффектам радиации |
Теоретическая работа — обзор, комментарий и др. (эпигенетическая передача — как гипотеза) |
Kaup S., ... Seymour C.B., Mothersill C.E., Schofield P.N. Radiation-induced genomic instability is associated with DNA methylation changes in cultured human keratinocytes // Mutat. Res. 2006. V. 597. № 1–2. P. 87–97. |
Саенко А.С. и др. Индивидуальная реакция людей и животных на действие ионизирующей радиации в малых дозах // В сб. тез. докл. межд. конфер. «Новые направления в радиобиологии». Москва, 6–7 июня 2007 г. М.: РУДН, 2007. С. 70–73. |
Koturbash I., ... Kovalchuk O. Epigenetic dysregulation underlies radiation-induced transgenerational genome instability in vivo // Int. J. Radiat. Oncol. Biol. Phys. 2006. V. 66. № 2. P. 327–330. |
Дуброва Ю.Е. Нестабильность генома среди потомков облученных родителей. Факты и их интерпретация // Генетика. 2006. Т. 42. № 10. С. 1335–1347. |
Loree J., ... Kovalchuk O. Radiation-induced molecular changes in rat mammary tissue: possible implications for radiation-induced carcinogenesis // Int J Radiat Biol. 2006. V. 82. № 11. P. 805–815. |
Зайнуллин В.Г. и др. Генетические эффекты, индуцированные облучением в малых дозах у Drosophila melanogaster // Радиац. биология. Радиоэкология. 2006. Т. 46. № 3. С. 296–306. |
Koturbash I., ... Kovalchuk O. Stable loss of global DNA methylation in the radiation-target tissue — a possible mechanism contributing to radiation carcinogenesis? // Biochem. Biophys. Res. Commun. 2005. V. 337. № 2. P. 526–533. |
Mothersill C., Seymour C.B. Radiation-induced bystander effects and the DNA paradigm: an "out of field" perspective // Mutat. Res. 2006. V. 597. № 1–2. P. 5–10. |
Pogribny I., ... Kovalchuk O. Dose-dependence, sex- and tissue-specificity, and persistence of radiation-induced genomic DNA methylation changes // Biochem. Biophys. Res. Commun. 2004. V. 320. № 4. P. 1253–1261. |
Baverstock K., Belyakov O.V. Classical radiation biology, the bystander effect and paradigms: a reply // Hum. Exp. Toxicol. 2005. V. 24. № 10. P. 537–542. |
Pogribny I., ... Kovalchuk O. Dose-dependence, sex- and tissue-specificity, and persistence of radiation-induced genomic DNA methylation changes // Biochem. Biophys. Res. Commun. 2004. V. 320. № 4. P. 1253–1261. |
Baverstock K., Belyakov O.V. Classical radiation biology, the bystander effect and paradigms: a reply // Hum. Exp. Toxicol. 2005. V. 24. № 10. P. 537–542. |
Таблица 2.3.1. (окончание) Эпигенетические механизмы индукции РИНГ в экспериментальных и теоретических работах*.
Экспериментальная работа по эпигенетическим эффектам радиации |
Теоретическая работа — обзор, комментарий и др. (эпигенетическая передача — как гипотеза) |
Pogribny I., ... Kovalchuk O. Dose-dependence, sex- and tissue-specificity, and persistence of radiation-induced genomic DNA methylation changes // Biochem. Biophys. Res. Commun. 2004. V. 320. № 4. P. 1253–1261. |
Baverstock K., Belyakov O.V. Classical radiation biology, the bystander effect and paradigms: a reply // Hum. Exp. Toxicol. 2005. V. 24. № 10. P. 537–542. |
Kovalchuk O. et al. Methylation changes in muscle and liver tissues of male and female mice exposed to acute and chronic low-dose X-ray-irradiation // Mutat. Res. 2004. V. 548. № 1–2. P. 75–84. |
Trosko J.E. et al. Low-dose ionizing radiation: induction of differential intracellular signalling possibly affecting intercellular communication // Radiat. Environ. Biophys. 2005. V. 44. № 1. P. 3–9. |
Kovalchuk O. et al. Genome hypermethylation in Pinus silvestris of Chernobyl — a mechanism for radiation adaptation? // Mutat. Res. 2003. V. 529. № 1–2. P. 13–20. |
Rugo R.E., Schiestl R.H. Increases in oxidative stress in the progeny of X-irradiated cells // Radiat. Res. 2004. V. 162. № 4. P. 416–425. |
|
Pongsaensook P. et al. Cis-acting transmission of genomic instability // Mutat. Res. 2004. V. 568. № 1. P. 49–68. |
Mothersill C., Seymour C. Radiation-induced bystander effects, carcinogenesis and models // Oncogene. 2003. V. 22. № 45. P. 7028–7033. |
|
Huang L. et al. Radiation-induced genomic instability and its implications for radiation carcinogenesis // Oncogene. 2003. V. 22. № 37. P. 5848–5854. |
|
Воробцова И.Е. Генетические и соматические эффекты ионизирующей радиации у людей и животных (сравнительный аспект) // Радиац. биология. Радиоэкология. 2002. Т. 42. № 6. С. 639–643. |
|
Мазурик В.К., Михайлов В.Ф. Радиационно-индуцируемая нестабильность генома: феномен, молекулярные механизмы, патогенетическое значение // Радиац. биология. Радиоэкология. 2001. Т. 41. № 3. С. 272-289. |
|
Limoli C.L. et al. Genomic instability induced by high and low LET ionizing radiation // Adv. Space Res. 2000. V. 25. № 10. P. 2107–2117. |
* До 2000 г. сведения не приводятся, поскольку найдены только обзорные работы либо экспериментальные исследования, где эпигенетические эффекты служат гипотетическим объяснением во введении или обсуждении. Не представлены также те публикации начала 2000-х гг., где имело место смешение понятий и неверная терминология, когда эпигенетическими эффектами названы сами РИНГ, «эффект свидетеля» и пр. (см. выше рис. 2.3.2).
Первые упоминания о том, что механизмом индукции и передачи РИНГ могут являться эпигенетические эффекты, нами обнаружены в рефератах обзорных работ 1996 г. [AM33, AM56], что указывает на достаточную популярность гипотезы уже в середине 1990-х гг. Прошла дюжина лет усиленных исследований нестабильности генома по всему миру, и какие же имеются предпосылки применительно к экспериментальным доказательствам эпигенетического механизма формирования и передачи РИНГ? Согласно табл. 2.3.1 (на 2008 г.), шесть публикаций одной группы авторов (Ольга Ковальчук работает в Канаде) и, к 2006 г., еще работа К. Мазерсилл с соавторами, в которой указано, что это — «впервые продемонстрированный факт эффекта радиации на индукцию наследуемых изменений метилирования в клетках млекопитающих». (“This is the first demonstration that irradiation results in the induction of heritable methylation changes in mammalian cells”.)
Действительно, применительно к работам О. Ковальчук с сотрудниками почти все упомянутые статьи посвящены исследованию измененного спектра метилирования ДНК в тканях облученных мышей или крыс. Первые пять по времени работ непосредственного отношения к РИНГ не имеют: показана исключительно модификация метилирования ДНК в пострадиационный период (конечно, тоже приоритет).
Применительно же к РИНГ только в 2006 гг. О. Ковальчук с соавторами были получены данные о том, что передающееся трансгенерационно гипометилирование определенных участков ДНК после облучения наблюдается параллельно со снижением способности тканей грызунов к репарации. Выявлена прямая корреляция между двумя названными показателями. Это имело место в работе О. Ковальчук с соавторами. А вот у К. Мазерсилл с соавторами в 2006 г. на клетках человека получилось несколько по-другому: радиация приводила, в основном, не к гипометилированию, как у О. Ковальчук с соавторами, но к гиперметилированию ДНК в клетках-потомках, хотя, как сказано, встречалось и гипометилирование (ссылки см. в табл. 2.3.1).
Так что пока совершенно не ясно, в какую сторону сдвигает облучение данный эпигенетический «механизм» индукции РИНГ. Беспроигрышные, надо сказать, работы получаются, как с репаративным синтезом ДНК или с антиоксидантной активностью, где что «плюс», что «минус» — все подходит.
Но если и «плюс», и «минус» эффекта приводят к одному и тому же явлению, то какой отсюда следует вероятный вывод? Можно думать, что все эти «плюсы» и «минусы» к данному явлению прямого отношения не имеют. (Мы не настаиваем на данном выводе, мы просто говорим, что пока рано о чем-то утверждать, ибо по эпигенетическим эффектам радиации мало данных.)
Знакомясь с рефератом наиболее важной работы канадки О. Ковальчук и др., 2006 (см. в табл. 2.3.1 статью про трансгенерационную передачу РИНГ), в очередной раз можно удивиться тому, что изучающие трансгенерационные эффекты излучения нередко скрывают свои объекты исследования (рефераты в Pubmed соответствуют авторефератам авторов статей). В резюме последней публикации О. Ковальчук с соавторами нельзя найти каких-либо упоминаний о том, что опыты выполнены на грызунах. Авторы в кратком реферате подробно рассуждают, что «помимо прочих осложнений, радиация способна представлять угрозу для потомков облученных родителей» и что, де, «механизмы трансгенерационной передачи нестабильности темны» (2006 г.). Очень, конечно, свежие, оригинальные мысли, и очень «уместные» для реферата. Но информации, что эксперименты выполнены на грызунах, авторы избегают. Вот раздел реферата «Материалы и методы»: “We studied the levels of cytosine DNA methylation in somatic tissues of unexposed offspring upon maternal, paternal, or combined parental exposure”.
Словом, О. Ковальчук с соавторами исследовали «детей родителей».
Можно так и не понять, про кого речь, если бы в рефератах других статей 2004–2006 гг. не было бы указаний на мышей и крыс.
Могут попенять на обсуждение данного момента, скажут: «Случайность, де». Но такие «случайности», почему-то, в одну сторону. Мы еще в своем фельетоне [РК12, РК13] и, затем, в «Ответе профессору Юрию Дуброве» [РК20], одному из наиболее известных радиационных генетиков, обращали внимание на то, как и этот исследователь трансгенерационных эффектов радиации писал свои рефераты. Наиболее важные вещи в ряде случаев опускались (дозы и объекты). Мы еще обратили тогда внимание [РК20] на обзор профессора Ю.Е. Дубровы в журнале “Oncogene” за 2003 г. [AD22]. Он назывался «Индуцированная облучением трансгенерационная нестабильность». В реферате обзора сказано про важность этой передачи и про то, что в подобных случаях может быть повышен риск канцерогенеза и мутагенеза у потомства. Следует заметить, что подобные эффекты у потомков облученных родителей выявлены (кроме стран бывшего СССР) только на грызунах, но не на людях [AC12, AU16]. Однако в реферате обзора Ю.Е. Дубровы за 2003 г. [AD22], вновь, не было ни слова о каких-либо объектах.
Правда, затем указанный исследователь все-таки исправился (возможно, сыграли роль наши критические публикации [РК12, РК13, РК20]). Например, в 2006 г. в журнале «Генетика» вышел его обзор про «нестабильность генома у детей облученных родителей» (весьма взвешенный обзор) [РД2]. Опять в нем разбирается «риск канцерогенеза, риск мутагенеза...». Но в кратком (3,5 строки) реферате в Pubmed все-таки нашлось место уточнению, что все это — у животных (“...high frequency of cancer diseases and instability of the genome of somatic and germline cells in the offspring of radiation-exposed animals” [РД2]).
Мы не сомневаемся в корректности данных О. Ковальчук с соавторами относительно наличия корреляции между гипометилированием ДНК и снижением активности репаративных процессов у грызунов — потомков облученных родителей, что может сопутствовать РИНГ (см. табл. 2.3.1). Правда, необходимо сделать еще один экспериментальный шаг. Следует не только накопить феноменологические факты, но осуществить и «активное вмешательство»: подавить (ингибировать) один из процессов, чтобы узнать, как это отразиться на другом, гипотетически зависимым от первого. Либо придумать что-нибудь еще, вроде опытов на животных со сниженной/повышенной способностью к репарации или к метилированию. Не знаем конкретно; но, если исходить из нашего старинного экспериментального опыта, просто размахивать одними корреляциями маловато, поскольку непонятно, что есть «курица, а что яйцо», что причина, а что — следствие.
Поскольку такими корреляциями полны отчеты о проделанных научно-исследовательских работах. Отчеты забытые. Мы сами всяких разных корреляций выявляли в свое время немало. К примеру, в старой работе [РН4], где имела место корреляция концентрации неких белков плазмы крови с развитием раковой опухоли у мышей. Что, сразу надо было заявлять, будто канцерогенез определяется данными белками? Или статьи (одна времен расцвета Гайдара) [РК28, AK28], в которых репликативный синтез ДНК в клетках мышей коррелировал с уровнем определенных белков хроматина. А про стрессорные белки металлотионеины и говорить нечего: они когда-то в наших исследованиях много с чем коррелировали (хотя бы [РК31, РК32]). Но нигде не были сделаны столь глобальные, концептуальные выводы, следующие, по идее, из работ О. Ковальчук с соавторами, на которые должны опираться писавшие свои многочисленные обзоры по механизмам РИНГ. Более того (см. табл. 2.3.1), получается, что этих экспериментальных работ еще не было, но результаты их уверенно предвосхитили в обзорах прошлых лет... Вспомним тут, что в естественных науках, особенно последнего времени работы по грантам, иной раз и слово материализуется, это ведь ясно.
