
Часть-1 дз метода
.pdf
Таким образом, выражения для гибридных волновых функций имеют следующий вид:
sp |
|
1 |
|
( |
|
), |
(13) |
||
|
|
|
|||||||
|
|
||||||||
1 |
|
|
2 |
|
2s |
2p |
|
|
|
|
|
|
|
|
|
|
|
||
sp |
|
|
1 |
|
( |
|
). |
(14) |
|
|
|
|
|
||||||
1 |
|
|
2 |
|
2s |
2p |
|
|
|
|
|
|
|
|
|
|
|
||
Аналогичным образом выводятся уравнения и для других гибридных орбиталей. Например, в случае четырёх sp3-гибридных орбиталей
sp3 ai 2s bi 2px ci 2py di 2pz
необходимо вычислить 16 значений коэффициентов ai , bi, ci, di.
Как известно, при решении уравнения Шредингера методом разделения переменных находят радиальную часть волновой функции
R(r), зависящую от расстояния электрона до ядра r, и угловую часть
( ) ( ), зависящую от угла долготы и угла широты . Результаты
решения уравнения Шредингера приводятся в справочниках. Пользуясь ими, можно вычислить численное значение угловой части волновой функции ( , ). Форма орбитали (атомной или гибридной) определяется угловой частью волновой функции или её квадратом.
Для плоскостного изображения формы орбитали достаточно вычислить значения угловой части при различных значениях угла долготы , выбрав такое значение угла широты (0º или 90º), чтобы широтная часть равнялась бы единице (эта часть волновой функции содержит тригонометрические параметры cos и sin ).
Далее на лучах, проведённых под произвольными углами
относительно координатных осей,
70

откладываются отрезки, пропорциональные либо угловой части волновой функции, либо её квадрату в интервале значений от 0º до 360º.
Полученные «засечки» на лучах затем соединяются плавной линией, в
результате чего получается плоскостное изображение формы гибридных орбиталей.
При линейной комбинации -функций с одинаковым знаком
2s-орбитали и 2p-орбитали (например, 2px -орбитали)
происходит усиление положительной части 2px -орбитали и уменьшение отрицательной части, в результате чего форма одной из гибридных sp-орбиталей имеет вид:
При наложении областей с различным знаком -функций происходит уменьшение абсолютного значения суммарной -функции,
т.е. форма второй гибридной sp-орбитали имеет вид:
71

Таким образом, две sp-гибридные орбитали располагаются линейно в пространстве под углом 180º.
Пример 2. Изобразить схему перекрывания орбиталей при образовании связей в молекулах NH3 и CH3OH.
Решение. Электронное строение молекулы NH3 можно изобразить в виде схемы
 ,
,
согласно которой атом азота имеет неподелённую электронную пару.
Электронная конфигурация атома азота – 1s22s22p3.
Электроны валентного слоя будут занимать четыре sp3-гибридные орбитали, три из которых содержат по одному электрону. Эти три орбитали образуют связи N H вследствие перекрывания с s-орбиталями атомов водорода. Четвертая sp3-гибридная орбиталь будет занята электронной парой, не образующей химическую связь с атомами Н. Таким образом, схему перекрывания орбиталей атома азота с орбиталями атомов водорода можно изобразить следующим образом:
72

В молекуле CH3OH атом углерода находится в sp3-гибридном
состоянии. Четыре sp3-гибридных орбитали образуют три связи С H и
одну связь С O. Связь O H образуется за счёт перекрывания p-орбитали атома кислорода с s-орбиталью атома водорода. Схему перекрывания орбиталей при образовании связей в молекуле CH3OH
можно изобразить следующим образом:
Пример 3. Указать число σ- и π-связей в молекулах HC С CH3 и
H2C СHBr.
Решение. Любая одинарная связь в молекуле соединения является
σ-связью, которая образована электронным облаком, имеющим максимальную плотность на линии, соединяющей ядра атомов.
Любая кратная связь содержит одну σ-связь и одну или две π-связи
(они образуются электронами, орбитали которых дают максимальное перекрывание по обе стороны от линии, соединяющей ядра атомов).
В соответствии с формулами соединений
73

в молекуле пропина шесть σ-связей и две π-связи, а в молекуле бромистого винила пять σ-связей и одна π-связь.
Пример 4. Изобразить схему перекрывания орбиталей при образовании σ- и π-связей в молекулах HCHO и N2.
Решение. В соответствии с формулой
атом углерода в молекуле формальдегида образует три σ-связи за счёт перекрывания трёх sp2-гибридных орбиталей с s-орбиталями атомов водорода и p-орбиталью атома кислорода. Эти три σ-связи располагаются в одной плоскости под углами 120º друг к другу. Четвёртая атомная p-орбиталь атома углерода образует π-связь с атомом кислорода. π-Связь располагается в плоскости, перпендикулярной той, в которой располагаются три σ-связи. Таким образом, схема перекрывания орбиталей при образовании связей в молекуле формальдегида выглядит так:
В молекуле азота одна σ-связь образуется за счёт перекрывания p-орбиталей атомов азота, две другие валентные p-орбитали атомов азота образуют две π-связи, расположенные во взаимно перпендикулярных плоскостях:
74
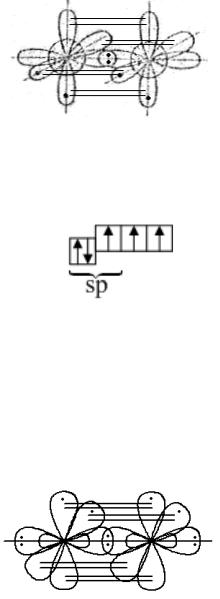
Однако образование химических связей в молекуле азота можно объяснить и с позиций гибридизации атомных орбиталей. При этом атомы азота находятся в sp-гибридном состоянии,
но одна sp-гибридная орбиталь содержит неподелённую пару электронов. σ-Связь в молекуле N2 реализуется в результате перекрывания двух гибридных sp-орбиталей атомов азота, на которых находится по одному неспаренному электрону. Две p-орбитали, содержащие по одному неспаренному электрону, образуют две π-связи:
Пример 5. Изобразить валентные схемы для молекулы SO3.
Решение. Как установлено методом дифракции электронов, молекула
SO3 в газовой фазе представляет собой плоскую симметричную структуру с тремя расстояниями S O, равными 143 пм. Дипольный момент молекулы SO3 равен нулю.
Одна из возможных валентных схем молекулы SO3 может быть представлена формулой
75

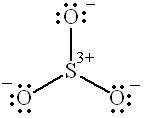 ,
,
в которой атом серы имеет незанятую р-орбиталь и обладает неполным октетом электронов. При этом три электрона атома серы делокализованы по одному на орбиталях атомов кислорода. Конечно, такая схема вносит наименьший вклад в суммарное распределение электронной плотности в молекуле, так как предполагает, что все связи S O в молекуле SO3
являются ионными.
Возможны валентные схемы, которые содержат одну двойную связь
S O:
В данном случае два электрона атома серы делокализованы на р-орбитали двух атомов кислорода.
Наконец, возможны и валентные схемы, которые содержат две двойные связи S O за счёт участия d-орбиталей атома серы в образовании химических связей:
76

В реальной молекуле имеет место промежуточное распределение электронной плотности по сравнению с распределением, представленным с помощью валентных схем.
Пример 6. Указать связь, образованную в молекуле NH3 BF3 по донорно-акцепторному механизму.
Решение. Молекула NH3 имеет следующее электронное строение
 .
.
Согласно приведённой схеме три электронные пары образуют три
связи |
N H, |
а неподелённая пара внешних |
электронов принадлежит |
только |
атому |
азота. Молекула NH3 может |
присоединять частицы, |
имеющие незаселённые орбитали и, следовательно, способные принимать электронную пару, например, молекулу BF3, в которой атом бора обладает незаполненной р-орбиталью.
В молекуле соединения, образовавшейся в результате взаимодействия NH3 и BF3, атомы бора и азота четырёхвалентны. Связь,
образованная по донорно-акцепторному механизму, условно обозначается стрелкой. Направление стрелки указывает перенос электронной пары от атома азота в молекуле NH3 (донор) к атому бора (акцептор).
77
Вариант 1
1.Какой вид гибридизации валентных орбиталей атома А отвечает тетраэдрическому расположению связей в молекуле типа AX4?
2.Изобразить схемы перекрывания орбиталей при образовании связей в молекулах H2O и CH2Cl2.
3.Указать число σ- и π-связей в молекулах HCHO и CH3COCH3.
4.Изобразить схемы перекрывания орбиталей при образовании σ- и
π-связей в молекулах COCl2 и C2H2.
5.Изобразить валентные схемы для иона NO3 .
6.Указать число связей в молекуле Be2Cl4 , образованных по донорно-акцепторному механизму.
Вариант 2
1. Какова геометрическая форма молекулы AX5, если валентные орбитали атома А находятся в dsp3-гибридном состоянии?
2. Изобразить схемы перекрывания орбиталей при образовании связей в молекулах С2H5OH и NF3.
3. Указать число σ- и π-связей в молекулах CH3CHO и
H2C CH CH2 CH3.
4.Изобразить схемы перекрывания орбиталей при образовании σ- и
π-связей в молекулах HC С CH3 и COCl2.
5.Изобразить валентные схемы для молекулы HNO3.
6.Указать число связей в молекуле H2[SiF6], образованных по донорно-акцепторному механизму.
78
Вариант 3
1.Какой вид гибридизации валентных орбиталей атома А отвечает плоскому расположению связей в молекуле типа AX3?
2.Изобразить схемы перекрывания орбиталей при образовании связей в молекулах С2H6 и BF3.
3.Указать число σ- и π-связей в молекулах CH2CHCl и CH3COOH.
4.Изобразить схемы перекрывания орбиталей при образовании σ- и
π-связей в молекулах CO2 и CH3COOH.
5.Изобразить валентные схемы для иона N3 .
6.Указать число связей в ионе AlH4 , образованных по донорно-
акцепторному механизму.
Вариант 4
1.Какой вид гибридизации валентных орбиталей атома А отвечает линейному расположению связей в молекуле типа AX2?
2.Изобразить схемы перекрывания орбиталей при образовании связей в молекулах SiF4 и PH3.
3. Указать число σ- и π-связей в молекулах COCl2 и
H2C CH CH CH2 .
4.Изобразить схемы перекрывания орбиталей при образовании σ- и
π-связей в молекулах CH2CHCl и NH3.
5.Изобразить валентные схемы для иона CO32 .
6.Указать число связей в ионе PF6 , образованных по донорно-
акцепторному механизму.
79
