
Часть-1 дз метода
.pdf4. Распределить электроны по молекулярным орбиталям в ионе
CN . Каков порядок связи в этом ионе? Каковы его магнитные свойства? 5. Как изменяется длина связи и энергия связи в ряду CN , CN,
CN ? Ответ обосновать.
6. Определить порядок связи в молекуле N2.
Вариант 5
1.Изобразить структурные схемы Льюиса и классифицировать по методу ОЭПВО следующие молекулы: BCl3, SF6, BeCl2, SbH3, XeF4.
2.Какова геометрическая форма следующих молекул и ионов: IF7,
NH4 , SbH3, XeO64 , POCl3?
3.Как изменяется валентный угол в ряду следующих молекул: AsF3, AsCl3, AsBr3? Ответ обосновать.
4.Распределить электроны по молекулярным орбиталям в молекуле
F2. Каков порядок связи в этой молекуле? Каковы магнитные свойства
молекулы фтора?
5.Как изменяется длина связи и энергия связи в ряду молекул N2, O2, F2? Ответ обосновать.
6.Определить порядок связи в молекуле OF.
9.ОБЩИЕ СВЕДЕНИЯ О КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ И ХИМИЧЕСКАЯ СВЯЗЬ В НИХ
Пример 1. Для комплексных соединений K[Ag(CN)2] и
[Cu(NH3)4](OH)2 указать центральный ион (комплексообразователь),
90
внутреннюю и внешнюю сферы, лиганды и координационное число, а
также дать названия соединениям.
Ответ.
K[Ag(CN)2]. Центральный ион − Ag ; лиганды – анионы CN ;
центральный ион имеет координационное число (к.ч.) 2; [Ag(CN)2] −
внутренняя сфера комплекса, а ион K образует внешнюю сферу.
Название – дицианоаргенат(I) калия.
[Cu(NH3)4](OH)2. Центральный ион − Cu2 ; лиганды – молекулы
аммиака; к.ч. центрального иона – 4; [Cu(NH3)4]2 − внутренняя сфера, а
анионы OH образуют внешнюю сферу комплекса. Название – гидроксид тетраамминмеди(II).
Первый комплекс содержит комплексный анион, второй – комплексный катион.
Пример 2. Написать уравнения реакций образования и разрушения комплексных соединений, указанных в примере 1.
Ответ. Возможные химические реакции образования комплексных соединений:
AgNO3 2KCN(изб.) K[Ag(CN)2 ] KNO3,
Ag2O 4KCN(изб.) H2O 2K[Ag(CN)2 ] 2KOH,
Cu(OH)2 4NH3(изб.) [Cu(NH3)4](OH)2,
CuO 4NH3(изб.) H2O [Cu(NH3)4](OH)2.
Возможные химические реакции разрушения комплексных
соединений:
2K[Ag(CN)2] Zn K2[Zn(CN)4] 2Ag,
2K[Ag(CN)2] K2S Ag2S 4KCN,
91
[Cu(NH3)4](OH)2 3H2SO4 CuSO4 2(NH4)2SO4 2H2O,
[Cu(NH3)4](OH)2 K2S CuS 4NH3 2KOH,
t |
t |
[Cu(NH3)4](OH)2 |
4NH3 Cu(OH)2 4NH3 CuO H2O. |
p p |
|
Пример 3. Описать химическую связь в комплексных ионах
[Fe(H2O)6]2 и [Fe(CN)6]4 с позиции метода валентных связей (ВС) и
указать: тип гибридизации орбиталей иона-комплексообразователя;
геометрию комплексного иона; его магнитные свойства.
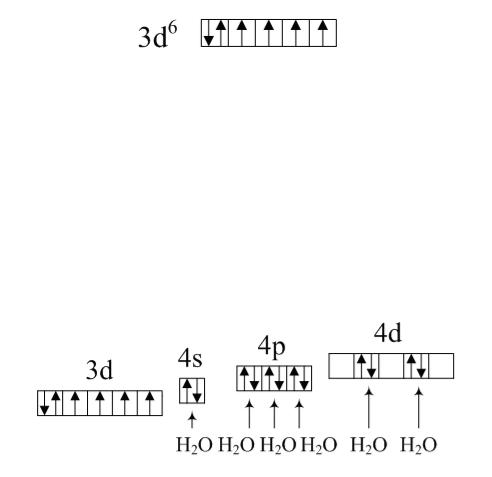
Ответ. В обоих комплексных ионах комплексообразователем является ион Fe2 , имеющий следующее строение внешнего электронного слоя:
Орбитали 4-го слоя (4s, 4p, 4d и 4f) пусты. Вода является лигандом слабого поля (работа на образование пары электронов меньше выигрыша в энергии при образовании химической связи), и поэтому электронная конфигурация свободного иона сохранится неизменной в комплексе.
Молекулы воды по донорно-акцепторному механизму поставляют электронные пары (каждая молекула по одной) на пустые орбитали иона-
комплексообразователя:
92
Эти шесть орбиталей объединяются в гибридную комбинацию sp3d2. Ей соответствует октаэдрическая форма расположения лигандов вокруг центрального иона. Поскольку в гибридную комбинацию вовлечены d-орбитали внешнего слоя, то к маркировке типа гибридизации добавляется слово «внешняя». Наличие неспаренных электронов обуславливает парамагнитность комплекса.
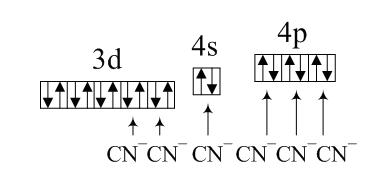
Анион CN является лигандом сильного поля (выигрыш в энергии при образовании химической связи превышает работу на образование пары электронов), и поэтому электроны 3d-орбитали будут объединены в пары и две из них окажутся свободными. Они и последующие 4s- и 4p-орбитали и будут заполняться по донорно-акцепторному механизму электронными парами ионов CN (по одной от каждого аниона):
Эти шесть орбиталей объединяются в гибридную комбинацию d2sp3(sp3d2). Комплексный анион имеет форму октаэдра и характеризуется диамагнитными свойствами в силу отсутствия неспаренных электронов.
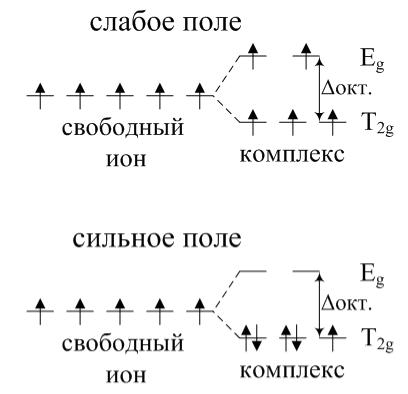
Пример 4. На основе представлений теории кристаллического поля
(ТКП) распределить по T2g и Eg орбиталям в сильном и слабом октаэдрических полях лигандов электроны центрального иона с конфигурацией nd5. Привести примеры таких комплексов.
93
Ответ.
Электронную конфигурацию nd5 имеют, например, ионы Mn2 и
Fe3 (3d5). Примерами комплексов слабого поля являются гексааква-
ионы, а комплексами сильного поля – гексациано-ионы.
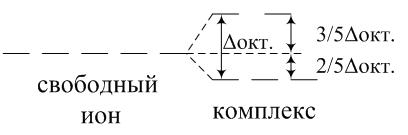
Пример 5. Рассчитать энергию стабилизации кристаллическим полем (ЭСКП) для комплексов, указанных в примере 4. Будут ли окрашены эти комплексные ионы?
Ответ. ЭСКП отражает выигрыш в энергии при образовании химических связей, обусловленный расщеплением пятикратно вырожденного уровня энергии d-орбиталей в свободном ионе на две группы различных по энергии орбиталей. В частности в октаэдрическом поле лигандов
94
Если на T2g -орбиталях находится n электронов, а на Eg – m
электронов, то абсолютная величина ЭСКП равна:
|
2 |
|
3 |
|
|
|
ЭСКП |
|
n |
|
m |
окт.. |
|
5 |
5 |
|||||
|
|
|
|
Для приведённых в примере 4 комплексов в слабом поле
|
2 |
|
3 |
|
|
|
|
ЭСКП |
|
3 |
|
2 |
|
окт. 0, |
|
5 |
5 |
||||||
|
|
|
|
|
а в сильном поле
|
2 |
|
3 |
|
|
|
|
ЭСКП |
|
5 |
|
0 |
|
окт. 2 окт.. |
|
5 |
5 |
||||||
|
|
|
|
|
Как видно, в рамках ТКП комплексы ионов с электронной
конфигурацией nd5с лигандами слабого поля должны быть непрочными,
что и подтверждается примерами ионов Mn2 и Fe3 .
ТКП даёт простую трактовку вопроса о наличии или отсутствии окраски у комплексного соединения (иона). Бесцветны должны быть
комплексы с электронной конфигурацией nd0 или nd10, а все остальные – окрашены. Таким образом, в рамках этих представлений комплексные
ионы с электронной конфигурацией центрального иона nd5 должны быть окрашены, в частности комплексы ионов Mn2 и Fe3 .
Пример 6. Написать не менее 3-х уравнений реакций, позволяющих перевести малорастворимый в воде AgCl в раствор за счёт
95
комплексообразования. Как качественно сравнить прочность этих комплексных ионов?
Ответ. Малорастворимый в воде хлорид серебра легко переходит в растворимое состояние за счёт комплексообразования
а) в избытке хлоридного раствора:
AgCl(к) 2NaCl(изб.) Na[AgCl2](р-р);
б) в избытке водного раствора аммиака и аминов:
AgCl(к) 2NH3(изб.) [Ag(NH3)2]Cl(р-р) ;
AgCl(к) 2CH3NH2(изб.) [Ag(CH3NH2)2]Cl(р-р);
в) в избытке раствора тиосульфата натрия:
AgCl(к) 2Na2S2O3(изб.) Na3[Ag(S2O3)2](р-р) ;
г) в избытке раствора цианида калия:
AgCl(к) 2KCN(изб.) K[Ag(CN)2](р-р).
Сопоставление прочности комплексных ионов, образованных одним и тем же центральным ионом, можно произвести на основе положения лигандов в спектрохимическом ряду – ряду по силе поля лигандов. Из чего следует, что самым непрочным из четырёх комплексных ионов будет
[AgCl2] , а самым прочным – [Ag(CN)2] . Аммиачный и тиосульфатный комплексы будут характеризоваться промежуточной прочностью.
Вариант 1
1.Дать названия следующим комплексным соединениям и указать внутреннюю и внешнюю сферы: K2[HgI4], [Cr(H2O)5Cl]Cl2.
2.Написать уравнения реакций:
K2[Zn(OH)4] H2SO4(изб.)
96
AgCl NH3(изб.)
FeCl3 KCN(изб.)
3. Описать химическую связь в комплексных ионах [NiF4]2 и
[Ni(CN)4]2 с позиции метода ВС и указать геометрию комплексного иона и его магнитные свойства.
4. На основе представлений ТКП распределить по T2g - и
Eg-орбиталям в сильном и слабом октаэдрических полях лигандов
электроны центрального иона с конфигурацией nd6. Привести примеры таких комплексов.
5.Рассчитать ЭСКП для комплексов, указанных в задании 4. Будут ли окрашены эти комплексные ионы?
6.Написать уравнения реакций приготовления реактива,
используемого для проведения «реакции серебряного зеркала», из нитрата
серебра. Написать уравнения реакций окисления этим реактивом
формальдегида и глюкозы.
Вариант 2
1.Дать названия комплексным соединениям H[AuCl4] и
[Cu(NH3)2]Cl. Указать ион-комплексообразователь и его к.ч.
2. Написать уравнения реакций:
SnO NaOH(изб.) H2O
K4[Fe(CN)6] K2Cr2O7 H2SO4
CuO H2O en(изб.)
97
3. Описать химическую связь в комплексном ионе [Co(NH3)6]3 и
молекуле Ni(CO)4 с позиции метода ВС и указать тип гибридизации
орбиталей иона-комплексообразователя и геометрическую форму частиц. 4. На основе представлений ТКП распределить по T2g - и
Eg-орбиталям в сильном и слабом октаэдрических полях лигандов
электроны центрального иона с конфигурацией nd4. Привести примеры таких комплексов.
5.Рассчитать ЭСКП для комплексов, указанных в задании 4. Будут ли окрашены эти комплексные ионы?
6.Написать не менее 3-х уравнений реакций, позволяющих перевести малорастворимый в воде CuI в раствор за счёт комплексообразования. Имеют ли окраску полученные соединения?
Вариант 3
1. Какие к.ч. наблюдаются для комплексов с центральным ионом,
имеющим заряд +1, +2, +3? Привести примеры и дать названия комплексным соединениям.
2. Написать уравнения реакций:
AgBr Na2S2O3(изб.)
Na2[Sn(OH)4] H2O2
[Ag(NH3)2]OH KCN(изб.)
3. Описать химическую связь в комплексных ионах [Co(H2O)6]3 и
[Co(NH3)6]3 с позиции метода ВС и указать тип гибридизации орбиталей центрального иона и магнитные свойства комплексов.
98
4.Привести схему расщепления энергии d-орбиталей в тетраэдрическом поле лигандов. Как вычисляется ЭСКП в этом случае?
5.Среди приведённых комплексных ионов указать бесцветные: [Mg(H2O)6]2 ; [AlF6]3 ; [MnF6]4 ; [HgS2]2 ; [AgCl2] ; [Ni(CN)4]2 .
Ответ аргументировать.
6. Написать уравнение качественной реакции на многоатомные спирты с щелочной взвесью Cu(OH)2 на примере этиленгликоля.
Написать не менее 2-х уравнений реакций разрушения полученного комплексного соединения.
Вариант 4
1. Дать названия следующим комплексным соединениям и указать
внутреннюю и внешнюю сферы: [Pt(NH3)2NO2Cl]SO4;
[Co(NH3)3(NO2)3].
2. Написать уравнения реакций:
Pb KOH(изб.) H2O
SiO2 HF(изб.)
FeSO4 KCN(изб.)
3. Описать химическую связь в молекулах карбонилов Fe(CO)5и
Mo(CO)6 с позиции метода ВС и указать: тип гибридизации орбиталей
центрального иона, геометрическую |
форму молекул и их магнитные |
|||
свойства. |
|
|
|
|
4. На |
основе представлений |
|
ТКП распределить по |
T2g - и |
Eg-орбиталям |
в сильном и слабом |
октаэдрических полях |
лигандов |
|
99
