
Влияние внешних условий на равновесие.
1. Влияние давления:
Соотношение между константами Кр и КN выражается в виде:
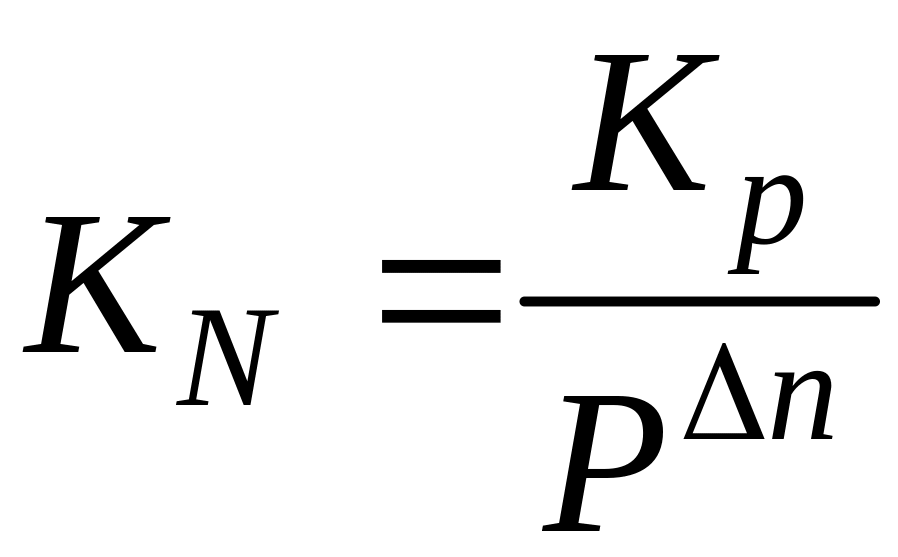 ;
;
Из выражения следует, что константа КN будет зависеть от общего давления в системе. Характер этого влияния определяется членом ∆n. Если реакция идет с увеличением числа молей, то есть ∆n > 0, рост давления смещает равновесие справа налево; если с уменьшением числа молей, то есть ∆n < 0, с ростом давления равновесие смещается слева направо; если без изменения числа молей (∆n = 0), изменение давления на сдвиг равновесия не влияет. В последнем случае Кр = КN.
Примечание: в ряде случаев реакционная смесь может быть разбавлена газом, инертным по отношению к участникам реакции. Влияние ввода этого газа на равновесие аналогично уменьшению общего давления в системе.
2. Влияние температуры:
Уравнения изобары и изохоры.
Для вывода используется уравнение Гиббса-Гельмгольца:

Вывод уравнения изобары:
В уравнение Гиббса подставляется уравнение изотермы для состояния равновесия ( P ≤ 1атм ).
∆GT0 = –RTlnКр;
–RTlnКр
= ∆H
– RTlnКр
–
 ;
;
 – уравнение изобары
в дифференциальном виде;
– уравнение изобары
в дифференциальном виде;
Интегрирование при H = const:

 ;
;
По этому уравнению, зная две константы при двух температурах, можно определить ∆H или, зная тепловой эффект и константу при какой-либо температуре, легко можно определить константу при любой другой температуре.

 ;
;
Графический анализ уравнения.

Из графика следует: для экзотермической реакции рост температуры приводит к сдвигу равновесия справа налево; для эндотермической – слева направо. Если протекание реакции не сопровождается поглощением или выделением тепла (∆H = 0), изменение температуры на равновесие не влияет.
Примечание: для качественного определения сдвига равновесия при изменении тех или иных внешних факторов используют принцип Ле-Шателье: Если на систему, находящуюся в равновесии, оказывают внешнее воздействие, в системе идет сдвиг равновесия, ослабляющий это воздействие.
Третье начало термодинамики.
Включает тепловую теорему Нернста и постулат Планка. Последний имеет прикладное значение при расчёте химического равновесия.
Постулат Планка:
В области абсолютного нуля температуры энтропия правильно сформированного кристалла равна нулю (T = 0 K, S = 0). Это подтверждается и формулой Больцмана, так как при 0 K термодинамическая вероятность системы W равна 1, то S = 0. Постулат Планка не является абсолютно строгим, так как некоторые составляющие энтропии, обусловленные спиновым и изотропным эффектами, не будут равны нулю, но при протекании химических реакций ими пренебрегают. Практическое значение постулата Планка заключается в возможности теоретического расчета абсолютного значения энтропии.
Например:
 ;
;
 ;
;
Обычно справочные
значения абсолютных энтропий рассчитывают
в интервале 0 – 298 K.
(![]() – справочное значение).
– справочное значение).
Теоретический расчёт химического равновесия
Теоретический расчёт химического равновесия проводят с использованием абсолютных значений энтропии.
1. Расчёт
![]() – стандартного изменения энергии Гиббса
при стандартной температуре (a
= 1, T
= 298 K).
– стандартного изменения энергии Гиббса
при стандартной температуре (a
= 1, T
= 298 K).
a)
=
![]() – 298∙
– 298∙![]() ;
;
= ∑nкон( )кон – ∑n исх( )исх;
б)
= ∑nкон(![]() )кон
– ∑nисх(
)исх;
)кон
– ∑nисх(
)исх;
– изменение энергии Гиббса при образовании какого-либо соединения из простых веществ. Для простых веществ она равна нулю.
Примечание: при расчёте пользуются обоими методами.
2.
Расчёт
![]() (a
= 1, T
= любая).
(a
= 1, T
= любая).
a)
=
![]() ;
;
![]() =
+
=
+
 –
уравнение Кирхгофа.
–
уравнение Кирхгофа.
 ;
;
 ;
;
Для реакции в
целом:
 ;
;
 ;
;
 ;
;
![]()
![]() – значения двойных
интегралов, рассчитанных авторами
метода при соответствующих коэффициентах
теплоёмкости.
– значения двойных
интегралов, рассчитанных авторами
метода при соответствующих коэффициентах
теплоёмкости.
б)
 ;
;
Заменим константы Кр на Ka, вместо ∆H подставим интегральную форму уравнения Кирхгофа, когда ∆Cp = f(T).
 ;
;
Интегрируем и домножаем обе части на –RT, учитывая
–RTlnKa = ∆G0T
 ,
где
Y
– константа интегрирования в этом
выражении. Для её определения вместо
∆G0T
подставляют ∆G0298,
а вместо T
– 298 К. Далее расчёт проводят при
температуре, которая задана.
,
где
Y
– константа интегрирования в этом
выражении. Для её определения вместо
∆G0T
подставляют ∆G0298,
а вместо T
– 298 К. Далее расчёт проводят при
температуре, которая задана.
Примечание: в расчётном задании ∆G0T считают обоими методами.
