
Правило отбора.
В квантовой механике возникают особые правила отбора, ограничивающие число возможных переходов электрона в атоме, связанных с испусканием или поглощением света. Если бы таких правил отбора не существовало, то число линий в спектрах излучения и поглощения атома было бы произвольно велико.
Оказывается, например, что в атомах, где существует две системы энергетических уровней — одиночные (синглетные) и тройные (триплетные) (гелий, ртуть),— практически не наблюдается переходов между синглетными и триплетными уровнями
Переходы между уровнями называются разрешенными переходами, если матричный элемент дипольного перехода отличен от нуля. В этом случае спектральные линии интенсивные. Переходы между уровнями называются запрещенными переходами, если матричный элемент дипольного перехода равен нулю.
Разрешенные переходы удовлетворяют правилу отбора:
![]() ,
,
где nf и ni — квантовые числа конечного и начального состояния соответственно. То есть, переходы могут происходить только между соседними состояниями.
Для магнитного
квантового числа
![]() .
.
Свет,
который испускается при переходе с ![]() ,
линейно поляризован.
При переходах с
,
линейно поляризован.
При переходах с ![]() испускается
циркулярно- поляризованный свет.
испускается
циркулярно- поляризованный свет.
Для квантового
числа полного момента многоэлектронной
системы
![]() .
.
Кроме того, запрещены переходы между состояниями, в которых оба квантовых числа полного момента равны нулю.
Для орбитального
квантового числа
![]() .
.
Если
говорить о многоэлектронных системах
в атомах, то нужно учитывать следующие
правила отбора:
1. Переходы
между термами разной мультиплетности запрещены.
2.
Магнито-дипольные переходы запрещены,
если меняется радиальное
квантовое число.
3. Переходы EL имеют
четность (-1)L ,
переходы ML — (-1)L+1.
4.
Для переходов EL и ML имеет место
неравенство ![]() ,где
,где ![]() —
изменение орбитального квантового
числа,
—
изменение орбитального квантового
числа, ![]() и
и ![]() —
начальный и конечный полный момент.
—
начальный и конечный полный момент.
Многоэлектронные атомы- атомы, содержащие более одного валентного электрона.
Распределение электронов по состояниям.
Согласно классической теории, электроны в основном (невозбужденном) состоянии атома должны занимать самый нижний, т. е. основной, энергетический уровень. Однако, как оказалось впоследствии, заполнение электронных оболочек атома подчиняется принципу, сформулированному Паули на основе обобщения опытных данных.
Порядок заполнения электронных состояний определяется двумя принципами:
принцип Паули: в атоме может быть только один электрон с данным набором квантовых чисел;
Принцип
Паули в простейшей формулировке: в одном
и том же атоме не может быть более одного
электрона с одинаковым набором четырех
квантовых чисел n, ![]() ,
, ![]() и
и ![]() .,
т. е. Z (n,
,
и
)=0
или 1, где Z (n,
,
и
)
— число электронов, находящихся в
квантовом состоянии, описываемом набором
четырех квантовых чисел: n,
,
и
.
Таким образом, принцип Паули утверждает,
что два электрона, связанные в одном и
том же атоме, различаются значениями
по крайней мере одного квантового числа.
.,
т. е. Z (n,
,
и
)=0
или 1, где Z (n,
,
и
)
— число электронов, находящихся в
квантовом состоянии, описываемом набором
четырех квантовых чисел: n,
,
и
.
Таким образом, принцип Паули утверждает,
что два электрона, связанные в одном и
том же атоме, различаются значениями
по крайней мере одного квантового числа.
принцип минимума энергии: Электроны заселяют атомные орбитали, начиная с подуровня с меньшей энергией. Следует учесть, что вследствие взаимодействия электронов друг с другом значения энергии зависят не только от главного квантового числа n, но и от орбитального l.
Совокупность электронов атома с заданным значением главного квантового числа n образует электронную оболочку атома (эти электроны объединяют близкие значения энергии и средняя удаленность от ядра; из последнего родилось и название).
Механический и магнитный моменты(спин) атома
Механический
момент:
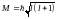 ,
где
-
орбитальное квантовое число
,
где
-
орбитальное квантовое число
Собственный магнитный
момент:
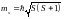
Спин - собственный магнитный момент количества движения элементарной частицы имеет квантовую природу. Спин электрона характеризуется спиновым квантовым числом ms, которое может быть равно +1/2 и −1/2.
Отношение магнитного момента к механическому моменту электрона, называется магнитомеханическим отношением или g-фактором.
