
- •24. Металлическая связь
- •[Природа
- •[История
- •]Свойства
- •]В воде [Механизм Гротгуса
- •]В нуклеиновых кислотах и белках
- •]В полимерах
- •25. Гибридизация
- •Особенности молекул, содержащих σ-связи
- •28. Механизм образования связи
- •Валентность атомов. Перекрывание атомных орбиталей
- •Гибридизация атомных орбиталей. Геометрическая форма частиц
- •Гибридизация атомных орбиталей. Геометрическая форма частиц
- •Геометрическая форма молекул и реакционная способность веществ
- •]Определение
- •]Связь с термодинамической устойчивостью системы
- •]Применение в химии []Связь с химическим потенциалом
- •]Историческая справка
- •30. Энергетические эффекты химических реакций
- •31. Превращение энергии при химических реакциях
- •]Определение
- •]Связь с термодинамической устойчивостью системы
- •]Применение в химии ]Связь с химическим потенциалом
- •Направленность химических процессов
- •[Определение
- •]Связь с термодинамической устойчивостью системы
- •]Применение в химии ]Связь с химическим потенциалом
- •]Энергия Гиббса и направление протекания реакции
- •]Историческая справка
- •35. []Скорость химической реакции
- •]Порядок химической реакции
- •]Реакция нулевого порядка
- •[]Реакция первого порядка
- •]Реакция второго порядка
- •]Молекулярность реакции
- •]Катализ
- •]Катализ в биохимии
- •]Равновесие
- •Способы выражения константы равновесия
- •]Стандартная константа равновесия
- •]Константа равновесия реакций в гетерогенных системах
- •]Константа равновесия и изменение энергии Гиббса
- •39. Гомогенные и гетерогенные реакции
- •Закон действующих масс
- •]Закон действующих масс в химической кинетике
- •]Закон действующих масс в химической термодинамике
- •]Методы расчета константы равновесия
- •[Править]Энтропийный расчёт изменения энергии Гиббса и константы равновесия реакции
]Историческая справка
Энергия Гиббса названа в честь одного из основателей термодинамики, Джозаи Уилларда Гиббса.
\Химическая кинетика или кинетика химических реакций — раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений.[1]
35. []Скорость химической реакции
Важным понятием химической кинетики является скорость химической реакции. Эта величина определяет, как изменяется концентрация компонентов реакции с течениемвремени. Скорость химической реакции — величина всегда положительная, поэтому если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение домножается на −1. Например для реакции
![]() скорость
можно выразить так:
скорость
можно выразить так:
![]()
В 1865 году Н. Н. Бекетовым и в 1867 году К. М. Гульдбергом и П. Вааге был сформулирован закон действующих масс, согласно которому скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведённым в некоторые степени. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы: природа реагирующих веществ, наличие катализатора, температура (правило Вант-Гоффа) и площадь поверхности раздела фаз.
]Порядок химической реакции
Порядок реакции по данному веществу — показатель степени при концентрации этого вещества в кинетическом уравнении реакции.
]Реакция нулевого порядка
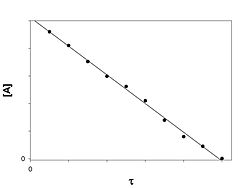
График зависимости концентрации реагента A в реакции A → B от времени для нулевого порядка реакции
Кинетическое уравнение имеет следующий вид:
![]()
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ. Нулевой порядок характерен, например, для гетерогенных реакций в том случае, если скорость диффузии реагентов к поверхности раздела фаз меньше скорости их химического превращения.
[]Реакция первого порядка
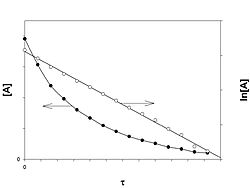
График зависимости концентрации реагента A для первого порядка реакции
Кинетическое уравнение реакции первого порядка:
![]()
Приведение уравнения к линейному виду даёт уравнение:
![]()
Константа скорости реакции вычисляется как тангенс угла наклона прямой к оси времени:
![]()
Период полупревращения:
![]()
]Реакция второго порядка
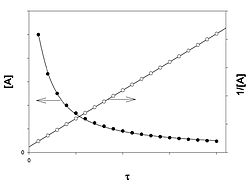
График зависимости концентрации реагента A для второго порядка реакции
Для реакций второго порядка кинетическое уравнение имеет следующий вид:
![]()
или
![]()
В первом случае скорость реакции определяется уравнением
![]()
Линейная форма уравнения:
![]()
Константа скорости реакции равна тангенсу угла наклона прямой к оси времени:
![]()
![]()
Во втором случае выражение для константы скорости реакции будет выглядеть так:
![]()
Период полупревращения (для случая равных начальных концентраций!):
![]()
]Молекулярность реакции
Молекулярность элементарной реакции — число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия.
Мономолекулярные реакции — реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация и т. д.):
H2S → H2 + S
Бимолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных):
СН3Вr + КОН → СН3ОН + КВr
Тримолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении трех частиц:
О2 + NО + NО → 2NО2
Реакции с молекулярностью более трёх неизвестны.
Для элементарных реакций, проводимых при близких концентрациях исходных веществ, величины молекулярности и порядка реакции совпадают. Чётко определенной взаимосвязи между понятиями молекулярности и порядка реакции нет, так как порядок реакции характеризует кинетическое уравнение реакции, а молекулярность — механизм реакции.
