
6) Изобарный процесс
Основная статья: Изобарный процесс
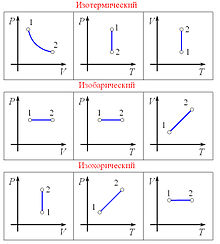
![]()
Графики изопроцессов в различных системах координат
Изобарный
процесс (др.-греч.
ισος, isos — «одинаковый» + βαρος,
baros — «вес») — процесс изменения
состояния термодинамической системы
при постоянном давлении (![]() )
)
![]()
Зависимость объёма газа от температуры при неизменном давлении была экспериментально исследована в 1802 году Жозефом Луи Гей-Люссаком. Закон Гей-Люссака: При постоянном давлении и неизменных значениях массы газа и его молярной массы, отношение объёма газа к его абсолютной температуре остаётся постоянным: V/T = const.
Изохорный процесс
Основная статья: Изохорный процесс
Изохорный
процесс (от
греч. хора — занимаемое место) —
процесс изменения состояния
термодинамической системы при постоянном
объёме (![]() ).
Для идеальных газов изохорический
процесс описывается законом
Шарля:
для данной массы газа при постоянном
объёме, давление прямо пропорционально
температуре:
).
Для идеальных газов изохорический
процесс описывается законом
Шарля:
для данной массы газа при постоянном
объёме, давление прямо пропорционально
температуре:
![]()
Линия, изображающая изохорный процесс на диаграмме, называется изохорой.
Ещё стоит указать что поданная к газу энергия расходуется на изменение внутренней энергии то есть Q = 3* ν*R*T/2=3*V*ΔP, где R — универсальная газовая постоянная, ν количество молей в газе, T температура в Кельвинах, V объём газа, ΔP приращение изменения давления. а линию, изображающая изохорный процесс на диаграмме, в осях Р(Т), стоит продлить и пунктиром соединить с началом координат, так как может возникнуть недопонимание.
Изотермический процесс
Основная статья: Изотермический процесс
Изотермический
процесс (от
греч. «термос» — тёплый, горячий) —
процесс изменения состояния
термодинамической системы при постоянной
температуре (![]() )(
)(![]() ).
Изотермический процесс описывается законом
Бойля — Мариотта:
).
Изотермический процесс описывается законом
Бойля — Мариотта:
При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным: PV = const.
Изоэнтропийный процесс
Основная статья: Изоэнтропийный процесс
Изоэнтропийный
процесс —
процесс изменения состояния
термодинамической системы при постоянной
энтропии (![]() ).
Изоэнтропийным является, например,
обратимый адиабатический процесс: в
таком процессе не происходит теплообмена
с окружающей средой. Идеальный газ в
таком процессе описывается следующим
уравнением:
).
Изоэнтропийным является, например,
обратимый адиабатический процесс: в
таком процессе не происходит теплообмена
с окружающей средой. Идеальный газ в
таком процессе описывается следующим
уравнением:
![]()
где ![]() — показатель
адиабаты,
определяемый типом газа.
— показатель
адиабаты,
определяемый типом газа.
16) Теплова́я маши́на — устройство, преобразующее тепловую энергию в механическую работу (тепловой двигатель) или механическую работу в тепло (холодильник). Преобразование осуществляется за счёт изменения внутренней энергии рабочего тела — на практике обычно пара или газа.
Идеальная тепловая машина — машина, в которой произведённая работа и разница между количеством подведённого и отведённого тепла равны. Работа идеальной тепловой машины описывается циклом Карно.
При работе часть тепла Q1 передается от нагревателя к рабочему телу, а затем часть энергии Q2 передается холодильнику, который охлаждает машину КПД тепловой машины считается по формуле (Q1-Q2/Q1)х100
Периодически действующий двигатель, совершающий работу за счет получаемого извне тепла, называется тепловой машиной.
Коэффициентом полезного действия теплового двигателя (КПД) называется отношение работы, совершаемой двигателем, к количеству теплоты, полученному от нагревателя.
Коэффициент полезного действия любого теплового двигателя меньше единицы и выражается в процентах. Невозможность превращения всего количества теплоты, полученного от нагревателя, в механическую работу является платой за необходимость организации циклического процесса и следует из второго закона термодинамики.
Рабочим веществом может быть водяной пар или газ.
3) Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией взаимодействия молекулможно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
Модель широко применяется для решения задач термодинамики газов и задач аэрогазодинамики. Например, воздух при атмосферном давлении и комнатной температуре с большой точностью описывается данной моделью. В случае экстремальных температур илидавлений требуется применение более точной модели, например модели газа Ван-дер-Ваальса, в котором учитывается притяжение между молекулами.
Различают классический идеальный газ (его свойства выводятся из законов классической механики и описываются статистикой Больцмана) и квантовый идеальный газ (свойства определяются законами квантовой механики, описываются статистиками Ферми — Дирака или Бозе — Эйнштейна).
![]() .
(24.1)
.
(24.1)
Уравнение (24.1) называют основным уравнением молекулярно-кинетической теории.
12)
Парообразование —
свойство капельных жидкостей изменять
свое агрегатное состояние и превращаться
в пар.
Парообразование, происходящее лишь на
поверхности капельной жидкости,
называется испарением.
Парообразование по всему
объему жидкости называется кипением;
оно происходит при определенной
температуре, зависящей от давления.
Давление, при котором жидкость закипает
при данной температуре, называется давлением
насыщенных паров ![]() ,
его значение зависит от рода жидкости
и ее температуры.
,
его значение зависит от рода жидкости
и ее температуры.
Испаре́ние — процесс перехода вещества из жидкого состояния в газообразное (пар). Процесс испарения является обратным процессу конденсации (переход из парообразного состояния в жидкое). Испарение (парообразование), переход вещества из конденсированной (твердой или жидкой) фазы в газообразную (пар); фазовый переход первого рода.
Существует более развёрнутое понятие испарения в высшей физике.
Испаре́ние — это процесс, при котором с поверхности жидкости или твёрдого тела вылетают (отрываются) частицы (молекулы, атомы), при этом Ek > Eп.
Кипе́ние — процесс парообразования в жидкости (переход вещества из жидкого в газообразное состояние), с возникновением границ разделения фаз. Температура кипения при атмосферном давлении приводится обычно как одна из основных физико-химических характеристик химически чистого вещества.
Кипение является фазовым переходом первого рода. Кипение происходит гораздо более интенсивно, чем испарение с поверхности, из-за образования очагов парообразования, обусловленных как достигнутой температурой кипения, так и наличием примесей[1].
На процесс образования пузырьков можно влиять с помощью давления, звуковых волн, ионизации. В частности, именно на принципе вскипания микрообъёмов жидкости от ионизации при прохождении заряженных частиц работает пузырьковая камера.
Кипячение — нагревание жидкости (обычно воды) до температуры кипения. Физический способ дезинфекции.
Конденса́ция паров (лат. condense — уплотняю, сгущаю) — переход вещества в жидкое или твёрдое состояние из газообразного. Максимальная температура, ниже которой происходит конденсация, называется критической. Пар, из которого может происходить конденсация, бывает насыщенным или ненасыщенным.
