
- •Физика атома, твёрдого тела и атомного ядра Литература
- •Глава 1. Физика атома §1. Проблема строения атома. Опыты Резерфорда
- •§2. Атом Бора
- •§3. Корпускулярно-волновая природа света и частиц
- •§4. Уравнение Шрёдингера
- •§ 5. Квантовая модель атома водорода
- •§ 6. Периодическая система элементов Менделеева.
- •§7. Спектры многоэлектронных атомов
- •§8. Эффект Зеемана и Штарка
- •§9. Взаимодействие быстрых электронов с веществом
- •§10. Люминесценция
- •§11. Индуцированное излучение. Лазеры.
- •Глава 2. Физика твердого тела.
- •§ 12. Энергетические зоны.
- •Но опыт показывает, что cv металлов, как и диэлектриков, ближе к 3r. В этом суть парадокса теплоемкости.
- •§13. Электрическое сопротивление металлов. Сверхпроводимость.
- •3. Эффекты сверхпроводимости.
- •Глава 3. Физика атомного ядра §17. Естественная радиоактивность
- •8. Физические величины характеризующие радиоактивность, и единицы их измерения
- •§18. Проблема строения атомного ядра
§ 5. Квантовая модель атома водорода
1. Квантовые числа.
Уравнение Шрёдингера в задаче о движении
электрона в электрическом поле ядра
решается в трёхмерном пространстве в
сферической системе координат.
Координатами в этой системе являются
радиус 0 ≤ r ≤ ∞,
полярный угол 0 ≤ θ ≤ π,
азимутальный угол 0 ≤ φ ≤ 2π.
Решение уравнения Шрёдингера представляет
собой произведение трёх функций по трём
независимым координатам,
![]() ,
и потому включает в себя три целочисленные
параметра – квантовые числа n,
l, m.
Их названия сложились исторически.
,
и потому включает в себя три целочисленные
параметра – квантовые числа n,
l, m.
Их названия сложились исторически.
n – главное квантовое число. Оно входит в радиальную часть решения R(r) и определяет уровень энергии. Число n может принимать только целые положительные значения, n = 1, 2, 3, ...
l – азимутальное квантовое число. Оно входит в описание функции Ψ в широтном направлении. Число l может принимать целые положительные значения конечного ряда чисел, l = 0, 1, 2, ... n – 1. Каждому энергетическому уровню с номером n соответствует n значений азимутального квантового числа l.
m – магнитное квантовое число. Оно входит в описание функции Ψ в меридиональном направлении. Число m принимает 2l+1 значений конечного ряда: m = 0, ±1, ±2, ±3, ±... ±l.
Энергия электрона в атоме водорода зависит только от главного квантового числа n. Каждому разрешённому n-му уровню энергии соответствует несколько собственных функций Ψ, отличающихся набором значений квантовых чисел l и m. Это значит, что, будучи на одном и том же энергетическом уровне, атом водорода может находиться в нескольких разных состояниях.
Состояния с одинаковой энергией называются вырожденными, а число разных состояний с одним значением энергии называется кратностью вырождения соответствующего энергетического уровня. Поскольку каждому из n значений квантового числа l соответствует 2l+1 значений квантового числа m, то число разных состояний, соответствующих уровню n, равно
![]() (5.1)
(5.1)
Отсюда следует, что невозбуждённый атом водорода на уровне n = 1 может находиться в одинаково возможном (основном) состоянии. Возбуждённому уровню n = 2 соответствует 22 = 4 возможных состояний, уровню n = 3 – 32 = 9 возможных состояний и т.д.
Часто энергетические уровни обозначают большими буквами латинского алфавита.
n = 1, K-уровень;
n = 2, L-уровень;
n = 3, M-уровень;
n = 4, N-уровень;
n = 5, O-уровень;
n = 6, P-уровень;
n = 7, Q-уровень.
Состояния с разными азимутальными квантовыми числами l обозначают малыми буквами латинского алфавита. Часть этих букв пришла из спектроскопии (первые буквы в названии спектральных серий щелочных металлов).
l = 0, s-подуровень (от англ. sharp – резкий);
l = 1, p-подуровень (от англ. principal – резкий);
l = 2, d-подуровень (от англ. diffuse – размытый);
l = 3, f-подуровень (от англ. fundamental – основной);
l = 4, g-подуровень;
l = 5, h-подуровень.
Обычно состояние электрона в атоме обозначают так:
1s-состояние, n = 1, l = 0.
2s-состояние, n = 2, l = 0.
2p-состояние, n = 2, l = 1.
3d-состояние, n = 3, l = 2, и т.д.
2. Атом водорода в основном состоянии. Главное квантовое число n = 1. Квантовые числа l и m могут принимать единственные значения l = 0 и m = 0. Кратность вырождения n2 = 12 = 1. Основное состояние (невозбуждённое) атома водорода единственно возможное.
Функция Ψ представлена лишь радиальной составляющей,
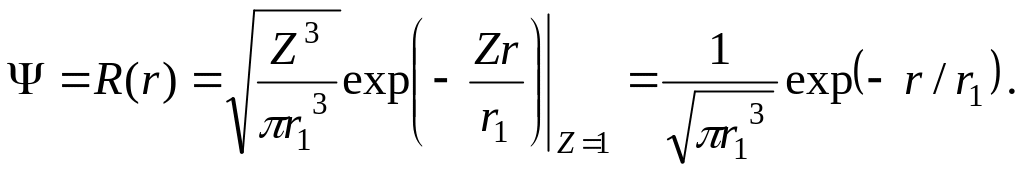 (5.1)
(5.1)
Здесь r1 –
боровский радиус, Z = 1
– номер элемента водорода в таблице
Менделеева. Но это значит, что
![]() также
зависит лишь от радиуса r.
Электрон с равной вероятностью может
быть обнаружен в любой точке сферы
определённого радиуса. Говорят,
электронное облако имеет
центрально-симметричную форму.
также
зависит лишь от радиуса r.
Электрон с равной вероятностью может
быть обнаружен в любой точке сферы
определённого радиуса. Говорят,
электронное облако имеет
центрально-симметричную форму.
На рис. 19 показана зависимость функции Ψ, а на рис. 20 – зависимость функции от расстояния r до ядра. Обе функции убывают монотонно с ростом r, постепенно стремясь к нулю. Поэтому формально не равна нулю вероятность пребывания электрона на сколь угодно больших расстояниях от ядра.
Если в качестве объёма атома брать объём, вероятность пребывания в котором электрона равна единице, то объём атома будет равен бесконечности. Поэтому договорились принимать в качестве объёма атома такой объём, вероятность пребывания в котором электрона составляет 0,9 (90%).
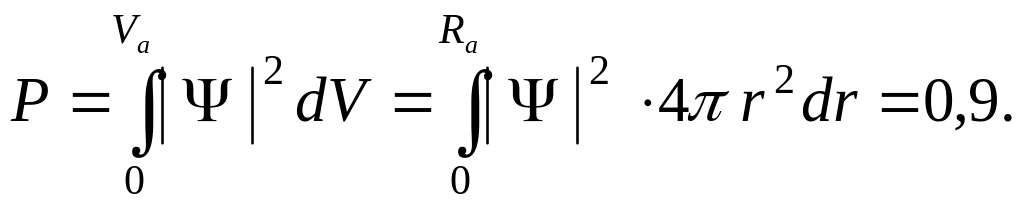 (5.2)
(5.2)
Выражение
![]() представляет собой элементарный
сферический объём, Va
и Ra
– объём и радиус шара, вероятность
пребывания в котором электрона равна
0,9 (рис. 21).
представляет собой элементарный
сферический объём, Va
и Ra
– объём и радиус шара, вероятность
пребывания в котором электрона равна
0,9 (рис. 21).
Из того, что подинтегральная функция
не
,
а
![]() следует, что для оценки вероятности
пребывания электрона на разных расстояниях
r в сферическом облаке
более информативна не объёмная
плотность вероятности
(численно – вероятность в единице
объёма), а радиальная плотность
вероятности
следует, что для оценки вероятности
пребывания электрона на разных расстояниях
r в сферическом облаке
более информативна не объёмная
плотность вероятности
(численно – вероятность в единице
объёма), а радиальная плотность
вероятности
![]() (численно – вероятность в сферическом
слое единичной толщины). Хотя функция
монотонно убывает, за счёт быстро
возрастающего множителя r2
выражение
в начале растёт и на некотором расстоянии
r1 от ядра
обнаруживает максимум (рис. 22).
Оказалось, что это расстояние r1
равно боровскому радиусу атома водорода,
(численно – вероятность в сферическом
слое единичной толщины). Хотя функция
монотонно убывает, за счёт быстро
возрастающего множителя r2
выражение
в начале растёт и на некотором расстоянии
r1 от ядра
обнаруживает максимум (рис. 22).
Оказалось, что это расстояние r1
равно боровскому радиусу атома водорода,
![]() нм.
нм.
Но трактовка одного и того же числа r1 разная. В теории Бора r1 – это радиус круговой орбиты, на которой электрон находится постоянно. В квантовой теории r1 – это радиус сферы, вероятность пребывания в окрестности которой у электрона максимальна.
Механический момент у электронного облака в 1s-состоянии равен нулю. Из формулы (4.22)
![]() (5.3)
(5.3)
Магнитный момент электрона в 1s-состоянии также равен нулю. Из формулы (2.18)
![]() (5.4)
(5.4)
[Для сравнения: в атоме Бора моменты не
равны нулю.
![]()
![]() ].
].
Энергия электрона получается такой же, как и в атоме Бора (ф. 2.13)
![]()
Здесь me – масса электрона.
3. Возбуждённый атом водорода на энергетическом уровне n = 2. Кратность вырождения 22 = 4.
![]()
l = 0. Первое (2s) состояние отчасти повторяет предыдущее состояние 1s. Электронное облако центрально-симметричное. Функции Ψ и имеют более сложный характер (рис. 23 и 24). На расстоянии 2r1 от ядра функция Ψ имеет узел, то есть обращается в нуль. Сферическая поверхность, соответствующая Ψ = 0, называется узловой. (Функция Ψ в стационарном атоме толкуется как стоячая волна де Бройля. Этим объясняется использование слова «узел»).
Функция имеет два максимума. Слабый максимум на расстоянии r1 накладывается на максимум 1s-состояния. Сильный максимум находится на расстоянии 4r1. Графический образ электронного облака в 2s-состоянии показан на рис. 25. Механический и магнитный моменты электрона в 2s-состоянии равны нулю.
l = 1. На p-подуровне электрон может находиться в трёх состояниях, соответствующих m = 0, = ±1.
Если OZ – ось, относительно которой отсчитывается полярный угол θ, а OX – ось, от которой отсчитывается азимутальный угол φ, то электронные облака в 2p-состоянии располагаются, как показано на рис. 26.
В состоянии m = 0
облако напоминает гантель, расположенную
вдоль оси OZ. Состояния
m = +1
и m = –1
отличаются тем, что функция Ψ имеет в
противоположных областях разные знаки.
Но квадрат модуля
одинаков,
![]() Электронное облако в обоих состояниях
m = ±1
напоминает тор, образованный вращением
знака ∞ (бесконечность) вокруг оси OZ.
Оба облака вложены один в другой. На
рис. 26 штриховкой показаны сечения
изображающих электронные облака тел
вращения плоскостью XOZ.
Электронное облако в обоих состояниях
m = ±1
напоминает тор, образованный вращением
знака ∞ (бесконечность) вокруг оси OZ.
Оба облака вложены один в другой. На
рис. 26 штриховкой показаны сечения
изображающих электронные облака тел
вращения плоскостью XOZ.
Механический момент электрона в 2p-состоянии не равен нулю.
![]() (5.5)
(5.5)
Проекция механического момента электрона на ось Z может принимать значения:
![]() Здесь m = –1,
0, +1 – квантовое число.
Здесь m = –1,
0, +1 – квантовое число.
Магнитный момент электрона в 2p-состоянии
![]() (5.6)
(5.6)
Проекции магнитного момента электрона на ось Z могут принимать значения
![]()
Здесь me – масса электрона.
4. Возбуждённый атом водорода на энергетическом уровне n = 3. Кратность вырождения 32 = 9.
![]()
l = 0. Электронное облако в 3s-состоянии центрально-симметричное. График радиальной плотности вероятности для 3s-электрона показан на рис. 27. Максимумы кривой приходятся примерно на радиусы боровских орбит r1 4r1 9r1. Две сферические узловые поверхности имеют приблизительно радиусы 2r1 и 7r1.
Механический и магнитный моменты 3s-электрона равны нулю.
l = 1. Форма облаков в 3p-состоянии примерно такая же, как и в 2p-состоянии (рис. 26). Но радиальная плотность вероятности меняется. Появляется одна узловая поверхность – сфера с радиусом 6r1 (рис. 28). Поэтому при m = 0 «гантель» распадается на две области: малую область внутри этой сферы и «гантель» вне этой сферы.
При m = ±1 тор также распадается на две области. Маленький тор находится внутри сферы радиуса r = 6r1, большой – снаружи!
Механический L и магнитный pm моменты электрона в 3p-состоянии такие же, как и в 2p-состоянии (формулы 5.5 и 5.6).
l = 2. Форма облаков в 3d-состоянии скромнее. Их конфигурации и сечения показаны на рис. 29.
Облака в 3d-состоянии на имеют узловых поверхностей.
С дальнейшим ростом главного квантового числа n s-состояние всегда остаётся центрально-симметричным. Общая конфигурация электронных облаков в p, d, f ... состояниях в основном исчерпывается фигурами рис. 29.
5. Опыты Штерна и Герлаха. Улучшение разрешающей способности спектральных аппаратов привело к началу 20-х годов к появлению проблемы, не находившей своего объяснения. Спектроскописты открыли тонкую структуру спектральных линий. Многие линии, которые при слабом разрешении считались одиночными (синглеты), при сильном разрешении оказались двойными (дублеты), тройными (триплеты) и даже с большим числом линий (мультиплеты).
К этому времени (1921 г.) была основательно разработана теория Бора. Естественно, что с её помощью пытались объяснить в первую очередь спектры щелочных металлов, атомы которых были наиболее «водородоподобны». В центре атома щелочного металла находится остов – ион с зарядом +e, а вокруг этого иона движется слабо связанный с ним электрон.
Объяснить спектральные дублеты щелочных металлов можно было тем, что орбитальный магнитный момент электрона взаимодействует с магнитным моментом остова. Поэтому возник вопрос: действительно ли водородоподобные атомы имеют магнитный момент и если да, то квантован ли он?
В 1921 г. немцы Отто Штерн и Вальтер Герлах в прямых опытах доказали, что атомы имеют магнитный момент и что магнитный момент атомов квантован.
В сосуде с высоким вакуумом с помощью диафрагм В создавался узкий атомный пучок элемента, испарявшегося в печи К (рис. 30). Пучок проходит через сильно неоднородное магнитное поле между полюсами N и S магнита.
Один из наконечников (N) имел вид призмы с острым ребром, а вдоль другого (S) была выточена канавка. После прохождения магнитного поля пучок оставлял след на фотопластинке P.
Идея опыта была в том, что если атомы в пучке имеют магнитный момент, то в магнитном поле они должны вести себя как маленькие магнитики. В однородном магнитном поле на магнит действует вращающий момент, поэтому магнитный атом может изменять свою ориентацию. В неоднородном поле кроме момента на магнит действует ещё сила, при одной ориентации втягивающая его к ребру (в область большей магнитной индукции), при другой – к канавке (в область меньшей индукции). (См. Электричество, §14).
Если магнитного поля нет, то на пластинке Р должна получаться узкая полоска осаждённых атомов. Если поле есть, а атом ведёт себя как классический маленький маятник со случайной ориентацией магнитного момента, то полоска на пластинке Р должна уширяться, оставаясь сплошной. Если же магнитный момент атома квантован, то полоска должна расщепляться на несколько полос в зависимости от числа квантовых состояний.
Опыты проводились с атомами серебра Ag, водорода Н, лития Li и других щелочных металлов. Оказалось, что в случае атомов 1-й группы (Li, H, Ag) полоска расщеплялась на две симметрично расположенные полоски. Это говорит о том, что атомы 1-й группы имеют магнитный момент и способны принимать две ориентации – по полю и против поля.
В теории Бора это можно было объяснить наличием орбитального магнитного момента внешних электронов. Тем более вычисления показали, что магнитный момент атома водорода в опытах Штерна равен магнетону Бора. Но буквально через 3-4 года, когда на смену теории Бора пришла квантовая механика, стало ясно, что никакого расщепления атомы водорода и щелочных металлов давать не должны. По анализу Паули, сделанному в 1923 г., следовало, что магнитные моменты остовов атомов щелочных металлов равны нулю. А из решения уравнения Шрёдингера, полученного через три года, получалось, что внешний электрон в атомах водорода и щелочных металлов находится в s-состоянии, и его магнитный момент так же равен нулю. Откуда же взялся магнитный момент атомов в опытах Штерна?
6. Спин. В 1925 г. ответили на этот вопрос американцы Сэмюэль Гаудсмит и Джордж Юленбек. Они показали, что дублеты в спектрах и опыты Штерна и Герлаха можно объяснить, если предположить существование у электронов собственного механического и магнитного моментов. Идея спина оказалась очень плодотворной и быстро нашла признание.
В начале полагали, что спин электрона обусловлен его вращением вокруг собственной оси. (Отсюда название от английского to spir – вращаться). Но расчёты показали, что линейная скорость движения поверхности шарика-электрона в несколько раз должна превышать скорость света. Поэтому пришлось отказаться от столь наглядного толкования.
В настоящее время словом «спин» обозначают собственный механический момент элементарных частиц, имеющий квантовую природу. Спин задаёт пространственную ориентацию частицы.
Для определения состояния микрочастицы к трём квантовым числам n, l, m нужно добавить ещё одно – спиновое квантовое число s. Оказалось, что у электрона спиновое число может принимать только два значения, s = +1/2 и s = –1/2.
Собственный (спиновый) механический момент электрона может иметь лишь одно единственное значение (см. ф. 4.22).
![]() (5.7)
(5.7)
Проекция механического момента электрона на физическую ось z (например, линии магнитного поля в опытах Штерна) может принимать два значения (см. ф. 4.23).
![]() (5.8)
(5.8)
Это в 2 раза меньше минимального значения.
Из формулы (2.18) следует, что отношение орбитального магнитного момента М электрона к механическому L равно
![]() Орбитальное гиромагнитное отношение
(5.9)
Орбитальное гиромагнитное отношение
(5.9)
Опыт показывает, что спиновое гиромагнитное отношение в 2 раза больше.
![]() Спиновое гиромагнитное отношение
(5.10)
Спиновое гиромагнитное отношение
(5.10)
Отсюда спиновый магнитный момент
электрона
![]() (5.11)
(5.11)
Появление 4-го квантового числа s (спинового) увеличивает число состояний электрона на n-ном энергетическом уровне. Поскольку спиновое квантовое число s может принимать только два значения, то и число максимально возможных состояний электрона увеличивается в 2 раза и равно 2π2.
Таким образом, в 1s-состоянии, например, максимальное число электронов не один ,а два. В одном и том же центрально-симметричном облаке могут находиться в 1s-состоянии два электрона с противоположными спинами.
7. Излучение и поглощение света атомом водорода. Как и в теории Бора, излучение и поглощение света атомом квантовая механика связывает с переходами электрона с одного энергетического уровня на другой. Из дискретности энергетических уровней вытекает линейчатая структура спектров.
Опыт и теория показывают, что могут реализовываться не любые переходы электрона в атоме. Возможность перехода определяется правилами Бора. Их два.
Для азимутального квантового числа
l.
![]() (5.12)
(5.12)
Для магнитного квантового числа m.
![]() (5.13)
(5.13)
Что касается вероятности переходов электрона с одного уровня на другой, то решение уравнения Шрёдингера для электрона в центральном поле ядра не даёт ответа на этот вопрос. Все уровни представляются в смысле устойчивости равноценными. На каждом уровне электрон может находиться сколь угодно долго. Поэтому разные интенсивности спектральных линий не объясняются.
Для объяснения самопроизвольных переходов электрона нужно кроме электрона в поле ядра учитывать одновременно и поле излучения. То есть решать задачу для системы, состоящей из атома и поля излучения. Такая квантовая теория излучения была построена в первой трети 20 века. Она смогла объяснить не только интенсивность спектральных линий, но и поляризованность излучения.
На рис. 31 показана схема уровней
энергии атома водорода и разрешённые
пути перехода. Толщина линий соответствует
вероятности перехода. В соответствии
с правилом отбора по азимутальному
квантовому числу
![]() запрещены переходы между одноимёнными
подуровнями типа 2s → 1s,
3p → 2p,
4d → 3d
и так далее. Поэтому на рисунке все линии
переходов косые (прямые линии объединяют
одноимённые подуровни).
запрещены переходы между одноимёнными
подуровнями типа 2s → 1s,
3p → 2p,
4d → 3d
и так далее. Поэтому на рисунке все линии
переходов косые (прямые линии объединяют
одноимённые подуровни).
Слева на рисунке показана энергия
возбуждения атома в электронвольтах,
отсчитываемая от основного 1s-состояния.
Длина волны на рисунке указана в
ангстрёмах,
![]() нм.
нм.
