
- •Физика атома, твёрдого тела и атомного ядра Литература
- •Глава 1. Физика атома §1. Проблема строения атома. Опыты Резерфорда
- •§2. Атом Бора
- •§3. Корпускулярно-волновая природа света и частиц
- •§4. Уравнение Шрёдингера
- •§ 5. Квантовая модель атома водорода
- •§ 6. Периодическая система элементов Менделеева.
- •§7. Спектры многоэлектронных атомов
- •§8. Эффект Зеемана и Штарка
- •§9. Взаимодействие быстрых электронов с веществом
- •§10. Люминесценция
- •§11. Индуцированное излучение. Лазеры.
- •Глава 2. Физика твердого тела.
- •§ 12. Энергетические зоны.
- •Но опыт показывает, что cv металлов, как и диэлектриков, ближе к 3r. В этом суть парадокса теплоемкости.
- •§13. Электрическое сопротивление металлов. Сверхпроводимость.
- •3. Эффекты сверхпроводимости.
- •Глава 3. Физика атомного ядра §17. Естественная радиоактивность
- •8. Физические величины характеризующие радиоактивность, и единицы их измерения
- •§18. Проблема строения атомного ядра
§18. Проблема строения атомного ядра
1. Открытие протона. В
1919 г. Эрнст Резерфорд впервые осуществил
искусственное превращение ядер азота.
Схема установки показана на рис. 132.
Альфа-активный препарат полоний
![]() наносился на держатель Д внутри
кюветы К. Сцинтилляции α-частиц
могли наблюдаться на стеклянной пластинке
Пл с порошком ZnS
через микроскоп М.
наносился на держатель Д внутри
кюветы К. Сцинтилляции α-частиц
могли наблюдаться на стеклянной пластинке
Пл с порошком ZnS
через микроскоп М.
Альфа-частицы имеют энергию 7,58 МэВ и длину пробега в воздухе при нормальном давлении около 7 см. Держатель Д был установлен на таком расстоянии от пластинки Пл, что при пониженном давлении газа в кювете α-чатисцы могли доходить до пластинки Пл и вызывать на ней сцинтилляции. При нормальном и повышенном давлении α-частицы до пластинки Пл не доходили.
Кювета заполнялась разными газами, после чего наблюдались сцинтилляции α-частиц при малых давлениях и их исчезновение с ростом давления.
При заполнении кюветы азотом N2 на пластинке Пл наблюдались сцинтилляции и при давлениях, больших предельного. Поскольку α-частицы не могли дойти до люминофора, оставалось сделать предположение, что в процессе взаимодействия α-частиц с ядрами азота рождались какие-то другие ионизирующие частицы.
Наложение электрического и магнитного полей позволили установить, что рождающаяся новая частица имеет положительный заряд, равный по абсолютной величине заряду электрона, и массу, приблизительно равную массе водорода. Очевидно, это ядро атома водорода, как α-частица – ядро атома гелия.
Ещё в 1910-х годах была высказана идея, что ядра всех химических элементов состоят из ядер водорода – то есть ядер простейшего, первого в таблице элемента. Поэтому Резерфорд назвал новую частицу «протон», образовав это слово от греч. protos – первый. (Ещё раньше, в 1815 г., подобную идею в отношении состава химических элементов высказал химик Уильям Праут).
Патрик Блэкетт продолжил в 1925 г. опыты с азотом с помощью усовершенствованной им камеры Вильсона (см. с. ). Он автоматизировал съёмку туманных треков ионизирующих частиц двумя фотокамерами одновременно с разных направлений. Это позволило восстановить пространственную форму траекторий частиц. Сделав 23 000 снимков и посмотрев их, он установил, что α-частица при столкновении поглощается ядром азота, после чего это новое ядро выбрасывает протон. С учётом сохранения заряда и массы ядерная реакция может быть записана так:
![]() Резерфорд, 1919 г. Открытие протона
(18.1)
Резерфорд, 1919 г. Открытие протона
(18.1)
Энергия протонов в опытах Резерфорда составляла около 6 МэВ, а длина пробега 28 см.
2. Свойства протона. Протон
в свободном состоянии – стабильная
элементарная частица, ядро атома
водорода. В ядерных реакциях обозначается
часто символом
![]() .
Масса протона mp
почти в 2000 раз превышает массу
электрона me,
mp = 1836
me = 1,67239 · 10–27 кг.
.
Масса протона mp
почти в 2000 раз превышает массу
электрона me,
mp = 1836
me = 1,67239 · 10–27 кг.
Спин, то есть собственный момент
импульса протона такой же, как у
электрона. Его проекция на физическую
ось может принимать только два значения,
![]() .
Спиновое квантовое число s
протона, как и у электрона, полуцелое,
.
Спиновое квантовое число s
протона, как и у электрона, полуцелое,
![]() .
Поэтому система протонов, как и система
электронов, описывается статистикой
Ферми-Дирака.
.
Поэтому система протонов, как и система
электронов, описывается статистикой
Ферми-Дирака.
Магнитный спиновый момент протона.
Как уже говорилось в §2, в теории атома
водорода Бора орбитальный магнитный
момент электрона в низшем энергетическом
состоянии (n = 1)
равен
![]() Дж/Тл
(см. ф. 2.18). На более высоком
энергетическом уровне магнитный момент
в n раз больше, где n
– номер уровня, Mn = n · M1.
Минимальную величину магнитного момента
Дж/Тл
(см. ф. 2.18). На более высоком
энергетическом уровне магнитный момент
в n раз больше, где n
– номер уровня, Mn = n · M1.
Минимальную величину магнитного момента
![]() называют магнетоном Бора. Это
минимальный магнитный момент в физике
электронных оболочек атомов. Поэтому
магнетон Бора используется в качестве
системы измерений магнитных моментов
электронов.
называют магнетоном Бора. Это
минимальный магнитный момент в физике
электронных оболочек атомов. Поэтому
магнетон Бора используется в качестве
системы измерений магнитных моментов
электронов.
Из опытов Штерна и Герлаха по расщеплению атомных пучков в неоднородном магнитном поле следовало, что спиновый магнитный момент электрона равен магнетону Бора. Поэтому после открытия протона было естественным предположение, что спиновый магнитный момент протона определяется формулой магнетона Бора, в которой вместо массы электрона me должна стоять масса протона mp.
![]() Дж/Тл.
(18.2)
Дж/Тл.
(18.2)
Величину Мя называют ядерным магнетоном. Он в 1836 раз меньше магнетона Бора и используется в качестве единицы измерения магнитных моментов в ядерной физике.
Но измерения показали, что спиновый магнитный момент протона больше магнетона Бора в 2,79 раз и составляет
![]() Дж/Тл.
(18.3)
Дж/Тл.
(18.3)
3. Ядерные реакции с испусканием
протона наблюдались позднее при
обстреле α-частицами бора
![]() ,
фтора
,
фтора
![]() ,
натрия
,
натрия
![]() ,
алюминия
,
алюминия
![]() и фосфора
и фосфора
![]() .
.
Заметим, что α-частицы могут результативно взаимодействовать лишь с лёгкими ядрами. Чтобы преодолеть электрическое отталкивание ядра, α-частица должна иметь кинетическую энергию Е, не меньшую потенциальной энергии необходимого для протекания реакции сближения с ядром.
![]() (18.4)
(18.4)
Отсюда можно найти максимальный номер Z элемента, ядро которого доступно для α-частицы с энергией Е.
![]() .
(18.5)
.
(18.5)
Радиус ядра
![]() м.
Для α-частиц с энергией Е ≈ 10 МэВ
получаем
м.
Для α-частиц с энергией Е ≈ 10 МэВ
получаем
![]()
Это завышенное число. Как показывают опыты, эффективное взаимодействие α-частиц с ядрами реально лишь для элементов с Z ≤ 20, то есть до кальция.
4. Открытие нейтрона. К 1930 г. выяснилось, что некоторые элементы, например, Be, Li, O2 при обстреле α-частицами протонов не испускают. Поэтому возник вопрос: что же происходит в тех случаях, когда обстреливаемое α-частицами ядро не выбрасывает протон?
В 1930 г. Вальтер Ботс и Г. Бекер
поставили опыт, схема которого показана
на рис. 133. На держателе Д помещался
α-активный препарат
![]() .
Его особенность в том, что испытав
α-распад полония –210 превращается
в ядро стабильного изотопа свинца
.
Его особенность в том, что испытав
α-распад полония –210 превращается
в ядро стабильного изотопа свинца
![]() .
Поэтому никаких других излучений
препарат полония –210 не даёт. Энергия
α-частиц у
меньше, чем у
,
она составляет 5,25 МэВ. Но для
проникновения в ядра выбранного для
опытов лёгкого бериллия, у которого
Z = 4,
этого было достаточно.
.
Поэтому никаких других излучений
препарат полония –210 не даёт. Энергия
α-частиц у
меньше, чем у
,
она составляет 5,25 МэВ. Но для
проникновения в ядра выбранного для
опытов лёгкого бериллия, у которого
Z = 4,
этого было достаточно.
Было опасение, что ядра, не испускающие протоны, испускают другое излучение, не дающее вспышек в сернистом цинке ZnS. Поэтому экран из сернистого цинка был заменён счётчиком Гейгера. Его действие основано на том, что ядерная частица, влетающая внутрь счётчика, ионизирует находящийся в нём газ. В результате в цепи счётчика возникает импульс тока (подробнее см. с. ).
Опыт показал, что при облучении α-частицами
пластинок из бериллия
![]() ,
бора
,
лития
,
бора
,
лития
![]() возникает какое-то излучение, вызывающее
слабые разряды счётчика Гейгера. Особенно
сильное излучение давал бериллий. Эти
бериллиевые лучи обладали огромным
проникающим действием: пластина свинца
толщиной 2 см уменьшала их интенсивность
всего на 14%. Боте и Бекер предположили,
что бериллиевые лучи представляют собой
очень жёсткие γ-кванты. По поглощению
в свинце было найдено, что энергия
бериллиевых γ-квантов составляет
7 МэВ. Но энергия α-частиц составляла
5,25 МэВ. откуда же взялся прирост
энергии?
возникает какое-то излучение, вызывающее
слабые разряды счётчика Гейгера. Особенно
сильное излучение давал бериллий. Эти
бериллиевые лучи обладали огромным
проникающим действием: пластина свинца
толщиной 2 см уменьшала их интенсивность
всего на 14%. Боте и Бекер предположили,
что бериллиевые лучи представляют собой
очень жёсткие γ-кванты. По поглощению
в свинце было найдено, что энергия
бериллиевых γ-квантов составляет
7 МэВ. Но энергия α-частиц составляла
5,25 МэВ. откуда же взялся прирост
энергии?
В 1931 г. к исследованиям бериллиевых лучей присоединились Ирен и Фредерик Жолио-Кюри. Помещая вместо свинцовых пластин листы парафина, они обнаружили, что из парафина под действием бериллиевых лучей исходили протоны, максимальный пробег в воздухе которых составлял 26 см. Такому пробегу соответствовала энергия протона 4,5 МэВ.
Парафины – это насыщенные углеводороды
с общей формулой СnH2n+2.
В них большое число атомов водорода.
Появление протонов при облучении
парафина бериллиевыми лучами упруги
Кюри истолковали как результат
комптоновского рассеяния γ-квантов
на протонах – ядрах атомов водорода.
Протон отдачи уходит вперёд, когда
рассеянный γ-квант отражается назад,
θ = π. Отсюда
![]() где mp
– масса протона, λ0 – длина
волны бериллиевых γ-квантов.
где mp
– масса протона, λ0 – длина
волны бериллиевых γ-квантов.
Энергия Е выбитого протона должна быть равной убыли энергии γ-кванта,
![]() (18.6)
(18.6)
Допустим для оценки, что
![]()
Тогда
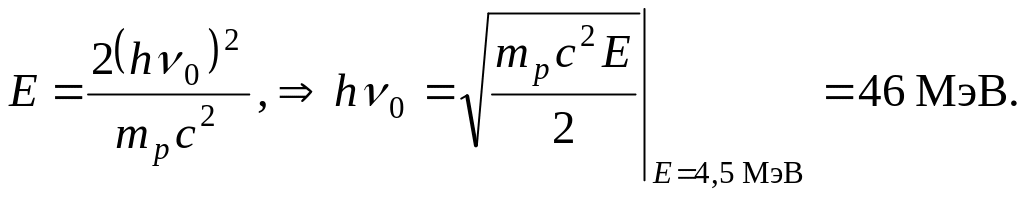
Итак, энергия бериллиевых γ-квантов, вычисленная по поглощению в свинце, 7 МэВ, по энергии выбитых из парафина протонов – 46-48 МэВ. Кроме того получается, что α-частицы с энергией 5,25 МэВ выбивает γ-квант с энергией 46-48 МэВ!
В 1932 г. в исследования природы бериллиевых лучей включается Джеймс Чедвик. Схема его установки практически ничем не отличалась от схемы Боте и Бекера, только вместо счётчика Гейгера он, как и Кюри, использовал ионизационную камеру.
Чедвик исследовал рассеяние бериллиевых лучей не только парафином, но и другими веществами. Энергия γ-квантов, измеренная по энергии ядер отдачи азота оказалась равной hν = 150 МэВ.
Итак, гипотеза, согласно которой бериллиевые лучи есть γ-кванты, приводила к противоречивым результатам. В зависимости от метода измерения энергия γ-квантов получалась разной и составляла 7, 48, 80, 150 МэВ. Это доказывало направленность данной гипотезы.
В том же 1932 г. Чедвик пришёл к выводу,
что бериллиевое излучение есть поток
нейтральных частиц, которые он назвал
нейтронами. Обозначают нейтроны
символом
![]() .
Ядерную реакцию рождения нейтронов
можно записать так:
.
Ядерную реакцию рождения нейтронов
можно записать так:
![]() Реакция открытия нейтронов, 1930-32 г.
(18.7)
Реакция открытия нейтронов, 1930-32 г.
(18.7)
Чедвик выполнил и первые измерения массы нейтрона. Оказалось, что масса нейтрона близка к массе протона. Точное значение массы нейтрона было получено из баланса масс различных ядерных реакций с участием нейтронов.
5. Свойства нейтрона. Нейтрон в свободном состоянии – нестабильная элементарная частица, распадающаяся на протон, электрон и электронное антинейтрино.
![]() (18.8)
(18.8)
Среднее время жизни нейтрона τ ≈ 16 минут.
Масса нейтрона несколько больше массы протона и составляет mn = 1838 me = 1,6760 · 10–27 кг. Спин нейтрона такой же, как у протона и составляет ħ/2. Поэтому нейтроны, как электроны и протоны, описываются статистикой Ферми-Дирака.
Хотя «минус» означает, что направления собственных механического и магнитного моментов нейтрона противоположны. Отношение спиновых магнитных моментов протона и нейтрона составляет Mp/Mn = –3/2.
Высокая проникающая способность нейтронов объясняется отсутствием у них электрического заряда. Нейтроны практически не взаимодействуют с электронными оболочками атомов и в отличие от α-частиц и протонов не отталкиваются от ядер. Поэтому даже при малых энергиях нейтроны могут вплотную подходить к атомным ядрам и захватываться ими.
Для регистрации быстрых нейтронов используют их упругие столкновения с ядрами водорода. Благодаря практическому равенству масс протона и нейтрона при упругом ударе нейтрона с неподвижным протоном последнему передаётся большая часть кинетической энергии нейтрона. В результате нейтрон практически останавливается, а протон движется в том же направлении с энергией, близкой к первоначальной энергии нейтрона. По пути протон производит интенсивную ионизацию и потому может регистрироваться ионизационной камерой, счётчиком Гейгера или камерой Вильсона.
После нескольких последовательных столкновений с атомными ядрами быстрые нейтроны отдают свою избыточную энергию и в дальнейшем совершают хаотическое движение с тепловыми скоростями. Для таких тепловых нейтронов описанный выше метод регистрации путём рассеяния на ядрах атомов водорода непригоден. В этом случае используют ядерные реакции, при которых нейтрон, проникая в яро, приводит к вылету из последнего α-частицы большой энергии. Например,
![]() (18.10)
(18.10)
6. Проблема строения ядра. К началу 30-х годов 20 в. были открыты следующие структурные элементы атома: электрон, 1897 г., Томсон; протон, 1919 г., Резерфорд; нейтрон, 1932 г., Чедвик. открытие радиоактивности и наблюдение первых ядерных реакций сделали актуальным вопрос: как устроено атомное ядро?
Прежде всего стало очевидно, что ядро атома нельзя представлять в виде шара, сложенного из неких неподвижных ядерных кирпичей. Ядро атома – это очень малый объём пространства, в котором движутся ядерные элементы. то есть это система ядерных объектов, движущихся и взаимодействующих по каким-то специфическим, пока ещё неизвестным законам.
В первую очередь надо было ответить на вопрос: из каких частиц состоит ядро. Исторически были рассмотрены два варианта: протон-электронное и протон-нейтронное ядро.
а. Протон-электронное ядро.
Ещё до открытия нейтрона в 1930 г.
Поль Дирак проанализировал идею Праута
о том, что все химические элементы
состоят из водорода. Применительно к
проблеме строения ядра эта идея сводилась
к тому, что все ядра элементов состоят
из ядер атома водорода, то есть из
протонов. (Изотоп водорода дейтерий
![]() был открыт только через 2 года). Но это
значит, что порядковый номер элемента
в таблице Менделеева должен быть равен
его массовому числу. Но таких элементов
в таблице нет. Уже у гелия порядковый
номер Z = 2,
а массовое число А = 4. Как будто
из 4-х протонов в ядре 2 нейтрализованы.
был открыт только через 2 года). Но это
значит, что порядковый номер элемента
в таблице Менделеева должен быть равен
его массовому числу. Но таких элементов
в таблице нет. Уже у гелия порядковый
номер Z = 2,
а массовое число А = 4. Как будто
из 4-х протонов в ядре 2 нейтрализованы.
Можно предположить, что ядро гелия
содержит 4 протона и 2 электрона. Но в
этом случае появляются противоречия с
принципом неопределённости Гейзенберга.
Действительно, неопределённость импульса
в ядре, выраженная из соотношения
неопределённости для координаты-импульса
![]() есть:
есть:
![]() (18.11)
(18.11)
Но неопределённость координаты Δх
не может быть больше радиуса ядра, по
крайней мере Δх ≈ r0.
Из опытов Резерфорда 1909 г. r0 ≈ 10–15 м.
импульс электрона в ядре не может быть
меньше неопределённости импульса,
![]() а его минимальная скорость движения в
ядре из релятивисткой формулы.
а его минимальная скорость движения в
ядре из релятивисткой формулы.
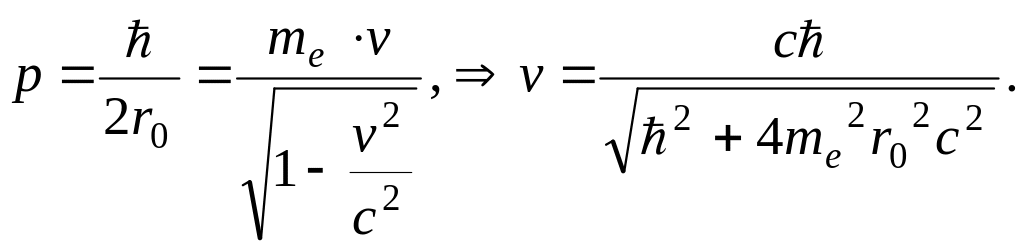 (18.12)
(18.12)
Здесь me – масса покоя электрона. После вычислений получаем v = 0,99998c, где с – скорость света.
Вычисленная по релятивистской формуле кинетическая энергия электрона в ядре составляет
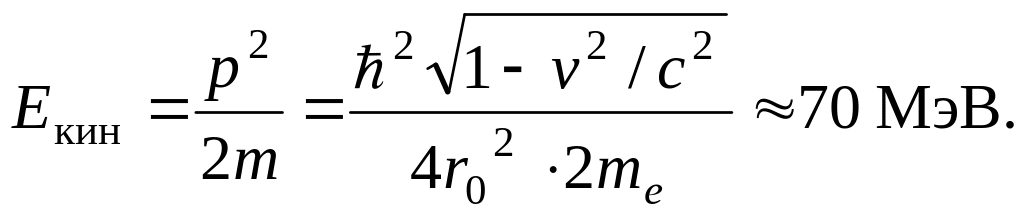
Но электроны, вылетающие из ядра при β-распаде, имеют энергию в пределах 10 МэВ. Столь разительному несоответствию очень трудно найти убедительное объяснение.
Вторая трудность протон-электронной модели ядра носит название азотной катастрофы. Суть её в следующем.
По величине сверхтонкого расщепления атомных спектров удалось вычислить магнитный момент атомных ядер. Он оказался примерно в 1000 раз меньше спинового магнитного момента электрона. Если в ядре чётное число электронов, то столь малый, магнитный момент ядра можно объяснить тем, что электроны в ядре образуют пары с противоположными спинами, поэтому магнитный момент ядра складывается из моментов протонов. А магнитный момент протона в 658 раз меньше момента электрона.
Но в ядре атома азота
![]() должно быть 14 протонов и 7 электронов.
Если 6 электронов образуют пары с
противоположными спинами, то один
электрон остаётся неспаренным. Этот
неспаренный электрон должен обеспечить
ядру азота такой же магнитный момент,
какой он имеет, то есть в 1000 раз больше,
чем у ядер с чётным числом электронов.
Но этого нет. Магнитный момент ядра
азота того же порядка, что и у других
ядер.
должно быть 14 протонов и 7 электронов.
Если 6 электронов образуют пары с
противоположными спинами, то один
электрон остаётся неспаренным. Этот
неспаренный электрон должен обеспечить
ядру азота такой же магнитный момент,
какой он имеет, то есть в 1000 раз больше,
чем у ядер с чётным числом электронов.
Но этого нет. Магнитный момент ядра
азота того же порядка, что и у других
ядер.
б. Протон-нейтронное ядро. Менее чем через полгода после открытия нейтрона практически одновременно и независимо друг от друга Дмитрий Иваненко и Вернер Гейзенберг предложили протон-нейтронный состав ядра. Разработанная позднее протон-нейтронная модель ядра прекрасно соответствует эксперименту и является сейчас общепринятой.
Согласно этой модели ядро атома содержит Z протонов A–Z нейтронов. Здесь Z – порядковый номер элемента в таблице Менделеева. Заряд ядра q = Ze+, поэтому номер Z называют часто зарядовым числом. Величину А называют массовым числом. Это целое число, равное атомной массе элемента, выраженной в углеродных единицах и округлённой до целого числа.
Протоны и нейтроны, находящиеся в составе ядра, называют нуклонами (от лат. nucleus – ядро). Тем самым подчёркивается, что протон и нейтрон в составе ядра – это одна и та же частица в разных состояниях. Массовое число А есть число нуклонов в ядре. В зависимости от соотношения между количествами протонов и нейтронов в ядрах различают изотопы, изобары и изотоны.
Изотопы (от греч. isos – равный, topos –место) – ядра, содержащие одинаковое количество протонов, то есть имеющие одинаковое количество протонов, то есть имеющие одинаковый номер Z, и разное число нейтронов. Все изотопы помещаются в одной клетке таблицы Менделеева и являются разновидностями одного химического элемента. Различаются изотопы числом N нейтронов в ядре. Например, изотопы водорода:
Протий,
![]() ,
ядро-протон, Z = 1,
A = 1,
N = A–Z = a,
нейтронов нет.
,
ядро-протон, Z = 1,
A = 1,
N = A–Z = a,
нейтронов нет.
Дейтерий,
![]() ,
ядро-дейтрон, Z = 1,
A = 2,
N = 1,
один нейтрон.
,
ядро-дейтрон, Z = 1,
A = 2,
N = 1,
один нейтрон.
Тритий,
![]() ,
ядро-тритон, Z = 1,
A = 3,
N = 2,
два нейтрона.
,
ядро-тритон, Z = 1,
A = 3,
N = 2,
два нейтрона.
Изотопы гелия:
![]() ,
Z = 2
(два протона), A = 3,
N = 1
(один нейтрон), стабилен.
,
Z = 2
(два протона), A = 3,
N = 1
(один нейтрон), стабилен.
![]() ,
Z = 2,
A = 4,
N = 2
(два нейтрона), стабилен.
,
Z = 2,
A = 4,
N = 2
(два нейтрона), стабилен.
![]() ,
Z = 2,
A = 6,
N = 4
(четыре нейтрона), нестабилен.
,
Z = 2,
A = 6,
N = 4
(четыре нейтрона), нестабилен.
![]() ,
Z = 2,
A = 8,
N = 6
(шесть нейтронов), нестабилен.
,
Z = 2,
A = 8,
N = 6
(шесть нейтронов), нестабилен.
У известных ныне элементов число Z достигает примерно значения 105. На это число элементов приходится примерно 1500 известных изотопов. В среднем на один элемент – 14 изотопов. Из них 1/5 – стабильных и 4/5 – нестабильных.
Изотопы одного химического имеют одинаковые химические и почти одинаковые физические свойства. Поэтому разделение изотопов – сложная физико-химическая задача. Наиболее заметно различаются изотопы водорода.
Изобары (от изос- и греч. baros – тяжесть) – ядра с одинаковым массовым числом А. Например, тритий и гелий . У них по 3 нуклона, но соотношение между протонами и нейтронами разное. У трития Z = 1, N = 2, у гелия Z = 2, N = 1.
Изотоны – ядра с одинаковым
числом нейтронов. Как и изобары, изотоны
– это ядра разных химических элементов.
Например, ядра разных
![]() содержат по 3 нейтрона.
содержат по 3 нейтрона.
Слова изобары и изотоны используются много реже, чем слово изотопы.
