
- •Вопрос1. Основные понятия кинематики.
- •Вопрос2. Скорость и ускорение.
- •Вопрос3. Кинематика вращ. Движения.
- •Вопрос4. 3 закона Ньютона.
- •Вопрос5. Центр масс и его движение. Закон сохранения импульса.
- •Вопрос6. Реактивное движение.
- •Вопрос7. Работа и мощность.
- •Вопрос8. Кинетическая энергия.
- •Вопрос9. Потенциальная энергия.
- •Вопрос10. Закон сохранения механической энергии.
- •Вопрос11. Упругий и неупругий удар шаров.
- •Вопрос12. Уравнение динамики вращательного движения.
- •Вопрос13. Теорема Штейнера.
- •Вопрос14. Работа при вращательном движении.
- •Вопрос15. Кинетическая энергия вращающегося тела.
- •Вопрос16. Закон сохранения момента импульса.
- •Вопрос17. Использование законов сохранения для решения задач.
- •Вопрос18. Гармонические колебательные движения.
- •Вопрос19. Динамика гармонических колебаний.
- •Вопрос20. Физический и математический маятники.
- •Вопрос21. Энергия колебательного движения.
- •Вопрос22. Сложение колебаний одинакового направления.
- •Вопрос23. Сложение взаимно перпендикулярных колебаний.
- •Вопрос24. Затухающие колебания.
- •Вопрос25. Вынужденные колебания. Резонанс.
- •Вопрос26. Распространение упругих волн.
- •Вопрос27. Уравнение плоской сферической волны.
- •Вопрос28. Уравнение плоской волны распространяющейся в произвольном направлении. Волновое уравнение.
- •Вопрос29. Скорость распространения упругих волн.
- •Вопрос30. Энергия упругой волны. Вектор Умова.
- •Вопрос31. Интерференция волн. Стоячие волны.
- •Вопрос32. Звук,ультразвук.
- •Вопрос33. Предмет молекулярной физики. Тепловое движение.
- •Вопрос34.Термодинамические параметры. Уравнение состояния.
- •Вопрос35.Изопроцессы в газах.
- •Вопрос36. Основное уравнение мкт.
- •Вопрос37. Распределение молекул по скоростям Максвелла
- •Вопрос38. Опыт Штерна.
- •Вопрос39. Барометрическая формула распределения Больцмана.
- •Вопрос40. Средняя длина свободного пробега молекул. Эффективный деаметр!
- •Вопрос41. Диффузия.
- •Вопрос42. Теплопроводность.
- •Вопрос43. Вязкость.
- •Вопрос44. Основные понятия и определения термодинамики.
- •Вопрос45. Внутренняя энергия системы тел.
- •Вопрос46.Теплота и работа.
- •Вопрос47. Первое начало термодинамики.
- •Вопрос48. Теплоемкости газов.
- •Вопрос49. Закон Дюлонга и Пти
- •Вопрос50. Уравнение Адиабаты. Политропические процессы.
- •Вопрос51. Работа в изопроцессах.
- •Вопрос52. Кпд тепловых двигателей (второе начало термодинамики)
- •Вопрос53. Цикл Карно.
Вопрос48. Теплоемкости газов.
Массовая, объёмная и мольная удельные теплоёмкости
Известно, что подвод теплоты к рабочему телу или отвод теплоты от него в каком-либо процессе приводит к изменению его температуры. Отношение количества теплоты, подведенной (или отведенной) в данном процессе, к изменению температуры называется теплоемкостью тела (системы тел):
(2.1)

 ,
,
где ![]() —
элементарное количество теплоты;
—
элементарное количество теплоты; ![]() —
элементарное изменение температуры.
—
элементарное изменение температуры.
Теплоемкость численно равна количеству теплоты, которое необходимо подвести к системе, чтобы при заданных условиях повысить ее температуру на 1 градус. Так как единицей количества теплоты в СИ является джоуль, а температуры — градус К, то единицей теплоемкости будет Дж/К.
Массовая теплоемкость — это теплоемкость, отнесенная к единице массы рабочего тела, Мольная теплоемкость — теплоемкость, отнесенная к количеству рабочего тела (газа) в молях,
Вопрос49. Закон Дюлонга и Пти
Закон Дюлонга-Пти (Закон постоянства теплоёмкости) — эмпирический закон, согласно которому молярная теплоёмкость твёрдых тел при комнатной температуре близка к 3R:
![]()
где R — универсальная газовая постоянная.
Закон выводится в предположении, что кристаллическая решетка тела состоит из атомов, каждый из которых совершает гармонические колебания в трех направлениях, определяемыми структурой решетки, причем колебания по различным направлениям абсолютно независимы друг от друга. При этом получается, что каждый атом представляет три осциллятора с энергией E, определяемой следующей формулой:
![]() .
.
Формула
вытекает из теоремы о равнораспределении энергии по
степеням свободы. Так как каждый
осциллятор имеет одну степень
свободы,
то его средняя кинетическая
энергия равна ![]() ,
а так как колебания происходят
гармонически, то средняя потенциальная
энергия равна
средней кинетической, а полная энергия
- соответственно их сумме. Число
осцилляторов в одном моле вещества
составляет
,
а так как колебания происходят
гармонически, то средняя потенциальная
энергия равна
средней кинетической, а полная энергия
- соответственно их сумме. Число
осцилляторов в одном моле вещества
составляет ![]() ,
их суммарная энергия численно равна
теплоемкости тела - отсюда и вытекает
закон Дюлонга-Пти.
,
их суммарная энергия численно равна
теплоемкости тела - отсюда и вытекает
закон Дюлонга-Пти.
Вопрос50. Уравнение Адиабаты. Политропические процессы.
Адиабата Пуассона
Для идеальных газов, чью теплоёмкость можно считать постоянной, в случае квазистатического процесса адиабата имеет простейший вид и определяется уравнением[6][15][16]
![]()
где ![]() —
его объём,
—
его объём, ![]() — показатель
адиабаты,
— показатель
адиабаты, ![]() и
и ![]() — теплоёмкости газа
соответственно при постоянном давлении
и постоянном объёме.
— теплоёмкости газа
соответственно при постоянном давлении
и постоянном объёме.
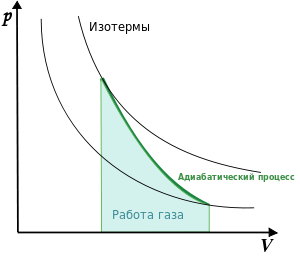
![]()
График
адиабаты (жирная линия) на ![]() диаграмме
для газа.
диаграмме
для газа.
![]() —
давление газа;
—
давление газа;
![]() —
объём.
—
объём.
С учётом уравнения состояния идеального газа уравнение адиабаты может быть преобразовано к виду
![]()
где ![]() — абсолютная
температура газа.
Или к виду
— абсолютная
температура газа.
Или к виду
![]()
Поскольку ![]() всегда
больше 1, из последнего уравнения следует,
что при адиабатическом сжатии (то есть
при уменьшении
)
газ нагревается (
возрастает),
а при расширении — охлаждается, что
всегда верно и для реальных газов.
Нагревание при сжатии больше для того
газа, у которого больше коэффициент
.
всегда
больше 1, из последнего уравнения следует,
что при адиабатическом сжатии (то есть
при уменьшении
)
газ нагревается (
возрастает),
а при расширении — охлаждается, что
всегда верно и для реальных газов.
Нагревание при сжатии больше для того
газа, у которого больше коэффициент
.
Политропический процесс — термодинамический процесс, во время которого удельная теплоёмкость газа остаётся неизменной.
В
соответствии с сущностью понятия
теплоёмкости ![]() ,
предельными частными явлениями
политропного процесса являются изотермический
процесс (
,
предельными частными явлениями
политропного процесса являются изотермический
процесс (![]() )
и адиабатный
процесс (
)
и адиабатный
процесс (![]() ).
).
В случае идеального газа, изобарный процесс и изохорный процесс также являются политропными
