
- •1ЭлТех Материалы
- •1,1Виды хим связи (структура атома водорода)
- •2Приближенная модель Атома водорода
- •3Атомы,Ионы,Малекулы
- •5 Типы химсвязи
- •6.Гетерополярная (ионная связь)
- •10Полиморфизм, аморфные тела
- •12Характеристика энергетического спектра
- •1.Диэлектрики (д)
- •2Д. В переменном поле
- •3Нагревостойкость д.Классы нагревостойкости
- •5Полиризация д. В отсутствии Эл.Поля
- •6Д. Прочность ,температура
- •1,1Характеристика пп в квантовой теории
- •2Электропроводность чистых металлов и примесных
- •3Материалы для пп
- •4 Материалы для сильноточный пп
- •6 Энергия их ионизации положи уровня Ферми
- •7Основные неосновные носители зарядов
- •1Магнитные материалы
- •2Классификация,магнитные св-ва,
- •3Природа феромагнетического материала
- •4Доменная структура ферромагнетика
1ЭлТех Материалы
1,1Виды хим связи (структура атома водорода)
Химическая связь — это взаимодействие частиц (атомов, ионов), осуществляемое путем обмена электронами. ковалентная (полярная и неполярная), ионная
Ковалентная связь образуется в результате обобществления электронов (с образованием общих электронных пар), которое происходит в ходе перекрывания электронных облаков. В образовании ковалентной связи участвуют электронные облака двух атомов. Различают две основные разновидности ковалентной связи: а) неполярную и б) полярную. а) Ковалентная неполярная связь образуется между атомами неметалла одного и того лее химического элемента. Такую связь имеют простые вещества, например О2; N2;
б) Ковалентная полярная связь образуется между атомами различных неметаллов.
Ионной называется связь между ионами, т. е. заряженными частицами, образовавшимися из атома или группы атомов в результате присоединения или отдачи электронов Ионная связь характерна для солей и щелочей.
 структура
атома водорода
структура
атома водорода
![]()
2Приближенная модель Атома водорода
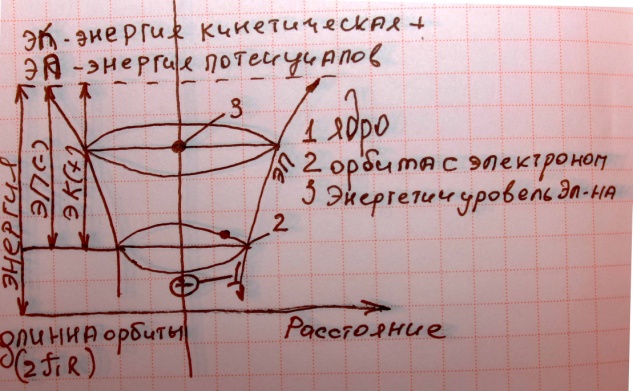
Атом водорода состоит из 1протона электрон вращается вокруг атома ядра,распологается на длинне 2Pr.на длинне которой укладывается целое число Де Броль
3Атомы,Ионы,Малекулы
Атом — наименьшая химически неделимая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и электронов. Ядро атома состоит из положительно заряженных протонов и незаряженных нейтронов. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. Атомы классифицируются по количеству протонов и нейтронов в ядре: количество протонов определяет принадлежность атома некоторому химическому элементу, а число нейтронов — изотопу этого элемента.1А=10−10м
Ион — одноатомная или многоатомная электрически заряженная частица, образующаяся в результате потери или присоединения атомом или молекулойодного или нескольких электронов. Ионизация (процесс образования ионов) может происходить при высоких температурах, под воздействием электрического поля, ионизирующего излучения
Молекула — электрически нейтральная частица, состоящая из двух или более связанных ковалентными связями атомов, наименьшая частица химического вещества, обладающая всеми его химическими свойствамиОбычно подразумевается, что молекулы нейтральны (не несут электрических зарядов) и не несут неспаренных электронов (все валентности насыщены); заряженные молекулы называют ионами, молекулы с мультиплетностью, отличной от единицы (то есть с неспаренными электронами и ненасыщенными валентностями) —радикалами.
5 Типы химсвязи
ковалентная, ионная, водородная, металлическая Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому
Ионная
связь –
частный случай ковалентной, когда
образовавшаяся электронная пара
полностью принадлежит более
электроотрицательному атому, становящемуся
анионом. Основой для выделения этой
связи в отдельный тип служит то
обстоятельство, что соединения с такой
связью можно описывать в электростатическом
приближении, считая ионную связь
обусловленной притяжением положительных
и отрицательных ионов. Взаимодействие
ионов противоположного знака не зависит
от направления, а кулоновские силы не
обладают свойством насыщености. Поэтому
каждый ион в ионном соединении притягивает
такое число ионов противоположного
знака, чтобы образовалась кристаллическая
решетка ионного типа. В ионном кристалле
нет молекул. Каждый ион окружен
определенным числом ионов другого
знака (координационное число иона).
Ионные пары могут существовать в
газообразном состоянии в виде полярных
молекул. В газообразном состоянии NaCl
имеет дипольный момент ~3∙10–29 Кл∙м,что
соответствует смещению 0,8 заряда
электрона на длину связи 0,236 нм от Na к
Cl, т. е. Na0,8+Cl0,8–
Металлическая
связь возникает
в результате частичной делокализации
валентных электронов, которые достаточно
свободно движутся в решетке металлов,
электростатически взаимодействуя с
положительно заряженными ионами. Силы
связи не локализованы и не направлены,
а делокализированные электроны
обусловливают высокую тепло- и
электропроводность
Водородная
связь.
Ее образование обусловленно тем, что
в результате сильного смещения
электронной пары к электроотрицательному
атому атом водорода, обладающий
эффективным положительным зарядом,
может взаимодействовать с другим
электроотрицательным атомом (F, O, N, реже
Cl, Br, S). Энергия такого электростатического
взаимодействия составляет 20–100
кДж∙моль–1.
Водородные связи могут
быть внутри- и межмолекулярными.
Внутримолекулярная водородная связь
образуется, например, в ацетилацетоне
и сопровождается замыканием цикла
ДИПОЛЬНЫЙ
МОМЕНТ -
физическая величина, характеризующая
свойства диполя. Электрический дипольный
момент равен произведению положительного
заряда электрического диполя на
расстояние между зарядами и направлен
от отрицательного заряда к положительному.
Магнитный дипольный момент контура с
током пропорционален произведению
силы тока на площадь контура и направлен
перпендикулярно плоскости контура
так, что с его конца ток виден текущим
против часовой стрелки. Дипольный
момент определяет электрическое
(магнитное) поле диполя на большом
расстоянии от него, а также воздействие
на диполь внешнего электрического
(магнитного) поля.
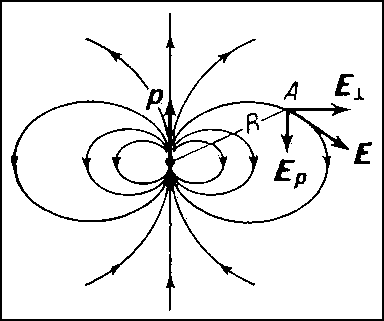 Электрическое
поле диполя, изображенное с помощью
силовых линий. В точке наблюдения А,
находящейся на расстоянии R от центра
диполя (R>>l),
поле Е (направленное по касательной к
силовой линии) разложено на 2 компоненты:
Ep —
параллельную оси диполя и E
Электрическое
поле диполя, изображенное с помощью
силовых линий. В точке наблюдения А,
находящейся на расстоянии R от центра
диполя (R>>l),
поле Е (направленное по касательной к
силовой линии) разложено на 2 компоненты:
Ep —
параллельную оси диполя и E![]()
