
- •14.Предмет изучения молекулярной физики.
- •3 Основных положения молекулярно - кинетической теории:
- •15. Уравнение состояния идеального газа
- •16. Основное уравнение мкт
- •17.Среднекинетическая энергия молекул идеального газа
- •Внутренняя энергия термодинамической системы
- •18. Теплоемкость идеального газа.
- •19. Явления переноса.
- •20. Работа в термодинамике.
- •21. Содержание первого начала термодинамики.
- •22.Адиабатический процесс.
- •23. Второе начало термодинамики.
20. Работа в термодинамике.
Механическая работа определяется как:
![]() ,
,
где ![]() — сила,
а
— сила,
а ![]() —
элементарное (бесконечно малое)
перемещение.
—
элементарное (бесконечно малое)
перемещение.
Элементарная работа термодинамической системы над внешней средой может быть вычислена так:
![]() ,
,
где ![]() —
нормаль элементарной (бесконечно малой)
площадки,
—
нормаль элементарной (бесконечно малой)
площадки, ![]() — давление и
— давление и ![]() —
бесконечно малое приращение объёма.
—
бесконечно малое приращение объёма.
Работа
в термодинамическом процессе ![]() ,
таким образом, выражается так:
,
таким образом, выражается так:
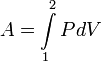 .
.
Величина
работы зависит от пути, по которому
термодинамическая система переходит
из состояния ![]() в
состояние
в
состояние ![]() ,
и не является функцией
состояния системы.
Такие величины называют функциями
процесса.
,
и не является функцией
состояния системы.
Такие величины называют функциями
процесса.
Несмотря на то, что до сих пор и в физической химии используется обозначение работы A, в соответствии с рекомендациями ИЮПАК работу в химической термодинамике следует обозначать как W[1
Изотермический процесс (от др.-греч. ἴσος «равный» и θέρμη «жар») — термодинамический процесс, происходящий в физической системе при постоянной температуре.
В идеальном
газе при
изотермическом процессе произведение
давления на объём постоянно (закон
Бойля-Мариотта).
Изотермы идеального газа в координатах ![]() —
гиперболы, расположенные на графике
тем выше, чем выше температура, при
которой происходит процесс
—
гиперболы, расположенные на графике
тем выше, чем выше температура, при
которой происходит процесс
Работа,
совершенная идеальным газом в
изотермическом процессе, равна ![]() ,
где
,
где ![]() —
число частиц газа,
—
температура,
—
число частиц газа,
—
температура, ![]() и
и ![]() —
объём газа в начале и конце
процесса,
— постоянная
Больцмана .
—
объём газа в начале и конце
процесса,
— постоянная
Больцмана .
В твёрдом теле и большинстве жидкостей изотермические процессы очень мало изменяют объём тела, если только не происходит фазовый переход.
Первый закон термодинамики для изотермического процесса записывается в виде:
![]()
![]()
Изохорический или изохорный процесс (от др.-греч. ἴσος «равный» и χώρος «место») — термодинамический процесс, который происходит при постоянном объёме. Для осуществления изохорного процесса в газе или жидкости достаточно нагревать (охлаждать) вещество в сосуде, который не изменяет своего объёма.
Из определения работы следует, что изменение работы при изохорном процессе равно:
![]()
Чтобы определить полную работу процесса проинтегрируем данное выражение. Поскольку объем неизменен, то:
![]() ,
,
Но такой интеграл равен нулю. Итак, при изохорном процессе газ работы не совершает:
![]() .
.
Графически доказать это намного проще. С математической точки зрения, работа процесса — это площадь под графиком. Но график изохорного процесса является перпендикуляром к оси абсцисс. Таким образом, площадь под ним равна нулю.
Изменение внутренней энергии идеального газа можно найти по формуле:
![]() ,
,
где i — число степеней свободы, которое зависит от количества атомов в молекуле (3 для одноатомной (например, неон), 5 для двухатомной (например, кислород) и 6 для трёхатомной и более (например, молекула водяного пара)).
Из определения и формулы теплоёмкости и, формулу для внутренней энергии можно переписать в виде:
![]() ,
,
где ![]() —
молярная теплоёмкость при постоянном
объёме.
—
молярная теплоёмкость при постоянном
объёме.
Используя первое начало термодинамики можно найти количество теплоты при изохорном процессе:
![]()
Но при изохорном процессе газ не выполняет работу. То есть, имеет место равенство:
![]() ,
,
то есть вся теплота, которую получает газ идёт на изменение его внутренней энергии.
Изобарный процесс (др.-греч. ἴσος «одинаковый» и βάρος «тяжесть») — термодинамический процесс, происходящий в системе при постоянном давлении и постоянной массе идеального газа.
Согласно закону
Гей-Люссака,
при изобарном процессе в идеальном
газе ![]() .
.
Работа,
совершаемая газом при расширении или
сжатии газа, равна ![]() .
.
Количество
теплоты, получаемое или отдаваемое
газом, характеризуется изменением энтальпии: ![]() .
.
Физический смысл универсальной газовой постоянной
ной Больцмана к:
R = NAk.
Постоянные Л\ и к имеют ясный смысл: Na — это число молекул или атомов в единице количества вещества, то есть моле; к — постоянная, определяющая связь между температурой в кельвинах и температурой в единицах энергии. Но определенный физический смысл (быть может, многим он покажется неожиданным) имеет и комбинация NA и k — постоянная R.
Представим себе, что I моль идеального газа находится в сосуде с подвижным поршнем и что подводом тепла к нему или отводом тепла от него его температуру изменяют на 1 кельвин. Благодаря тому, что сосуд закрыт подвижным поршнем, давление газа будет оставаться постоянным (нравным внешнему давлению).
Напишем уравнение состояния газа до и после нагревания: до нагревания pVx = RT% после нагревания pV2 = R (Т+АТ), где ДТ = 1 К. Вычтя первое равенство из второго, мы получим p(y2-Vx)=RT + RAT-RT = RtbT.
Левая часть этого равенства представляет собой работу, совершаемую силой давления газа (или внешней силой против силы давления), когда при постоянном давлении р объем газа увеличивается (или уменьшается) от V, до V7.' Следовательно, газовая постоянная R равна работе, которую совершает 1 моль идеального газа, расширяясь при нагревании на 1 К при постоянном давлении.
Разумеется, при изобарном охлаждении 1 моля газа на 1 К такую же работу совершает внешняя сила, действующая на поршень.
(1)
В уравнение состояния идеального газа (уравнение Менделеева — Клапейрона)
PV-2RT
входит универсальная газовая постоянная R. Она, как известно, равна произведению двух других постоянных — числа Авогадро NA
