
- •14.Предмет изучения молекулярной физики.
- •3 Основных положения молекулярно - кинетической теории:
- •15. Уравнение состояния идеального газа
- •16. Основное уравнение мкт
- •17.Среднекинетическая энергия молекул идеального газа
- •Внутренняя энергия термодинамической системы
- •18. Теплоемкость идеального газа.
- •19. Явления переноса.
- •20. Работа в термодинамике.
- •21. Содержание первого начала термодинамики.
- •22.Адиабатический процесс.
- •23. Второе начало термодинамики.
15. Уравнение состояния идеального газа
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Менделеева —Клапейрона) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
![]()
где
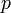 — давление,
— давление,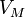 — молярный
объём,
— молярный
объём,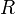 — универсальная
газовая постоянная
— универсальная
газовая постоянная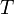 — абсолютная
температура,К.
— абсолютная
температура,К.
Так
как ![]() ,
где
,
где ![]() — количество
вещества,
а
— количество
вещества,
а ![]() ,
где
,
где ![]() —
масса,
—
масса, ![]() — молярная
масса,
уравнение состояния можно записать:
— молярная
масса,
уравнение состояния можно записать:
![]()
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
В случае постоянной массы газа уравнение можно записать в виде:
![]()
![]()
Универса́льная га́зовая постоя́нная — термин, впервые введённый в употребление Д. Менделеевым в 1874 г. Численно равна работе расширения одногомоля идеального газа в изобарном процессе при увеличении температуры на 1 К.
Входит
в уравнение
состояния идеального газа ![]() .
.
В
системе СИ универсальная
газовая постоянная равна ![]() Дж⁄(моль∙К).
Дж⁄(моль∙К).
В
системе СГС универсальная
газовая постоянная равна ![]() Эрг⁄(моль∙К).
Эрг⁄(моль∙К).
Удельная
газовая постоянная (R/M) для сухого
воздуха: ![]() Дж⁄(кг∙К)
Дж⁄(кг∙К)
Закон Бойля — Мариотта гласит:
При постоянной температуре и массе идеального газа произведение его давления и объёмапостоянно.
В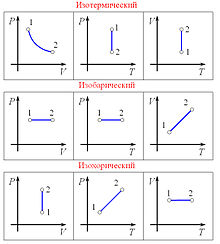 математической форме это утверждение
записывается следующим образом
математической форме это утверждение
записывается следующим образом
![]()
где
—
давление газа; ![]() —
объём газа.
—
объём газа.
Изобарический закон, открытый Гей-Люссаком в 1802 году утверждает, что при постоянном давлении объём постоянной массы газа пропорционален абсолютной температуре. Математически закон выражается следующим образом:
![]()
или
![]()
где — объём газа, — температура.
Если известно состояние газа при неизменном давлении и двух разных температурах, закон может быть записан в следующей форме:
![]()
или
![]() .
.
16. Основное уравнение мкт
Молекулярно-кинетическая теория (сокращённо МКТ) — теория XIX века, рассматривавшая строение вещества, в основном газов, с точки зрения трёх основных приближенно верных положений:
все тела состоят из частиц: атомов, молекул и ионов;
частицы находятся в непрерывном хаотическом движении (тепловом);
частицы взаимодействуют друг с другом путём абсолютно упругих столкновений.
Основными доказательствами этих положений считались:
Диффузия
Броуновское движение
Изменение агрегатных состояний вещества
В современной (теоретической) физике термин молекулярно-кинетическая теория уже не используется, хотя он встречается в учебниках по курсу общей физики. В современной физике МКТ заменила кинетическая теория, в русскоязычной литературе — физическая кинетика, и статистическая механика. В этих разделах физики изучаются не только молекулярные (атомные или ионные) системы, находящиеся не только в «тепловом» движении, и взаимодействующие не только через абсолютно упругие столкновения.
![]() ,
где k является постоянной
Больцмана (отношение универсальной
газовой постоянной R к числу
Авогадро NA), i —
число степеней свободы молекул (
,
где k является постоянной
Больцмана (отношение универсальной
газовой постоянной R к числу
Авогадро NA), i —
число степеней свободы молекул (![]() в
большинстве задач про идеальные газы,
где молекулы предполагаются сферами
малого радиуса, физическим аналогом
которых могут служить инертные газы),
а T -
абсолютная температура.
в
большинстве задач про идеальные газы,
где молекулы предполагаются сферами
малого радиуса, физическим аналогом
которых могут служить инертные газы),
а T -
абсолютная температура.
Основное уравнение МКТ связывает макроскопические параметры (давление, объём, температура) газовой системы с микроскопическими (масса молекул, средняя скорость их движения).
Уравнение среднеквадратичной скорости молекулы легко выводится из основного уравнения МКТ для одного моля газа.
![]() ,
,
![]() ,
где
,
где ![]() — молярная
масса газа
— молярная
масса газа
Отсюда окончательно
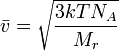
Постоя́нная
Бо́льцмана (![]() или
или ![]() ) — физическая
постоянная,
определяющая связь между температурой иэнергией.
Названа в честь австрийского физика Людвига
Больцмана,
сделавшего большой вклад встатистическую
физику,
в которой эта постоянная играет ключевую
роль. Её экспериментальное значение
в СИравно
) — физическая
постоянная,
определяющая связь между температурой иэнергией.
Названа в честь австрийского физика Людвига
Больцмана,
сделавшего большой вклад встатистическую
физику,
в которой эта постоянная играет ключевую
роль. Её экспериментальное значение
в СИравно
![]() Дж/К[1].
Дж/К[1].
