
- •30. Природа света.
- •31. Световой поток. Освещенность.
- •§ 70. Сила света и освещенность. Полный световой поток характеризует излучение, которое распространяется от
- •32. Законы освещенности.
- •33. Яркость источников и освещенных поверхностей.
- •34. Световые измерения и измерительные приборы.
- •35. Прямолинейное распространение света и световые лучи.
- •36. Законы отражения и преломления света. Понятие дисперсии.
- •37. Интерференция света. Дифракция света.
- •127. Определение длины световой волны с помощью колец Ньютона.
- •§ 130. Законы отражения и преломления света на основе принципа Гюйгенса. Пусть на границу раздела двух сред аb (рис. 273) падает параллельный пучок лучей, образуя
- •§ 136. Дифракционная решетка как спектральный прибор.
- •38. Поляризация света.
- •39. Цвет.
- •§ 164. Спектральный состав света различных источников.
- •40. Линзы. Преломление изображения в линзах.
- •41. Формула линзы. Действительное и мнимое изображение.
- •42. Плоские и сферические зеркала.
- •43. Построение изображения в зеркалах.
- •44. Увеличение при изображении объектов в сферических зеркалах и линзах.
- •45. Проекционные оптические приборы.
- •46. Фотоаппарат.
- •47. Глаз как оптическая система. Лупа.
- •48. Микроскоп.
- •49. Разрешающая способность и увеличение оптических приборов.
- •50. Погрешности оптических приборов.
- •§ 102. Увеличение системы. Найдем теперь формулы для линейного увеличения системы. Из подобия треугольников s'1s'2f' и h'q'f' (рис. 226) имеем
- •§ 107. Ограничение пучков в оптических системах. Изучая оптические системы, мы до сих пор оставляли в стороне
- •51. Различные виды микроскопов, используемые в судебной экспертизе.
- •52. Оптическая световая микроскопия и ее использование для исследования объектов судебной экспертизы
- •53. Люминесцентная микроскопия и ее использование для исследования объектов судебной экспертизы.
- •54. Электронная микроскопия, ее виды и использование ее для исследования объектов судебной экспертизы.
- •55. Понятие электромагнитных волн.
- •56. Источники электромагнитных волн.
- •57. Способы исследования электромагнитных волн различной длины.
- •58. Шкала электромагнитных волн.
- •59. Видимая и невидимая зоны шкалы электромагнитных волн. Свойства электромагнитного излучения в различных областях спектра
- •60. Ультрафиолетовая, инфракрасная микроскопия и использование ее для исследования объектов судебной экспертизы.
- •61. Дисперсия и цвет тел.
- •62. Понятие спектра. Типы спектров, используемых в судебной экспертизе.
- •§ 174. Происхождение спектров различных типов. Исследование показало, что тип спектра определяется характером светящегося объекта.
- •63. Дисперсия показателя преломления различных материалов. Коэффициенты поглощения, отражения и пропускания.
- •64. Спектральный состав света различных источников. Спектры и спектральные закономерности.
- •65. Спектральные аппараты.
- •66. Действия света на вещество. Фотоэлектрический эффект.
64. Спектральный состав света различных источников. Спектры и спектральные закономерности.
Спектральный состав света различных источников.
Опытами Ньютона было установлено, что солнечный свет имеет сложный характер. Подобным же образом, т. е. анализируя состав света при помощи призмы, можно убедиться, что свет большинства других источников (лампа накаливания, дуговой фонарь и т. д.) имеет такой же характер. Сравнивая спектры этих светящихся тел, обнаружим, что соответственные участки спектров обладают различной яркостью, т. е. в различных спектрах энергия распределена по-разному. Еще надежнее удостовериться в этом можно, если исследовать спектры при помощи термоэлемента (см. § 149).
Для обычных источников эти различия в спектре не очень значительны, однако их можно без труда обнаружить. Наш глаз даже без помощи спектрального аппарата обнаруживает различия в качестве белого света, даваемого этими источниками. Так, свет свечи кажется желтоватым или даже красноватым по сравнению с лампой накаливания, а эта последняя заметно желтее, чем солнечный свет.
Еще значительнее различия, если источником света вместо раскаленного тела служит трубка, наполненная газом, светящимся под действием электрического разряда. Такие трубки употребляются в настоящее время для светящихся надписей или освещения улиц. Некоторые из этих газоразрядных ламп дают ярко желтый (натриевые лампы) или красный (неоновые лампы) свет, другие светятся беловатым светом (ртутные), ясно отличным по оттенку от солнечного. Спектральные исследования света подобных источников показывают, что в их спектре имеются только отдельные более или менее узкие цветные участки.
В настоящее время научились изготовлять газоразрядные лампы, свет которых имеет спектральный состав, очень близкий к солнечному. Такие лампы получили название ламп дневного света (см. § 186).
Если исследовать свет солнца или дугового фонаря, профильтрованный через цветное стекло, то он окажется заметно отличным от первоначального. Глаз оценит этот свет как цветной, а спектральное разложение обнаружит, что в спектре его отсутствуют или очень слабы более или менее значительные участки спектра источника.
Спектральные закономерности. Линейчатый спектр атома представляет собой совокупность большого числа линий, разбросанных по всему спектру без всякого видимого порядка. Однако внимательное изучение спектров показало, что расположение линий следует определенным закономерностям. Яснее всего, конечно,
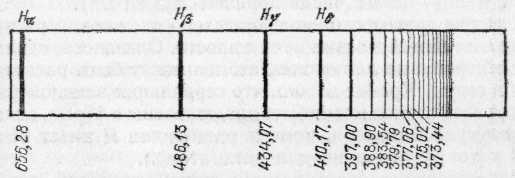
Рис. 326. Линейчатый спектр водорода (серия Бальмера, длины волн в нанометрах). H, Н, Н и H — обозначения первых четырех линий серии, лежащих в видимой области спектра
эти закономерности выступают на сравнительно простых спектрах, характерных для простых атомов. Впервые такая закономерность была установлена для спектра водорода,
изображенного на рис. 326.
В 1885 г. швейцарский физик и математик Иоганн Якоб Бальмер (1825—1898) установил, что частоты отдельных
линий водорода выражаются простой формулой:
![]()
где означает частоту света, т. е. число волн, испускаемых в единицу времени, R — называемая постоянной Ридберга величина, равная 3,28984•1015 с-1, и m — целое число. Если задавать для т значения 3, 4, 5 и т. д., то получаются значения, очень хорошо совпадающие с частотами последовательных линий спектра водорода. Совокупность этих линий составляет серию Бальмера.
В дальнейшем было обнаружено, что в спектре водорода еще имеются многочисленные спектральные линии, которые также составляют серии, подобные серии Бальмера.
Частоты этих линий могут быть представлены формулами
![]() (серия
Лаймана),
(серия
Лаймана),
![]() (серия
Пашена),
(серия
Пашена),
причем R имеет то же самое числовое значение, что и в формуле Бальмера. Таким образом, все водородные серии можно объединить одной формулой:
![]()
где n и m — целые числа, причем mn+1 *).
Спектры других атомов значительно сложнее, и распределение их линий в серии не так просто. Оказалось, однако, что спектральные линии всех атомов могут быть распределены в серии. Крайне важно, что сериальные закономерности для всех атомов могут быть представлены в форме, подобной формуле Бальмера, причем постоянная R имеет почти одно и то же значение для всех атомов.
Существование спектральных закономерностей, общих для всех атомов, указывало несомненно на глубокую связь этих закономерностей с основными чертами атомной структуры. Действительно, датский физик, создатель квантовой теории атома Нильс Бор (1885—1962) в 1913 г. нашел ключ к пониманию этих закономерностей, установив в то же время основы современной теории атома (см. гл. XXII).
