
Хим.Св. Железа
3Fe+C=(t>500)Fe3C Fe+4HNO3(k)=Fe(No3)3+NO+2H2O 3Fe+4H2O(ниже600)↔Fe3O4+4H2 4Fe+2H2O+3O2=4FeO(OH) Fe+2NaOH(k)+2H2O=(t)Na2[Fe(OH)4]+H2 Fe+2KNO3=K2FeO4+2NO
Реакции отщепления у спиртов и галлогеналканов. Пр-ло Зайцева. (Е) Атом Н отщепляется от того соседнего атома С(С-Г, С-ОН)где атомов Р меньше)
СН3-СН-СН2-СН3=(КОНтв, Спирт,t,-KCl, -H2O) CH3-CH=CH-CH3(осн прод.) | 2- бутен Cl
СН3-СН-СН2-СН3=(H2SO4, 180 С, -Н2О) CH3CH=CHCH3
| бутен-2
OH
химические св щел Ме
Хим. св-ва щелочных(т.к.с водой образуют щелочи)металлов (Li,Na,K,Rb,Cs,Fr):
1)с сухим водородом:2Na+H2=(t)2NaH(гидрид Na);
2)c кислородом энергично:Li+O2=Li2O, Na+O2=Na2O2(пероксид);K,Rb,Cs+O2=KO;
с изб.мет.образуются оксиды:Na2O2+2Na=2Na2O.
3)с водой: 2Na+2H2O=2NaOH+H2↑.(Li-реаг.медленно,Na-энергично,K-с воспламенен,Rb-со взрывом,Cs-даже при t=-108).
Оксиды энергично: Na2O+H2O=2NaOH,
гидриды энергично:NaH+H2O=NaOH+H2O.
17
Физ. св щел Ме
Простые вещ-ва, образованные элементами 1-а подгруппы, представляют собой легкоплавкие металлы серебристо-белого цвета (кроме цезия- золотисто-желт.)Они очень мягкие и легкие, обладают высокой сжимаемостью, тепло- и электропроводностью. Tпл вниз по подгруппе постепенно понижается, а плотность повышается. Плотность Li почти в 2 раза меньше чем плотность воды-это самое легкое ТВ вещ-во при комнатной t. Li тверже чем Na но мягче чем Pb.
Промышленное получение Al.
1)Очистка боксита от примесей получают Глинозем(Al2O3)
2)Электролиз (Холл,Эру)
Tпл Al2O3=2050!
3)В смесь глинозема +95% креолита(tпл970)
4)2АL2O3(расплав)=(эл.ток.)4Al(на катоде)+3О2↑(на аноде)
Реакции окисления спиртов.
3ые с расщеплением С-С
СН3СН2ОН→[O]CH3C=O→[O] CH3-C=O
\ \
H OH
2ые
CH3CHCH3→[O]CH3CCH3 (кетоны в жест усл могут расщепл)
| || с расщеплением С-С
OH O [O]- KMnO4(H2SO4)/K2Cr2O7(H2SO4)
Физ св Фосфора Белый Фосфор.(желтый) Образуется при быстром охлаждении паров Р, белое с кристальным оттенком вещ-во.tпл=44.кип=257, имеет чесночный запах, мягче чем воск, его хранят в воде в темноте, хорошо растворяется в сероуглероде, ядовитое при t=40гр самовоспламеняется, при попадании брызг получаются ожоги. кристаллическая решетка Р4 очень напряжена эта структура обуславливает низ tпл, высокую летучесть и выс. Хим. Активность.Красный. –темно красное мелкокристаллическое малолетучее вещ-во не растворяется в органических растворителях.Р4(бел)=(300,50часов кат-I2, без дост воздуха)Неоднороден, состоит их мелких кристаллов фиолетового цв. Почти не ядовит tвоспл=240 (самовозгорание не происходит но если зажечь, бурно горит)менее активен чем белый, с ок-ем обр-ют взрывч. Смеси.Черный.-наиболее устойчивая форма он не токсичен, явл-ся полупроводником.Р4=(400,кат Hg)4Р черн. По виду напоминает графит жирный на ощупь,раздел-ся на чешуйки, кр.реш. представляет собой слои. Хим. Малоактивен не растворяется при комн температуре, воспламеняется при 490
18
хим св Фосфора
1)Р4изб+3O2=P4O6
P4+5O2изб=(t)P4O10
P4O6+O2=(t)P4O10=P2O5
2)c галогенами
2Pизб+3Cl2=PCl3
2P+5Cl2изб =2PCl5
PCl3+Cl2=(t)PCl5
3)C cерой
4P+3S=(t)P4S3
4) c раствором щелочи(диспропорц)
P4+3KOH+3H2O=3KH2PO2+PH3↑
5) c HNO3(k) / H2SO4(k)
3P+5HNO3(k)+2H2O=3H3PO4+5NO↑
2P+5H2SO4(k)=(t) 2H3PO4+5SO2↑+2H2O
6) c Me
2P+3Ca=(t)Ca3P2
7) при горении спичек
12P+10KClO3=(t)3P4O10+ 10KCl
Реакции окисления альдегидов. Реакция серебряного зеркала.
CH3-C=O→(KMnO4,H2SO4)CH3-C=O
\ \
H OH
Альдегиды можно окислить по реакции серебряного зеркала.
CH3-C=O→([Ag(NH3)2]OH) CH3-C=O
\ (-Ag 0 ↓) \
H O- NH4+
19
Физические и химические свойства цинка. Цинк - металл средней твердости. В холодном состоянии хрупок, а при 100-150 °С весьма пластичен и легко прокатывается в листы и фольгу толщиной около сотых долей миллиметра. При 250 °С вновь становится хрупким. tпл=419,5 С; tкип=906 С. На воздухе цинк покрывается тонкой пленкой оксида ZnO. При сильном нагревании сгорает с образованием амфотерного белого оксида ZnO:
2Zn + O2 = 2ZnO.
ZnO + 2HNO3 = Zn(NO3)2 + H2O
ZnO + 2NaOH = Na2ZnO2 + Н2,
Zn + 2HCl = ZnCl2 + H2↑,
Zn + H2SO4(разб.) = ZnSO4 + H2↑
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑,
Взаимодействие металлов с серной кислотой.
H2SO4(разб) + Ме (до Н) = Соль + Н2
Н2SO4(разб) + Ме (после Н) = не реагирует
H2SO4(конц.) + Ме (до Н) = Соль + Н2О +S ((H2S))
H2SO4(конц) + Ме (после Н) = Соль + Н2О+SO2
Fe, Al, Cr + H2SO4(конц) = X2O3+H2O+S пассивация.
Промышленное получение углекислого газа и кремния.
CaCO3(известняк)=CaO+CO2↑ 900-1200 C
В лаборатории:
CaCO3+2HCl=CaCL2+CO2↑+H2O (в аппарате Киппа)
Реакции восстановления альдегидов и кетонов.(на Ni, можно Pt)
CH3-C=O→(H2,t,Ni)CH3CH2OH
\
H
CH3-C-CH3→(H2,t,Ni) CH3CHOH пропанол-2
\\ |
O OH
Реакции радикального замещения на примере метана.
Атакующей частицей является свободный радикал, такие частицы или атомы нейтральны и имеют неспаренный е по типу превращения это замещение:
R-H+Cl=(hv)R-Cl+HCl
R-H+Cl=(hv)R-Cl
-HCl
CH4+Cl2→(hv)CH3Cl+HCl
CH4+Br2→(hv)CH3Br+HCl
20
Сопряженные диены. Присоединение Br к 1,3-бутадиену
CH2=CH-CH=CH2→(Br2,CCl4)CH2CHCH=CH2
| |
Br Br
→(Br2,CCl4)CH2CH=CH-CH2
| |
Br Br сопряженные алкадиены (или просто диены; кратные связи расположены через одну простую): СН2=СН-СН=СН2 (бутадиен-1,3), СН3-СН=СН-СН=СН-СН3 (гексадиен-2,4):
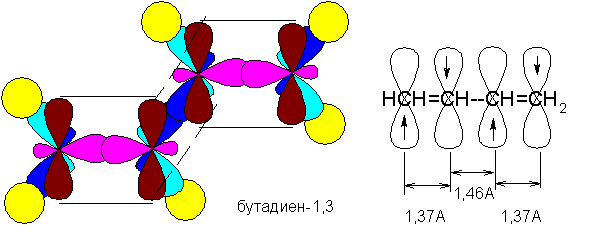
У сопряженных диенов наблюдается перекрывание соседних р-орбиталей (между атомами углерода, «формально» разделенными простой связью). Такое перекрывание имеет место в реальности, хотя в структурных формулах оно не отражается. На самом деле, в молекуле бутадиена-1,3, например, не существует «чистых» простых или двойных связей, а все связи «усреднены» и представляют собой нечто среднее между простой и двойной связью. Такое усреднение не является абсолютным.
в) изолированные диены (кратные связи разделены более чем одной простой):
СН2=СН-СН2-СН=СН2 (пентадиен-1,4):
1.Поведение KMnO4 с восст-лями в различ.средах. 2KMnO4+5Na2SO3+3H2SO4=2MnSO4+5Na2SO4+3H2O в кислой среде KMn(+7)O4 восст-ся до Mn(+2)SO4,а SO3(+4) окис-ся до SO4(+6); 2KMnO4+3Na2SO3+2H2O=2MnO2↓+2KOH+3H2SO4 в нейтр.среде SO3(-2) окисл. до SO4(-2),а KMnO4 восст. до КОН и MnO2; 2KMnO4+Na2SO3+2КОH=2К2MnO4+Na2SO4+H2O –в щелоч.среде KMn(+7)O4 восст-ся до KMn(+6)O4, SO3(+4) до SO4(+6).
21
Химические св. азота
N2 + 3H2=(t,p,kat)2NH3
O2=(эл.разряд)2NO
3Mg =(t) Mg3N2(нитрид магния)
Полимеризация-Это последовательное соединение малых молекул(мономеров)в более крупные молекулы (поли-)Полимер получ-й из одинаковых мономеров называется гомополимером.
nA----------An
моно- поли
(гомополимер)
nCH2=CH2→(t,p,kat)(-СH2-CH2-)n двойная связь рвется
n=20- жидк n=500-2000 (полиэтилен)
Химические свойства углерода.
при комн температ активность низкая
С+2S=(750-1000)CS2
3C+CaO=(t,)CaC2+CO
C+2H2=(t,Ni-й катализатор)CH4
С+O2=CO2 C-восст
2ZnO+C=2Zn+CO2 C-восст Fe,Cu,Zn,Pb и др из их оксидов.
C+H2O(пар)→CO+H2
C+H2SO4(k)→CO2↑+SO2↑+H2O
C+HNO3(k)→CO2↑+NO2↑+H2O
C+F2→CF4
Взаимодействие H2SO4 c неМе
С+2H2SO4(k)→CO2+2SO2+2H2O
2P0 +H2S+6 O4(k)→2H3PO4+SO2+2H2O
-5e +2e
S0 +2H2S+6 O4(k)→(t)SO2+2H2O
22Промышленное получение фосфора
Получение. Фосфор в промышленности получают из фосфата кальция Ca3(PO4)2, который выделяют из фосфоритов и фторапатитов. Метод получения основан на реакции восстановления Ca3(PO4)2 до фосфора. В качестве восстановителя используют кокс (углерод) . Для связывания соединений кальция добавляют кварцевый песок SiO2. Реакция протекает по уравнению:
2Ca3(PO4)2 + 6SiO2 + 10C = 6CaSiO3 + P4 +10CO.
Реакции окисления первичных и вторичных спиртов.
Реакции окисления спиртов.
3ые Окисление происходит в жестких условиях при этом связи С-С рвутся
1ые СН3СН2ОН→[O]CH3C=O→[O] CH3-C=O
\ \
H OH
2ые
CH3CHCH3→[O]CH3CCH3 (кетоны в жест усл могут расщепл)
| || с расщеплением С-С
OH O [O]- KMnO4(H2SO4)/K2Cr2O7(H2SO4)
Физические и химические свойства щелочноземельных Ме.
Ca | 1) возр Ме св
Sr | 2) усилив реакц способность
Ba |
Ra ↓
Металлические св-ва ослабевают по периоду слева направо, они менее акт-ны чем щелочные, и темпер пл, кип меньше чем у щ-зем Ме.
t пл Ca=842,Ba =727. Me серебристо-белые, окрашивают пламя в следущ цвета : Са оранж-красный, Sr- карминово-красный, Ва- желто-зеленый.
Химич св-ва:
1)с О2
2Ca+O2=(t)2Cao
2Ba+O2=(800)2Ba0
Ba+O2=(500-600)BaO2
2)c H2
Ca+H2=(t)CaH2
3)реагирует с Сl и др нужна температура 200 и выше
4)Взаимодействие с водой
Ca+2H2O=Ca(OH)2↓(если выпадает известк.молоко)+H2↑
