
1
Физические и химические свойства цинка. Цинк - металл средней твердости. В холодном состоянии хрупок, а при 100-150 °С весьма пластичен и легко прокатывается в листы и фольгу толщиной около сотых долей миллиметра. При 250 °С вновь становится хрупким. tпл=419,5 С; tкип=906 С. На воздухе цинк покрывается тонкой пленкой оксида ZnO. При сильном нагревании сгорает с образованием амфотерного белого оксида ZnO:
2Zn + O2 = 2ZnO.
ZnO + 2HNO3 = Zn(NO3)2 + H2O
ZnO + 2NaOH = Na2ZnO2 + Н2,
Zn + 2HCl = ZnCl2 + H2↑,
Zn + H2SO4(разб.) = ZnSO4 + H2↑
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑,
Взаимодействие металлов с серной кислотой.
H2SO4(разб) + Ме (до Н) = Соль + Н2
Н2SO4(разб) + Ме (после Н) = не реагирует
H2SO4(конц.) + Ме (до Н) = Соль + Н2О +S ((H2S))
H2SO4(конц) + Ме (после Н) = Соль + Н2О+SO2
Fe, Al, Cr + H2SO4(конц) = X2O3+H2O+S пассивация.
Промышленное получение углекислого газа и кремния.
CaCO3(известняк)=CaO+CO2↑ 900-1200 C
SiO2+2C(кокс)=Si+2CO
Химические свойства галогеналканов.
Легко вступают в реакции замещения и отщепления.
Реакции нуклеофильного замещения:
СН3СН2Br+NaNO2→CH3CH2NO2(нитроэтан) +NaBr
СН3СН2Br+NH3→[СН3СН2NH3]Br(бромидэтиламмония)+NH3=СН3СН2NH2(этиламин)+NH4Br
СН3СН2Br+NaOH→(H2O) СН3СН2OH(этанол)+NaBr
Реакция отщепления:
СН3СН2Br+KOH(тв)→(спирт, t, C2H5OH) C2H4+KBr+H2O
Химические свойства оксида и гидроксида цинка.
ZnO+2HCl=ZnCl2+H2O
ZnO+C=Zn+CO
ZnO+2NaOH=Na2ZnO2+H2O
ZnO+Na2CO3=Na2ZnO2+CO2
ZnO+H2SO4(разб)=ZnSO4+H2O
Zn(OH)2+2NaOH=Na2Zn(OH)4
Zn(OH)2+HCl=ZnCl2+H2O
Zn(OH)2+H2SO4=ZnSO4+H2O
Zn(OH)2+HNO3+Zn(NO3)2+ H2O
2
Взаимодействие неМе с серной кислотой.
С+2H2SO4(k)→CO2+2SO2+2H2O 2P0 +H2S+6 O4(k)→2H3PO4+SO2+2H2O S0 +2H2S+6 O4(k)→(t)SO2+2H2O
Промышленное получение оконного стекла.
Na2CO3+CaCO3+6SiO2=Na2O*CaO*6SiO2+2CO2↑ 1500 C
Na2SO4+C+CaCO3+6SiO2= Na2O*CaO*6SiO2+CO2↑+SO2↑+ CO↑ 1500 C
Химические свойства альдегидов и кетонов.
CH3COCH3(ацетон, кетон)→(H2,t) CH3CHOHCH3(2-пропанол)
СH3COH→(KMnO4, H2SO4) CH3COOH
CH3COH→([Ag(NH3)]OH) CH3COONH4+Ag
Химические свойства железа.
3Fe + 2O2 = Fe2O3 • FeO
4Fe + 3О2+ 6Н2О = 4Fe(ОН)3
2Fe + 3Cl2 = 2FeCl3
Fe + CuSO4 = FeSO4 + Cu
Fe + 2Cl = FeCl2 + H2
Графит. Алмаз.
Графит-уголь(каменный, древесный), сажа. Аллотропная модификация углерода. Структура слоистая. Представляет собой правильный шестиугольник.
Алмаз-минерал, аллотропная модификация углерода. Очень твердый минерал, малолетуч, химически инертен.
Химические свойства карбоновых кислот. Понятие об аминокислотах.
Реагирует с металлами до Н.
CH3COOH+Na→CH3COONa+H2
CH3COOH+NaOH→CH3COONa+H2O
CH3COOH+Na2CO3→ CH3COONa+H2O+CO2
CH3COOH+CH3CH2OH(изб)→H2SO4=CH3COOCH2CH3+H2O
CH3COOH+CuO→(CH3COO)2Cu+H2O
Аминокислоты-орг. соединения, которые использует природа для построения сложных биологических структур.
Известно 22 аминокислоты в природе. Половина из них может синтезироваться в организмах животных и людей, половина-нет.
Химические свойства оксида железа(3).
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+Na2CO3=2NaFeO2+CO2
Fe2O3+2NaOH=2NaFeO2+H2O
Fe2O3+3H2=2Fe+3H2O
3
Взаимодействие металлов с азотной кислотой.
HNO3(конц)+ Ме(Все кроме благородных)=Соль + H2О + NO2
HNO3(конц)+ Fe, Al, Cr=Х2О3 + H2О +NO2
HNO3(разб)+Ме(до Н)=Соль + H2О + N2O, N2
HNO3(разб)+Ме( после Н)= Соль + H2О + NO
HNO3(оч.разб)+Ме(до Н)=Соль + H2О + NH4NO3
Графит. Алмаз.
Графит-уголь(каменный, древесный), сажа. Аллотропная модификация углерода. Структура слоистая. Представляет собой правильный шестиугольник.
Алмаз-минерал, аллотропная модификация углерода. Очень твердый минерал, малолетуч, химически инертен.
Жиры и мыла.
Жиры, или триглицериды — природные органические соединения, полные сложные эфиры глицерина и одноосновных жирных кислот; входят в класс липидов. В живых организмах выполняют структурную, энергетическую и др. функции.
Состав жиров отвечает общей формуле: CH2-O-C(O)-R¹ | CH-О-C(O)-R² | CH2-O-C(O)-R³, где R¹, R² и R³ — радикалы (иногда различных) жирных кислот.
Мы́ло — растворяющаяся в воде моющая масса (кусок или густая жидкость), получаемая взаимодействием жиров и щелочей.
В химическом отношении основным компонентом твёрдого мыла являются смесь растворимых солей высших жирных кислот. Обычно это натриевые, реже калиевые и аммониевыесоли таких кислот как стеариновая, пальмитиновая, миристиновая, лауриновая и олеиновая.
Физические и химические свойства алюминия.
Самый распр. в мире металл. Открыл Эрстед в 1825 г. Входит в состав алюмосиликатов, из которых образована земная кора.
Серебристый, белый металл. tпл=660 С. Мягкий, легко вытягивается в проволоку и прокатывается в фольгу. Легкий, но прочный, прекрасный проводник электрического тока, устойчивый к коррозии. Обладает высокой теплопроводностью, нетоксичен.
4Al+3O2=t=2Al2O3
2Al+3S=t>200=Al2S3 (единственный метод получения сульфита)
4Al+3C=1500=Al4C3
2Al+3Cl2=2AlCl3
8Al+3Fe3O4=2000=4Al2O3+9Fe
2Al+6HCl=2AlCl3+H2
2Al+30HNO3(разб)=8Al(NO3)3+3(NH)2NO3+9H2O
2Al+6NaOH+6H2O=2Na3[Al(OH)6]+3H2
Получение натрия, соды методом Сольве.
NaCl(расплав)=эл-з=Na(на катоде)+1/2Cl(на аноде)
4NaOH(расплав)=эл-з=4Na(на катоде)+2H2O +О2(на аноде)
NaCl+CO2=кат=Na+Cl2
NaCl(насыщен. раствор)+NH3+CO2+H2O=NaHCO3(питьевая сода)+NH4Cl
2NaHCO3=t=Na2CO3(сода)+СО2+H2O
4
Физические и химические свойства серы.
Се́ра — Проявляет неметаллические свойства. В водородных и кислородных соединениях находится в составе различных ионов, образует многие кислоты и соли. Многие серосодержащие соли малорастворимы в воде. Светло-жёлтое хрупкое твёрдое вещество, в чистом виде без запаха.
tпл = 119,3 °C, tкип = 444,674 °C.
S + Na = Na2S 2S + C(графит) = CS2
S + 3F2 = SF6 S + 2H2SO4(конц.) = 2SO2↑ + 2H2O S + 6HNO3(конц.) = H2SO4 + 6NO2↑ + 2H2O
3S + 6KOH(конц.) = 2K2S−II + K2SIVO3 + 3H2O
Na2S+2S=Na2S2
Химические свойства алканов.
СH4+Cl2→CH3Cl+HCl галогенирование
RH + HNO3 → RNO2 + H2OНитрирование
С5H12+8O2→5CO2+6H2O горения
CH3-CH3 → CH2=CH2 + H2 дегидрирование (этан в этен) 400—600 °C, катализаторы — Pt, Ni, Al2O3, Cr2O3
Промышленное получение простого и двойного суперфосфатов.
Сa3(PO4)2(изб)+2H2SO4=Ca(H3PO4)2+2CaSO4 простой
Сa3(PO4)2+4H3PO4=2Ca(H2PO4)2 двойной
Физические и химические свойства кремния.
Кремний второй по распространенности на Земле элемент. В чистом виде нет в природе. tпл=1415 С, tкип=3250 С.
твёрдость кремния значительно меньше, чем алмаза. Кремний хрупок, только при нагревании выше 800 °C он становится пластичным веществом.
Si+2NaOH+H2O=t=Na2SiO3+2H2
Si+4HF=t=SiF4=2H2
Si+18HF+HNO3=t=3H2[SiF6]+4NO+8H2O
Si+O2=t=SiO
Si+2F2=t=SiF4
Si+2Cl2=t=SiCl4
Si+2S=t=SiS2
Si+C(гр)=t=SiC(карборунд)
Si+2Mg=t=Mg2Si
Промышленное получение едкого натра и алюминея.
2NaCl+2H2O=электролиз=2NaOH+H2(катод)+Сl2(анод)
5
Химические свойства алкенов.
C3H6+Br2→(ССl) CH3-CH-CH2 1.2-дибромпропан
| |
Br Br
C3H6+HBr→ CH3-CH-CH3
|
Br
C3H6+H-O-H→(H2SO4) CH3-CH-CH3
|
OH
C3H6+H2→(Ni,t) CH3CH2CH3
Белый, красный и черный фосфор.
Белый фосфор представляет собой белое вещество (из-за примесей может иметь желтоватый оттенок). По внешнему виду он очень похож на очищенный воск или парафин, легко режется ножом и деформируется от небольших усилий.
Белый фосфор имеет молекулярное строение; формула P4. Отливаемый в инертной атмосфере в виде палочек (слитков), он сохраняется в отсутствие воздуха под слоем очищенной воды или в специальных инертных средах.
Легкорастворим в органических растворителях. Растворимостью белого фосфора в сероуглероде пользуются для промышленной очистки его от примесей. Плавится белый фосфор при 44,1 °C. В парообразном состоянии происходит диссоциация молекул фосфора.
Химически белый фосфор чрезвычайно активен. Например, он медленно окисляется кислородом воздуха уже при комнатной температуре и светится (бледно-зелёное свечение). Явление такого рода свечения вследствие химических реакций окисления называется хемилюминесценцией (иногда ошибочно фосфоресценцией).
Белый фосфор не только активен химически, но и весьма ядовит.
Красный фосфор — это более термодинамически стабильная модификация элементарного фосфора. Впервые он был получен в 1847 году в Швеции австрийским химиком А. Шрёттером при нагревании белого фосфора при 500 °С в атмосфере угарного газа (СО) в запаянной стеклянной ампуле.
Красный фосфор имеет формулу Рn и представляет собой полимер со сложной структурой. В зависимости от способа получения и степени дробления, красный фосфор имеет оттенки от пурпурно-красного до фиолетового, а в литом состоянии - тёмно-фиолетовый с медным оттенком, имеет металлический блеск. Химическая активность красного фосфора значительно ниже, чем у белого; ему присуща исключительно малая растворимость. Растворить красный фосфор возможно лишь в некоторых расплавленных металлах (свинец и висмут).
Чёрный фосфор — это наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Впервые чёрный фосфор был получен в 1914 годуамериканским физиком П. У. Бриджменом из белого фосфора в виде чёрных блестящих кристаллов. Чёрный фосфор представляет собой чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, и с полностью отсутствующей растворимостью в воде или органических растворителях. Поджечь чёрный фосфор можно, только предварительно сильно раскалив в атмосфере чистого кислорода до 400 °С. Чёрный фосфор проводит электрический ток и имеет свойства полупроводника. Температура плавления чёрного фосфора 1000 °С под давлением 18·105 Па.
6
Физические и химические свойства щелочных металлов.
1 группа щелочные металлы. Называются щелочными т.к. эти металлы и их оксиды с водой образуют щелочи. Они очень реакционноспособные, поэтому в чистом виде не встречаются. Получение-электролиз.
Усиливаются металлические свойства, радиус атома, восстановительные свойства в ряду Li, Na, K,Rb, Cr, Fr. Температура плавления и кипения, наоборот, падает. Они мягкие, обладают низкими температурами плавления и кипения. Это серебристо-белые металлы. Хранят Li,Na,K в герметичной таре под слоем керосина. Rb, Cs в стеклянных запаянных ампулах. Окрашивают пламя газовой горелки: Li-малиновый, Na-желтый, K, Rb, Cs-розово-фиолетовый.
Реагируют с сухим водородом.
2Na+H2=t=2NaH(гидрид натрия)
C кислородом.
Li Li2O
Na + O2= Na2O2
K, Rb, Cs KO2, RbO2, CsO2
C избытками металла образуют оксиды.
Na2O2+2Na=2Na2O
C водой.
2Na+2H2O=2NaOH+H2
Получение оксида азота(2), (4), азотной кислоты.
N2+3H2=t,p,Fe=2NH3
4NH3+5O2=Pt-Rb,t=4NO+6H2O
2NO+O2=2NO2
4NO2+O2+H2O=4HNO3 азотная кислота
3Сu+8HNO3(разб)=3Cu(NO3)2+2NO+3H2O
2NaNO2+2NaJ+2H2SO4=Na2SO4+2H2O+2NO+J оксид азота 2
Сu+4HNO3(конц)=NO2+Cu(NO3)2+2H2O оксид азота 4
Химические свойства алкинов.
Br Br
| |
С3H4+Br2 →(CCl) CH3-C=CH→CH3-C-CH
| | | |
Br Br Br Br
J
|
С3H4+HJ→CH3-C=CH2→CH3-C-CH3
| | |
J J J
С3H4+H-O-H→(H2SO4,HgSO4) CH3-C=CH2(енол)→CH3-C-CH3(кетон, ацетон)
| ||
OH O
С3H4+H2→(Pd,PbO,CaCO3) CH3-CH=CH2 пропен
С3H4+H2→(Ni) CH3-CH2-CH3 пропан
7
Физические и химические свойства меди.
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет. Медь обладает высокой тепло- и электропроводностью. Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом. tкип=2540 , tпл=1084,5.
Сu + 8HN03(разб) = 3Cu(N03 )2 + 2NO + 4Н20 Сu + 4HN03 (конц)= Cu(N03)2 + 2N02+ 2Н20 Сu+ 2H2S04(конц) = CuS04 + S02 + 2 Н20
2 Сu + O2 =2CuO
Cu+S=CuS
Cu+Cl2=CuCl2
2Cu+H2O+CO2+O2=Cu2CO3(OH)2
2Cu+2NO=(500-600 C) 2CuO+N2
2Cu+S=(300-400 C) CuS2
4Cu+SO2=(600-800 C) Cu2S+2CuO
Физические и химические свойства хлора.
Хлор зеленый газ с резким запахом. Ядовит. tкип=101 С, tпл=-34 С
Cl2+H2O=HCl+HClO
Cl2+H2=(hv) 2HCl
Cl2+2NaJ=2NaCl+J2
Cl2+2NaBr=2NaCl+Br2
Cl2+2NaOH=NaCl+NaClO+H2O
Cl2+6NaOH=5NaCl+NaCLO3+3H2O
Cl2+2Ca(OH)2=CaCl2+CaCLO2+2H2O
Промышленное получение фосфорной, серной кислоты.
1)Контактный метод
4FeS2+11O2= (t) 2Fe2O3+8SO2
SO2+1/2O2=(V2O5) SO3
SO3+H2O=(H2SO4) H2SO4
2)Нитрозный метод
4FeS2+11O2= (t) 2Fe2O3+8SO2
SO3+NO2=SO3+NO
SO3+H2O=(H2SO4) H2SO4
1)Экстракционный метод
Ca3(PO4)2+3H2SO4(50% изб)=3CaSO4+2H3PO4
2)Термический метод
Ca3(PO4)2+5C+3SiO2=(1500 C) 3CaSiO3+5CO+P2
2P2=(окисление) P4
P4+5O2(изб)=(t) P4O10
P4O10+6H2O(изб, гор)=(t) 4H3PO4
8
Химические свойства бензола.
2С6Н6 +
15О2 ![]() 12СО2 +
6Н2О.
12СО2 +
6Н2О.
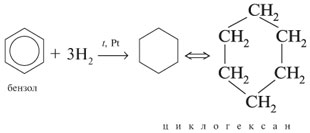 t,
Pt.
бензол→циклогексан
t,
Pt.
бензол→циклогексан
С6H6+Br2→(FeBr3) C6H5-Br +HBr бромбензол
C6H6+HNO3(конц)→ (H2SO4 конц) С6H5-NO2 нитробензол
C6H6+H2SO4(конц)←→ (t) C6H5-SO3H+H2O бензолсульфакислота
С6H6+CH3CH2Cl→( AlCl3, t) C6Н5 CH2CH3+HCl этилбензол
O O
|| ||
C6H6+CH3-C -Cl→(AlCl3, t) C6H5- C=CH3 метилфенилкетон.
Физические и химические свойства алюминия.
Самый распр. в мире металл. Открыл Эрстед в 1825 г. Входит в состав алюмосиликатов, из которых образована земная кора.
Серебристый, белый металл. tпл=660 С. Мягкий, легко вытягивается в проволоку и прокатывается в фольгу. Легкий, но прочный, прекрасный проводник электрического тока, устойчивый к коррозии. Обладает высокой теплопроводностью, нетоксичен.
4Al+3O2=t=2Al2O3
2Al+3S=t>200=Al2S3 (единственный метод получения сульфита)
4Al+3C=1500=Al4C3
2Al+3Cl2=2AlCl3
8Al+3Fe3O4=2000=4Al2O3+9Fe
2Al+6HCl=2AlCl3+H2
2Al+30HNO3(разб)=8Al(NO3)3+3(NH)2NO3+9H2O
2Al+6NaOH+6H2O=2Na3[Al(OH)6]+3H2
Получение углекислого газа.
CaCO3(известняк)=CaO+CO2↑ 900-1200 C
СаCO3 + 2HCl = CaCl2 + CO2 ↑ +H2O
Строение бензола.
Молекула C6H6 имеет плоское шестиугольное строение. Все атомы С находятся в sp2-гибридном состоянии. Углы между всеми связями 120 градусов, и все связи имеют равную длину. У каждого С остается по одному р-элементу, они все оказываются поделенными между всеми 6-ю атомами С.
Элементы равномерно распределены в поле 6 атомов С-делокализация. Это сопровождается выделением дополнительной энергии, которая называется энергией сопряжения 150кДж/моль. Это обуславливает высокую устойчивость кольца.
9
Химические свойства оксида железа 3 и гидроксида железа 3.
Fe2O3+Na2CO3=2NaFeO2+CO2
Fe2O3+2NaOH=2NaFeO2+H2O
Fe2O3+3H2=(100 C) 2Fe+3H2O
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+3H2O+3H2O=2[Fe(H2O)6]
Fe(OH)3 + 3КОН → K3[Fe(OH)6].
2Fe(OH)3 =(t) Fe2O3+3H2O
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
Fe(OH)3 + 3H= Fe3+ + 3H2O
Fe(OH)3 + OH= [Fe(OH)4]
Взаимодействие неметаллов с серной кислотой.
Химические свойства водорода.
H2газ+F2газ=(н.у. в темноте) 2HFгаз
H2газ+Cl2газ=(hv) 2HClгаз
2H2газ+O2газ=(Pt) 2H2Oгаз
3H2+N2=(450-500 C, Fe, p) 2NH3
H2+Cкокс=(600 C, p, Pt) CH4
H2+Cкокс=(2000 C) C2H4
H2+2Na=(300 C) 2NaH
Реакция Фриделя-Кравтса на примере бензола.
O O
|| ||
C6H6+CH3-C-Cl→(AlCl3, t) C6H5-C-CH3
ацитилхлорид метилфенилкетон
Реакции присоединения воды к алкенам и алкинам.
CH3-CH=CH2+H2O→(H2SO4) CH3-CH-CH3
|
OH
HC≡CH+H2O→(H2SO4, HgSO4) CH2=CH-OH→CH3-C=O
|
H
1.Хим.св-ва оксида железа(II):
FeO+2HCl=FeCl2+H2O; FeO+4HNO3=Fe(NO3)3+NO2+2H2O; FeO+4NaOH=Na4FeO3+2H2O
2.Физич.и химич.св-ва кислорода. Бесцветный газ, в жидком состоянии - светло-голубой, в твердом - синий.Составная часть воздуха: 20,94% по объему, 23,13% по массе. Из жидкого воздуха кислород выкипает после азота N2.На воздухе поддерживает горение многих веществ. Малорастворим в воде (31 мл/ 1 л Н2О при 20 °С), но несколько лучше, чем N2. При комнатной температуре обладает малой химической активностью из-за прочной двойной связи в молекулах. Сильный окислитель при нагревании, реагирует с большинством металлов и неметаллов: O2 + 2Mg = 2MgO; O2 + S = SO2.Вызывает ржавление (медленное окисление) железа. 3Fe + 2O2 = Fe3O4; 4К + О2 = 2К2О ( KO2); Ba + O2 = BaO2; В кислороде горят также сложные вещества с образованием соответствующих оксидов:CH4 + 2O2 = CO2 + 2H2O
10
3.Устран-е врем. и пост. жесткости воды.
Врем:.-кипячение: Ca(HCO3)2=CaCO3↓+CO2↑+H2O
пост: фосфатами, содой,с использ. катионов: MgSO4+Na3PO4=Mg3(PO4)2↓+Na2so4; CaCl2+Na2CO3=CaCO3↓+2NaCl; MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2; 2RH+Ca=R2Ca+2H
4. Структурн.изомеры-вещ. имеют одинаковые молекулярн. формулы, но различный порядок связи атомов в молекуле, т.е различ. структурн. формулы. Пр: C4H10 : CH3-CH2-CH2-CH3 -,бутан и
CH3-CH-CH3 -2-метилпропан
|
CH3
1.Хим.св-ва оксида хрома(III) и гидроксида хрома(III):
Относится к группе амфотерных оксидов. В высокодисперсном состоянии растворяется в сильных кислотах с образованием солей хрома(III):
Cr2O3 + 6HCl → 2CrCl3 + 3H2O, Cr2O3 + 6H+ + 9H2O → 2[Cr(H2O)6]3+.
При сплавлении со щелочами и содой даёт растворимые соли Cr3+ (в отсутствие окислителей):
Cr2O3 + 2KOH → 2KCrO2 + H2O,Cr2O3 + Na2CO3 → 2NaCrO2 + CO2↑.в щелочной среде он окисляется до хромата:Cr2O3 + 3KNO3 + 2Na2CO3 → 2Na2CrO4 + 3KNO2 + 2CO2↑.,
а сильные восстановители его восст:Cr2O3 + 2Al → Al2O3 + 2Cr.
2Cr(ОН)3+3H2SO4=Cr2(SO4)3+6Н2О так и в щелочах с образованием гидроксихромитов: Cr(OH)3+NaOH=Na3[Cr(OH)6].При сплавлении Cr(ОН)3 с щелочами образуются метахромиты и ортохромиты:Cr(ОН)3+NaOH=NaCrO2+2Н2O Cr(ОН)3+3NaOH=Na3CrO3+3Н2О.При прокаливании гидроксида хрома (III) образуется оксид хрома (III):2Cr(ОН)3=Cr2O3+3Н2O.
2.Взаимод-е мет. с H2SO4:
H2SO4(разб): с мет. до Н: Н2↑, после Н –не реаг;
H2SO4( конц): с мет до Zn: H2S,S, после Zn:SO2↑ (с Au,Pt не реаг);
Пассивация Al и Fe в холодн H2SO4(конц); Ag+H2SO4(конц)=AgSO4+SO2↑+2H2O; 4Zn+5H2SO4(конц)=H2S↑+4ZnSO4+4H2O; Al+H2SO4(разб)=H2↑+Al2(SO4)3; 2FeO+4H2SO4(к)=Fe2(SO4)3+SO2+4H2O; Al+H2SO4(K)=Al2(SO4)3+H2S↑+H2O.
3.Химич.св-ва водорода.
Водород используется для восстановления многих металлов, так как отнимает кислород у их оксидов:CuO + H2 = Cu + H2O,Fe3O4 + 4H2 = 3Fe + 4Н2О; С галогенами Водород образует галогеноводороды, например:Н2 + Cl2 = 2НСl; с фтором взрывается (даже в темноте и при - 252°С), с хлором и бромом реаг. лишь при освещении или нагревании, а с I только при нагревании. С N Водород взаимодействует с образованием аммиака:ЗН2 + N2 = 2NН3;
Нагреван:Н2 + S = H2S (сероводород); 2Н2 + С (аморфный) = СН4 (метан); реагирует с некот.мет. (щелочными, щелочноземельными и др), образуя гидриды:Н2 + 2Li = 2LiH; реакции Н с оксидом углерода (II), при которых образуются в зависимости от температуры, давления и катализатора различные органические соединения, например НСНО, СН3ОН и другие. Ненасыщ.углеводороды реагируют с Водородом, переходя в насыщенные, например:СnН2n + Н2 = СnН2n+2.
4.Геометрическая изомерия
- ЦИС-ТРАНС-ИЗОМЕРИЯ, один из видов пространственной изомерии химических соединений; заключается в возможности расположения заместителей по одну (цис-изомер) или по разные стороны (транс-изомер) плоскости двойной связи (С = С, С = N) или неароматического цикла (напр., циклогексана).
11.1
1.Поведение дихромата калия с восстановителями в различных средах.K2Cr2(+6)O7+3Na2SO3+4H2SO4=Cr2(+3)(SO4)3+3Na2SO4+K2SO4+4H2O-в кисл.среде K2Cr2o7 восст.до Cr2(so4)3 и K2SO4, SO3 окисл.до SO4.
2Pb(NO3)2 + K2Cr2O7 + H2O = 2PbCrO4↓ + 2KNO3 + 2HNO3; K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
2.Взаимодействие мет.с HNO3: HNO3(к)+актив.Ме=N2O;
HNO3(к)+малоактив.Ме=NO2;
HNO3(к)+Fe,Al,Cr=пассивация Ме.
HNO3(p)+актив.Ме=NH4,NO3,N2;
HNO3(p)+малоактив.Ме=NO.
Пр: Cu+4HNO3(K)=Cu(NO3)2+2NO2↑+2H2O;
3Cu+8HNO3(P)=3Cu(NO3)2+2NO↑+4H20;
5Zn+12HNO3(P)=5Zn(NO3)2+N2O↑+6H2O;
Al+HNO3(K)=(t)Al(NO3)3+N2O↑+H2O;
Al+HNO3(P)=Al(NO3)2+N2↑+H2O;
Al+HNO3(оч.pазб)=Al(NO3)3+NH4NO3+H2O.
3.Хим. св-ва щелочных
(т.к.с водой образуют щелочи)металлов (Li,Na,K,Rb,Cs,Fr): 1)с сухим водородом:2Na+H2=(t)2NaH(гидрид Na);2)c кислородом энергично:Li+O2=Li2O, Na+O2=Na2O2(пероксид);K,Rb,Cs+O2=KO; с изб.мет.образуются оксиды:Na2O2+2Na=2Na2O.
3)с водой: 2Na+2H2O=2NaOH+H2↑.(Li-реаг.медленно,Na-энергично,K-с воспламенен,Rb-со взрывом,Cs-даже при t=-108). Оксиды энергично: Na2O+H2O=2NaOH, гидриды энергично:NaH+H2O=NaOH+H2O.
4.Алканы.Хлорир.,бромиров-е.
Алканы-углеводороды,в котор. между всеми атомами углерода связи одинарные и имеющие общую ф-лу CnH2n+2.Малая реакционная способн. Хлорирование:механизм р-ции-свободнорадикальная цепная р-ция:а)инициирование цепи: Cl∙ƚ∙Сl→Cl∙ + ∙Cl; б)зарождение цепи-Сl атакует метан медленно:Cl+H∙ƚ∙CH3→HCl+∙CH3; в)рост цепи:радикал-метил.быстро: ∙СН3+Сl∙—∙Cl→CH3Cl(хлорметан)+ ∙Сl; г)обрыв цепи: ∙Сl+∙Cl→Cl2, ∙CH3+ ∙Cl→CH3Cl, ∙CH3+ ∙CH3→CH. Р-ция хлорир. приводит к смеси изомеров моногалогеналканов. Пр.: пропан СH3-CH2-CH3+Cl2→(hv,-HCl) CH3CH2CH2Cl(хлорпропан45%)+CH3-C(вниз-Cl)H-CH3(2-хлорпропан55%)идет замещ.и при первичн. и при вторичн. атоме углерода.при этом получ.изомеры примерно в одинак кол-ве.связи СН имеют различ реакц способность. Относит. реакц. способн. связей С-Н при хлор-ии 1:3,7:5,1. Бромирование-селективный пр-сс,приводит к образованию в значит-но большем кол-ве одного продукта(основного) по сравнению с образовавшимися другими(побочными).Пр:СH3-CH2-CH3+Br2→(hv,-HBr)CH3-C(вниз-Br)H-CH3(2-бромпропаноно97%)+CH3CH2CH2Br(1-бромпропан3%).относит.реакц.спос-ть связиС-Нпри бромир:1:82:1440.чем ниже активность реагента,тем селективней идет р-ция.реакц.спос-ть галогена уменьш. В ряду:F2>Cl2>Br2>I2.
11.2
1.Поведение KMnO4 с восст-лями в различ.средах.
2KMnO4+5Na2SO3+3H2SO4=2MnSO4+5Na2SO4+3H2O в кислой среде KMn(+7)O4 восст-ся до Mn(+2)SO4,а SO3(+4) окис-ся до SO4(+6); 2KMnO4+3Na2SO3+2H2O=2MnO2↓+2KOH+3H2SO4 в нейтр.среде SO3(-2) окисл. до SO4(-2),а KMnO4 восст. до КОН и MnO2; 2KMnO4+Na2SO3+2КОH=2К2MnO4+Na2SO4+H2O –в щелоч.среде KMn(+7)O4 восст-ся до KMn(+6)O4, SO3(+4) до SO4(+6).
2. Промышленное получение азотной к-ты.
4NO2+O2+2H2O=4HNO3; KNO3+H2SO4(K)=(t)+HNO3;
NO2+H2O=HNO3+NO.
3.Хим.св-ва гидроксида Аl. Al(OH)3+3NaOH(p-p)=Na3[Al(OH)6]; Al(OH)3+NaOH(спл)=NaAlO2+H2O;
Al(OH)3+HCl=AlCl3+H2O; Al(OH)3=(t)Al2O3+H2O-получение Al2O3 в лаб.
4.Реакция этерификации.Понятие о сложных эфирах.
CH3C=O →(CH3CH2OH(изб),H2SO4) ↔CH3C=O
| |
OH OCH2CH3+H2O этилацетат
СЛОЖНЫЕ ЭФИРЫ – класс соединений на основе минеральных (неорганических) или органических карбоновых кислот, у которых атом водорода в НО-группе замещен органической группой R. Примеры:
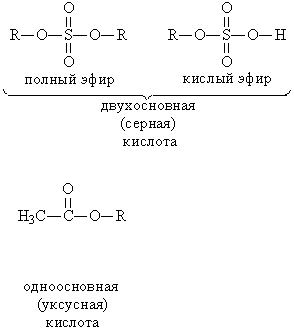
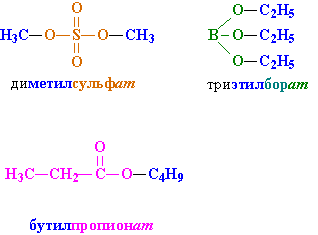
Номенклатура.Название создается следующим образом: вначале указывается группа R, присоединенная к кислоте, затем – название кислоты с суффиксом «ат» (как и в названиях неорганических солей: карбонат натрия, нитрат хрома). Примеры:
1.Поведение дихромата калия с восстановителями в различных средах.
K2Cr2(+6)O7+3Na2SO3+4H2SO4=Cr2(+3)(SO4)3+3Na2SO4+K2SO4+4H2O-в кисл.среде K2Cr2o7 восст.до Cr2(so4)3 и K2SO4, SO3 окисл.до SO4.
2Pb(NO3)2 + K2Cr2O7 + H2O = 2PbCrO4↓ + 2KNO3 + 2HNO3; K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
2.Взаимодействие неметаллов с азотной кислотой. При окис-ии немет. HNO3(K) воост-ся доNO3:
S+6HNO3(K)=H2SO4+6NO2↑+2H2O; P+5HNO3(K)=H3PO4+5NO2↑+H2O
разб. до NO: S+2HNO3(P)=H2SO4+2NO↑; 3P+5HNO3(p)+2H2O=3H2PO4+5NO↑.
12
3.Хим. св-ва щелочных(т.к.с водой образуют щелочи)металлов (Li,Na,K,Rb,Cs,Fr):
1)с сухим водородом:2Na+H2=(t)2NaH(гидрид Na);
2)c кислородом энергично:Li+O2=Li2O, Na+O2=Na2O2(пероксид);K,Rb,Cs+O2=KO; с изб.мет.образуются оксиды:Na2O2+2Na=2Na2O.
3)с водой: 2Na+2H2O=2NaOH+H2↑.(Li-реаг.медленно,Na-энергично,K-с воспламенен,Rb-со взрывом,Cs-даже при t=-108). Оксиды энергично: Na2O+H2O=2NaOH, гидриды энергично:NaH+H2O=NaOH+H2O.
4.Реакция Кучерова(гидратация) на примере ацетилена и пропина:
Катализаторы реакции Кучерова — обычно соли ртути (Hg2+). Р. Кучерова лежит в основе промышленного способа получ ацетальдегида из ацетилена; открыта русским Кучеровым в 1881. В данный момент почти не применяется, из-за вредности катализатора.
Ацетилен: CH≡CH + H2O → CH2=CH(OH) → CH3-CHO
Пропин: C3H7+H2О=H2+CO2
1.Поведение KMnO4 с восст-лями в различ.средах.
2KMnO4+5Na2SO3+3H2SO4=2MnSO4+5Na2SO4+3H2O в кислой среде KMn(+7)O4 восст-ся до Mn(+2)SO4,а SO3(+4) окис-ся до SO4(+6); 2KMnO4+3Na2SO3+2H2O=2MnO2↓+2KOH+3H2SO4 в нейтр.среде SO3(-2) окисл. до SO4(-2),а KMnO4 восст. до КОН и MnO2; 2KMnO4+Na2SO3+2КОH=2К2MnO4+Na2SO4+H2O –в щелоч.среде KMn(+7)O4 восст-ся до KMn(+6)O4, SO3(+4) до SO4(+6).
2. Промышленное получение азотной к-ты. 4NO2+O2+2H2O=4HNO3; KNO3+H2SO4(K)=(t)+HNO3;
NO2+H2O=HNO3+NO.
3. Химические свойства оксида марганца(4).
окисляет конц. соляную кислоту до хлора: 4HCl + MnO2 →(t) MnCl2 + 2H2O + Cl2↑.
С серной и азотной кислотами MnO2 разлагается с выделением кислорода:
2MnO2 + 2H2SO4 → 2MnSO4 + O2 + 2H2O.
При взаимодействии с сильными окислителями диоксид марганца окисляется до соединений Mn7+ и Mn6+: 3MnO2 + KClO3 + 6KOH → 3K2MnO4 + KCl + 3H2O.
Диоксид марганца проявляет амфотерные свойства. Так, при окислении сернокислого раствора соли MnSO4 перманганатом калия в присутствии серной кислоты образуется чёрный осадок соли Mn(SO4)2: 2KMnO4 + 8H2SO4 (конц.) + 3MnSO4 = 5Mn(SO4)2 + K2SO4 + 8H2O
При сплавлении с щелочами и основными оксидами MnO2 выступает в роли кислотного оксида, образуя соли манганиты: MnO2 + CaO → CaMnO3.
Является катализатором разложения пероксида (перекиси) водорода:
2H2O2 →(катализатор) 2H2O + O2↑.
4.Химические свойства спиртов.
(HBr,H-Г; -H2O) CH3CH2Br(бромэтан)
(Na) CH3CH2ONa+H2
(t=180,H2SO4(K), -H2O) CH2=CH2(этилен)
CH3CH2OH(этанол) → (t=140,H2SO4конц, -H2O) CH3CH2OCH2CH3(диэтиловый эфир)
(Al2O3, t=450, -H2O) CH2=CH2
(t=350,Al2O3, -H2O), CH3CH2OCH2CH3(этоксиэтан(диэтиловый эфир)
Со щелочь. спирты реаг. при усл:тверд.щелочь и кипяч-е, р-я обратима.
Окисл-е: (этанол) СH3CH2OH→CH3-C=O(этаналь)→CH3C=O(этановая к-та-уксусная)
\ \
H OH
Дегидрирование: СH3CH2OH →(Cu,t=300, -H2) CH3C=O. (спирт→альдегид)
\
H
13
1.Хим.св-ва оксида хрома(III) и гидроксида хрома(III):
Относится к группе амфотерных оксидов. В высокодисперсном состоянии растворяется в сильных кислотах с образованием солей хрома(III):
Cr2O3 + 6HCl → 2CrCl3 + 3H2O, Cr2O3 + 6H+ + 9H2O → 2[Cr(H2O)6]3+.
При сплавлении со щелочами и содой даёт растворимые соли Cr3+ (в отсутствие окислителей):
Cr2O3 + 2KOH → 2KCrO2 + H2O,Cr2O3 + Na2CO3 → 2NaCrO2 + CO2↑.в щелочной среде он окисляется до хромата:Cr2O3 + 3KNO3 + 2Na2CO3 → 2Na2CrO4 + 3KNO2 + 2CO2↑.,
а сильные восстановители его восст:Cr2O3 + 2Al → Al2O3 + 2Cr.
2Cr(ОН)3+3H2SO4=Cr2(SO4)3+6Н2О так и в щелочах с образованием гидроксихромитов: Cr(OH)3+NaOH=Na3[Cr(OH)6].При сплавлении Cr(ОН)3 с щелочами образуются метахромиты и ортохромиты:Cr(ОН)3+NaOH=NaCrO2+2Н2O Cr(ОН)3+3NaOH=Na3CrO3+3Н2О.При прокаливании гидроксида хрома (III) образуется оксид хрома (III):2Cr(ОН)3=Cr2O3+3Н2O.
2.Взаимод-е мет. с H2SO4:
H2SO4(разб): с мет. до Н: Н2↑, после Н –не реаг;
H2SO4(конц): с мет до Zn: H2S,S, после Zn:SO2↑ (с Au,Pt не реаг);
Пассивация Al и Fe в холодн H2SO4(конц); Ag+H2SO4(конц)=AgSO4+SO2↑+2H2O; 4Zn+5H2SO4(конц)=H2S↑+4ZnSO4+4H2O; Al+H2SO4(разб)=H2↑+Al2(SO4)3; 2FeO+4H2SO4(к)=Fe2(SO4)3+SO2+4H2O; Al+H2SO4(K)=Al2(SO4)3+H2S↑+H2O.
3.Химические свойства кислорода.
Сильный окислитель, взаимодействует практич. со всеми элементами, образуя оксиды. Ст.ок. −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры. Пр. р-ий, протекающих при комн.тем-ре: 4Li+O2=2Li2O.
Окисляет соед.,котор.содержат эл-ы с не макс. ст.ок.: 2NO+O2=2NO2.
Окисляет больш-во орг-х соед-й: CH3CH2OH+3O2=2CO2+3H2O.
Pеагирует непосредственно со всеми простыми веществами, кроме Au и инертных газов (He, Ne, Ar, Kr, Xe, Rn);пероксиды получаются при сгорании щел.мет. в кислороде:2Na+O2→Na2O2.
Некот. оксиды поглощают кислород:2BaO+O2=2BaO2.
При охл-ии пламени горящ. водорода льдом,образ.перекись водорода: H2+O2=H2O2
K, Rb и Cs реа-т с кислородом с образованием надпероксидов:K+O2=KO2
4.Бромирование и гидрирование алкенов и алкинов.
Схема реакции бромирования алкена: CnH2n + Br2 = CnH2nBr2
CH2=/ CH2(этен)+Br2→(CCl4) CH2(|Br)-CH2(|Br) (1,2-дибромэтан);
CH3C≡CH→(Br2,CCl4)CH2C(|Br)=CH(|Br)→(Br,CCl4)CH3-C(вниз и вверх Br)-C(вниз и вверх Br)-H 1,1,2,2-тетрабромпропан
Гидрирование: алкенов:R-CH=CH-R+H2→(Ni,t)R-CH2-CH2-R; алкинов:R-C≡C-R+H2→(Ni,t)R-CH2-CH2-R
Н2С=СН2 + H2 → Н3С—СН3; этилен этан
2HC≡CH+2H2→CH3-C(CH3)=CH2(ацетилен→изобутилен)
1.Поведение дихромата калия с восстановителями в различных средах.K2Cr2(+6)O7+3Na2SO3+4H2SO4=Cr2(+3)(SO4)3+3Na2SO4+K2SO4+4H2O-в кисл.среде K2Cr2o7 восст.до Cr2(so4)3 и K2SO4, SO3 окисл.до SO4.
2Pb(NO3)2 + K2Cr2O7 + H2O = 2PbCrO4↓ + 2KNO3 + 2HNO3; K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
14
2.Взаимодействие мет.с HNO3:
HNO3(к)+актив.Ме=N2O;
HNO3(к)+малоактив.Ме=NO2;
HNO3(к)+Fe,Al,Cr=пассивация Ме.
HNO3(p)+актив.Ме=NH4,NO3,N2;
HNO3(p)+малоактив.Ме=NO.
Пр: Cu+4HNO3(K)=Cu(NO3)2+2NO2↑+2H2O;
3Cu+8HNO3(P)=3Cu(NO3)2+2NO↑+4H20;
5Zn+12HNO3(P)=5Zn(NO3)2+N2O↑+6H2O;
Al+HNO3(K)=(t)Al(NO3)3+N2O↑+H2O;
Al+HNO3(P)=Al(NO3)2+N2↑+H2O;
Al+HNO3(оч.pазб)=Al(NO3)3+NH4NO3+H2O.
3.Химич.св-ва водорода.
Водород используется для восстановления многих металлов, так как отнимает кислород у их оксидов:CuO + H2 = Cu + H2O,Fe3O4 + 4H2 = 3Fe + 4Н2О; С галогенами Водород образует галогеноводороды, например:Н2 + Cl2 = 2НСl; с фтором взрывается (даже в темноте и при - 252°С), с хлором и бромом реаг. лишь при освещении или нагревании, а с I только при нагревании. С N Водород взаимодействует с образованием аммиака:ЗН2 + N2 = 2NН3;
Нагреван:Н2 + S = H2S (сероводород); 2Н2 + С (аморфный) = СН4 (метан); реагирует с некот.мет. (щелочными, щелочноземельными и др), образуя гидриды:Н2 + 2Li = 2LiH; реакции Н с оксидом углерода (II), при которых образуются в зависимости от температуры, давления и катализатора различные органические соединения, например НСНО, СН3ОН и другие. Ненасыщ.углеводороды реагируют с Водородом, переходя в насыщенные, например:СnН2n + Н2 = СnН2n+2.
4.Сопряженные диены. Присоединение брома к 1,3-бутадиену(дивинил).
CH2=CH-CH=CH2
Химич.Св серы и физические
Т.к. сера имеет промежуточную степень окисления, в х.р. она либо ок-ль, либо восст-ль.
S (ок) + H2 (200C)=H2S
+ C(графит)(800С)=CS2
Me(кроме Au,Pt) c щел. И щел-зем при комн t
+2Al=Al2S3
(во всех этих реакциях S0-2e=S-2)
S(восст) + O2=SO2(сернистый газ)
+ 3F2=SF6
+2H2SO4(кон,t) =3SO2+H2O
+6HNO3(kon,t)=H2SO4+2H2O+6NO2
3S+щелочь(диспропорц)6NaOH=(t)2Na2S+Na2SO3+3H2O
Сера представляет собой твердое хрупкое вещество желтого цвета, в воде практически нерастворима, не смачивается водой и плавает на её поверхности. Хорошо растворяется в сероуглероде и других органических растворителях, плохо проводит тепло и электрический ток. При плавлении сера образует легкоподвижную жидкость желтого цвета, которая при 160°С темнеет, её вязкость повышается, и при 200 °С сера становится темно-коричневой и вязкой, как смола. Это объясняется разрушением кольцевых молекул и образованием полимерных цепей. Дальнейшее нагревание ведет к разрыву цепей, и жидкая сера снова становится более подвижной. Пары серы имеют цвет от оранжево-желтого до соломенно-желтого цвета. Пар состоит из молекул состава S8, S6, S4, S2. При температуре выше 1500 °С молекула S2 диссоциирует на атомы.
15
Хим Св. Оксида алюминия(амф оксид)
Al2O3+HCl=AlCl3+H2O(азотная и серн.К.не растворяет Al2O3)
Al2O3+NaOH=(cпл)NaAlO2
Al2O3 =(р-р)Na3[Al(OH)6]
Al2O3+Na2CO3=(спл)NaAlO2+CO2↑
Получение соды методом Сольве NaCl(нас. р-р)+ СO2+NH3+H2O=NaHCO3↓ +NH4Cl (гидрокарб.амм.выкристализ-ся) 2NaHCO3=(t)Na2CO3+CO2↑+H2O Реакции электрофильного присоединения, Правило Морковникова.
CH2±CH-CH3+HBr=CH3CHCH3 (2-бромпропан) | Br (атом Н присоед-ся к атому С , с наиб-им числом атомов Н, при двойной связи) + механизм детально
CH2=CH-CH3→(медл) (лимитирующая стадия им.она опр=ет скор реакц.)
↓
H
|
Br
СH3-CH-CH3→(быстр,Br-)
CH3-CH-CH3
|
Br
Белый Фосфор.(желтый)
Образуется при быстром охлаждении паров Р, белое с кристальным оттенком вещ-во.tпл=44.кип=257, имеет чесночный запах, мягче чем воск, его хранят в воде в темноте, хорошо растворяется в сероуглероде, ядовитое при t=40гр самовоспламеняется, при попадании брызг получаются ожоги. кристаллическая решетка Р4 очень напряжена эта структура обуславливает низ tпл, высокую летучесть и выс. Хим. Активность.
Промышленное получение простого суперфосфата. Ca3(PO4)2изб.+2H2SO4=Ca(H2PO4)2+2CaSO4
16
Физ и хим св Fe Твердый,серебристо-белый, тугоплавкий Ме tпл=1535, кип=2750, плотность=7,87г/см3
Железо может существовать в виде двух кристаллических решеток: α- и γ-объемноцентрированной кубической (ОЦК) и гранецентрированной кубической (ГЦК). Ниже 910°С устойчиво α-Fe с ОЦК-решеткой (а = 2,86645Å при 20 °С). Между 910 °С и 1400°С устойчива γ-модификация с ГЦК-решеткой (а = 3,64Å). Выше 1400°С вновь образуется ОЦК-решетка δ-Fe (a = 2,94Å), устойчивая до температуры плавления (1539 °С). α-Fe ферромагнитно вплоть до 769 °С (точка Кюри). Модификации γ-Fe и δ-Fe парамагнитны.
Физические свойства Железа зависят от его чистоты. В промышленных железных материалах Железу, как правило, сопутствуют примеси углерода, азота, кислорода, водорода, серы, фосфора. Даже при очень малых концентрациях эти примеси сильно изменяют свойства металла. Так, сера вызывает так называемых красноломкость, фосфор (даже 10-2% Р) - хладноломкость; углерод и азот уменьшают пластичность, а водород увеличивает хрупкость Железа (т. н. водородная хрупкость). Снижение содержания примесей до 10-7 - 10-9% приводит к существенным изменениям свойств металла, в частности к повышению пластичности.
