
- •Химические свойства гидроксида цинка.
- •Химические свойства кетонов
- •1 Реакции присоединения
- •3 Реакция полимеризации
- •Химические свойства
- •Получение
- •Физические свойства
- •Общие химические свойства
- •Состав, структура жиров
- •Химические свойства
- •Физические свойства
- •Получение
- •Получение
- •Получение оксида азота (IV)
- •Физические свойства меди
- •Химические свойства хлора
- •Се́рная кислота́
- •Получение
- •Получение фосфорной кислоты
- •Химические свойства алканов
- •Механизм реакции
- •Физические свойства железа
- •Химические свойства железа
- •Реакции окисления спиртов
- •Химические свойства оксида марганца
- •Химические свойства спиртов.
- •Химические свойства оксида хрома (III)
- •Физические свойства алюминия
- •Химические свойства алюминия
- •Гидратация
- •Гидратация
- •Механизм реакции
- •Ограничения
- •Применение
Получение фосфорной кислоты
При взаимодействии высшего оксида фосфора с водой на холоде получается метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу. При разбавлении её водой образуется ортофосфорная кислота H3PO4:
![]()
При нагревании до 200—250 °C ортофосфорная кислота обезвоживается, и образуется пирофосфорная кислота H4P2O7, в результате дальнейшей дегидратации которой при 400—500 °C вновь образуется метафосфорная кислота:
![]()
Из всех фосфорных кислот наибольшее практическое значение имеет ортофосфорная кислота[1] (которую часто называют просто фосфорная[2]). Для её получения используют реакции обмена фосфатов с сильными кислотами или окисление белого фосфора азотной кислотой:
![]()
![]()
Химические свойства бензола
Взаимодействие с хлором в присутствии катализатора:
С6H6 + Cl2 -(FeCl3)→ С6H5Cl + HCl образуется хлорбензол
Катализаторы содействуют созданию активной электрофильной частицы путём поляризации между атомами галогена.
Cl-Cl + FeCl3 → Clઠ-[FeCl4]ઠ+
С6H6 + Clઠ--Clઠ+ + FeCl3 → [С6H5Cl + FeCl4] → С6H5Cl + FeCl3 + HCl
В отсутствие катализатора при нагревании или освещении идёт радикальная реакция замещения.
С6H6 + 3Cl2 -(освещение)→ C6H6Cl6 образуется смесь изомеров гексахлорциклогексана видео
Взаимодействие с бромом (чистый):
С6H6 + Br2 -(FeBr3 или AlCl3)→ С6H5Br + HBr образуется бромбензол видео
Взаимодействие с галогенопроизводными алканов (алкилирование бензола, реакция Фриделя-Крафтса):
С6H6 + С2H5Cl -(AlCl3)→ С6H5С2H5 + HCl образуется этилбензол
С6H6 + HNO3 -(H2SO4)→ С6H5NO2 + H2O
Химические свойства алканов
Галогенирование алканов проходит поэтапно — за один этап замещается не более одного атома водорода:
CH4 + Cl2 → CH3Cl + HCl (хлорметан)
CH3Cl + Cl2 → CH2Cl2 + HCl (дихлорметан)
CH2Cl2 + Cl2 → CHCl3 + HCl (трихлорметан)
CHCl3 + Cl2 → CCl4 + HCl (тетрахлорметан).
Горение CH4 + 2O2 → CO2 + 2H2O + Q
Нитрование RH + HNO3 → RNO2 + H2O.
В общем виде реакцию горения алканов можно записать следующим образом:
СnН2n+2 +(1,5n+0,5)O2 → nCO2 + (n+1)H2O.
Могут образовываться спирты, альдегиды, карбоновые кислоты.
При мягком окислении СН4 в присутствии катализатора кислородом при 200 °C) могут образоваться:
метиловый спирт: 2СН4 + О2 → 2СН3ОН;
формальдегид: СН4 + О2 → СН2О + Н2O;
муравьиная кислота: 2СН4 + 3О2 → 2НСООН + 2Н2O.
Дегидрирование
Образование:
1)В углеродном скелете 2 (этан) или 3 (пропан) атома углерода — получение (терминальных) алкенов, так как других в данном случае не может получиться; выделение водорода:
Условия протекания: 400—600 °C, катализаторы — Pt, Ni, Al2O3, Cr2O3.
а)CH3-CH3 → CH2=CH2 + H2 (этан → этен);
б)CH3-CH2-CH3 → CH2=CH-CH3 + H2 (пропан → пропен).
2)В углеродном скелете 4 (бутан, изобутан) или 5 (пентан, 2-метилбутан, неопентан) атомов углерода — получение алкадиенов; выделение водорода:
в)CH3-CH2-CH2-CH3 → CH2=CH-CH=CH2 + 2H2 (бутан → бутадиен-1,3).
в')CH3-CH2-CH2-CH3 → CH2=C=CH-CH3 + 2H2 (бутан → бутадиен-1,2) (ЭТО — ОДНА РЕАКЦИЯ!)
3) В углеродном скелете 6 (гексан) и более атомов углерода — получение бензола и его производных:
г) CH3-CH2-CH2-CH2CH2-CH2-CH2-CH3 (октан) → П.-ксилол, параллельно М.-ксилол, параллельно этилбензол + 3H2.
Конверсия метана
В присутствии никелевого катализатора протекает реакция:
CH4 + H2O → CO + H2.
Продукт этой реакции (смесь CO и H2) называется «синтез-газом».
Химические свойства оксида железа II
С соляной и разбавленной серной кислотами железо реагирует с образованием солей железа:
Fe + 2HCl → FeCl2 + H2↑;
Fe + H2SO4 → FeSO4 + H2↑.
При взаимодействии железа с приблизительно 70%-й серной кислотой реакция протекает с образованием сульфата железа:
2Fe + 6H2SO4 → Fe23 + 3SO2↑ + 6H2O.
Оксид железа реагирует с кислотами:
2Fe3 + 3H2SO4 → Fe23 + 6H2O.
Гидроксид железа Fe3 проявляет слабо амфотерные свойства, он способен реагировать только с концентрированными растворами щелочей:
Fe3 + 3КОН → K3.
Соединения железа в растворах восстанавливаются металлическим железом:
Fe + 2FeCl3 → 3FeCl2.
При хранении водных растворов солей железа наблюдается окисление железа до железа:
При взаимодействии ионов Fe и выпадает ярко-синий осадок берлинской лазури:
4K4 + 4Fe → 4KFe↓ + 12K.
Реактивом на ионы Fe в растворе может служить гексацианоферрат калия K3. При взаимодействии ионов Fe и выпадает осадок турнбулевой сини:
3K3 + 3Fe → 3KFe↓ + 6K.
Интересно, что берлинская лазурь и турнбулева синь — две формы одного и того же вещества, так как в растворе устанавливается равновесие:
KFe ↔ KFe.
Физические свойства кислорода
Твёрдый кислород (температура плавления −218,79 °C) — синие кристаллы. Известны шесть кристаллических фаз, из которых три существуют при давлении в 1 атм.:
α-О2 — существует при температуре ниже 23,65 К; ярко-синие кристаллы относятся к моноклинной сингонии, параметры ячейки a=5,403 Å, b=3,429 Å, c=5,086 Å; β=132,53°[4].
β-О2 — существует в интервале температур от 23,65 до 43,65 К; бледно-синие кристаллы (при повышении давления цвет переходит в розовый) имеют ромбоэдрическую решётку, параметры ячейки a=4,21 Å, α=46,25°[4].
γ-О2 — существует при температурах от 43,65 до 54,21 К; бледно-синие кристаллы имеют кубическую симметрию, период решётки a=6,83 Å[4].
Ещё три фазы образуются при высоких давлениях:
δ-О2 интервал температур 20-240 К и давление 6-8 ГПа, оранжевые кристаллы;
ε-О2 давление от 10 и до 96 ГПа, цвет кристаллов от тёмно-красного до чёрного, моноклинная сингония;
ζ-О2 давление более 96 ГПа, металлическое состояние с характерным металлическим блеском, при низких температурах переходит в сверхпроводящее состояние.
Химические свойства кислорода
Так, при нагревании кислород взаимодействует с водородом, серой, углеродом, фосфором, образуя воду и оксиды: 2Н2 + О2 = 2Н2О С + O2 = СO2 S + O2 = SO2 4Р + 5О2 = 2Р2О5 С галогенами кислород в реакцию не вступает. Очень активно взаимодействуют с кислородом щелочные и щелочноземельные металлы с образованием оксидов и пероксидов: 4К + О2 = 2К2О ( KO2) Ba + O2 = BaO2 С остальными металлами кислород реагирует при нагревании, выделяя большое количество теплоты и света: 2Mg + O2 = 2MgO Некоторые металлы в обычных условиях окисляются лишь с поверхности, так как образующаяся пленка оксида защищает металл. При повышении температуры окисление ускоряется. Например, в нормальных условиях железо окисляется довольно медленно, а при температуре красного каления ( ~400°C) железные стружки сгорают в кислороде: 3Fe + 2O2 = Fe3O4 В кислороде горят также сложные вещества с образованием соответствующих оксидов: CH4 + 2O2 = CO2 + 2H2O
Способы устранения временной и постоянной жёсткости воды
При кипячении воды гидрокарбонаты разлагаются с образованием осадка среднего или основного карбоната: Ca(HCO3)2 = СаСО3 ↓+ СО2↑+ Н2О, Mg(HCO3)2 = Мg2 (ОН) 2 СО3↓ +3СО2↑ + Н2О, и жёсткость воды снижается.
временную (карбонатную) жёсткость можно устранить добавлением гашеной извести: Са2+ +2НСО-3 + Са2+ + 2ОН- = 2СаСО3↓+ 2Н2О Mg2+ +2НСО-3 + Са2+ + 4ОН- = Mg(ОН) 2↓+2СаСО3↓+ 2Н2О.
При одновременном добавление извести и соды можно избавиться от карбонатной и некарбонатной жёсткости (известково-содовый способ). Карбонатная жёсткость при этом устраняется известью (см. выше), а некарбонатная – содой: Са2+ + СО2-3 = СаСО3↓ Mg2+ + СО2-3 = Mg СО3 и далее Mg СО3 + Са2+ + 2ОН- = Mg(ОН) 2↓+СаСО3↓
Структурная изомерия
Структурная изомерия — результат различий в химическом строении. К этому типу относят:
Изомерия углеводородной цепи (углеродного скелета)
Изомерия углеродного скелета, обусловленная различным порядком связи атомов углерода. Простейший пример — бутан СН3—СН2—СН2—СН3 и изобутан (СН3)3СН. Другие примеры: антрацен и фенантрен (формулы I и II, соответственно), циклобутан и метилциклопропан (III и IV).
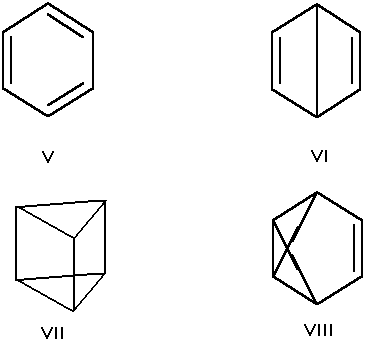
Валентная изомерия
Валентная изомерия — особый вид структурной изомерии, при которой изомеры можно перевести друг в друга лишь за счёт перераспределения связей. Например, валентными изомерами бензола (V) являются бицикло[2.2.0]гекса-2,5-диен (VI, «бензол Дьюара»), призман (VII, «бензал Ладенбурга»), бензвален (VIII)
Изомерия функциональной группы
Различается характером функциональной группы; например, этанол (CH3—CH2—OH) и диметиловый эфир (CH3—O—CH3).
Изомерия положения
Тип структурной изомерии, характеризующийся различием положения одинаковых функциональных групп или кратных связей при одинаковом углеродном скелете. Пример: 2-хлорбутановая кислота и 4-хлорбутановая кислота.

геометрическая изомерия
π—диастереомерия
π-диастереомеры, называемые также геометрическими изомерами, отличаются друг от друга различным пространственным расположением заместителей относительно плоскости двойной связи (чаще всего С=С и С=N) или цикла. К ним относятся, например, малеиновая и фумаровая кислоты (формулы XIV и XV соответственно), (Е)- и (Z)-бензальдоксимы (XVI и XVII), цис- и транс-1,2-диметилциклопентаны (XVIII и XIX).

Химические свойства оксида хрома(III)
Относится к группе амфотерных оксидов. В высокодисперсном состоянии растворяется в сильных кислотах с образованием солей хрома(III):
Cr2O3 + 6HCl → 2CrCl3 + 3H2O,
Cr2O3 + 6H+ + 9H2O → 2[Cr(H2O)6]3+.
При сплавлении со щелочами и содой даёт растворимые соли Cr3+ (в отсутствие окислителей):
Cr2O3 + 2KOH → 2KCrO2 + H2O,
Cr2O3 + Na2CO3 → 2NaCrO2 + CO2↑.
Поскольку Cr2O3 — соединение хрома в промежуточной степени окисления, в присутствии сильного окислителя в щелочной среде он окисляется до хромата:
Cr2O3 + 3KNO3 + 2Na2CO3 → 2Na2CrO4 + 3KNO2 + 2CO2↑.,
а сильные восстановители его восстанавливают:
Cr2O3 + 2Al → Al2O3 + 2Cr.
Химические свойства гидроксида хрома (III)
Относится к группе амфотерных оксидов. В высокодисперсном состоянии растворяется в сильных кислотах с образованием солей хрома(III): Cr2O3 + 6HCl → 2CrCl3 + 3H2O, Cr2O3 + 6H+ + 9H2O → 2[Cr(H2O)6]3+. При сплавлении со щелочами и содой даёт растворимые соли Cr3+ (в отсутствие окислителей): Cr2O3 + 2KOH → 2KCrO2 + H2O, Cr2O3 + Na2CO3 → 2NaCrO2 + CO2↑. Поскольку Cr2O3 — соединение хрома в промежуточной степени окисления, в присутствии сильного окислителя в щелочной среде он окисляется до хромата: Cr2O3 + 3KNO3 + 2Na2CO3 → 2Na2CrO4 + 3KNO2 + 2CO2↑., а сильные восстановители его восстанавливают: Cr2O3 + 2Al → Al2O3 + 2Cr.
Химические свойства ВОДОРОДА
Поэтому при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция:
Ca + Н2 = СаН2
и с единственным неметаллом — фтором, образуя фтороводород:
F2 + H2 = 2HF
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии
О2 + 2Н2 = 2Н2О
Он может «отнимать» кислород от некоторых оксидов, например:
CuO + Н2 = Cu + Н2O
Записанное уравнение отражает восстановительные свойства водорода.
N2 + 3H2 → 2NH3
С галогенами образует галогеноводороды:
F2 + H2 → 2HF, реакция протекает со взрывом в темноте и при любой температуре,
Cl2 + H2 → 2HCl, реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании:
C + 2H2 → CH4
Взаимодействие со щелочными и щёлочноземельными металлами
При взаимодействии с активными металлами водород образует гидриды:
2Na + H2 → 2NaH
Ca + H2 → CaH2
Mg + H2 → MgH2
Гидриды — солеобразные, твёрдые вещества, легко гидролизуются:
CaH2 + 2H2O → Ca(OH)2 + 2H2↑
Взаимодействие с оксидами металлов (как правило, d-элементов)
Оксиды восстанавливаются до металлов:
CuO + H2 → Cu + H2O
Fe2O3 + 3H2 → 2Fe + 3H2O
WO3 + 3H2 → W + 3H2O
Гидрирование органических соединений
Молекулярный водород широко применяется в органическом синтезе для восстановления органических соединений. Эти процессы называют реакциями гидрирования. Эти реакции проводят в присутствии катализатора при повышенных давлении и температуре. Катализатор может быть как гомогенным (напр. Катализатор Уилкинсона), так и гетерогенным (напр. никель Ренея, палладий на угле).
Производство азотной кислоты
Современный способ её производства основан на каталитическом окислении синтетического аммиака на платино-родиевых катализаторах (процесс Оствальда) до смеси оксидов азота (нитрозных газов), с дальнейшим поглощением их водой
4NH3 + 5O2 (Pt) → 4NO + 6H2O
2NO + O2 → 2NO2
4NO2 + O2 + 2H2O → 4HNO3.
Концентрация полученной таким методом азотной кислоты колеблется в зависимости от технологического оформления процесса от 45 до 58 %. Впервые азотную кислоту получили алхимики, нагревая смесь селитры и железного купороса:
4KNO3 + 2(FeSO4 · 7H2O) (t°) → Fe2O3 + 2K2SO4 + 2HNO3↑ + NO2↑ + 13H2O
Чистую азотную кислоту получил впервые Иоганн Рудольф Глаубер, действуя на селитру концентрированной серной кислотой:
KNO3 + H2SO4(конц.) (t°) → KHSO4 + HNO3↑
Дальнейшей дистилляцией может быть получена т. н. «дымящая азотная кислота», практически не содержащая воды.
Химические свойства. ГИДРОКСИДА Алюминий — очень активный металл. В ряду напряжений он стоит после щелочных и щелочноземельных металлов. Однако на воздухе он довольно устойчив, так как его поверхность покрывается очень плотной пленкой оксида, предохраняющей металл от контакта с воздухом. Если с алюминиевой проволоки снять защитную оксидную пленку, то алюминий начнет энергично взаимодействовать с кислородом и водяными парами воздуха, превращаясь в рыхлую массу — гидроксид алюминия:
4 Аl + 3 O2 + 6 Н2О = 4 Аl(ОН)3
Эта реакция сопровождается выделением теплоты.
Очищенный от защитной оксидной пленки алюминий взаимодействует с водой с выделением водорода:
2 Аl + 6 Н2О = 2 Аl(ОН)3 + 3 Н2
Алюминий хорошо растворяется в разбавленных серной и соляной кислотах:
2 Аl + 6 НСl = 2 AlСl3 + 3 Н2
2 Аl + 3 Н2SO4 = Аl2(SO4)3 +3 Н2
Разбавленная азотная кислота на холоду пассивирует алюминий, но при нагревании алюминий растворяется в ней с выделением монооксида азота, гемиоксида азота, свободного азота или аммиака, например:
8 Аl + 30 НNО3 = 8 Аl(NО3)3 + 3 N2О + 15 Н2О
Концентрированная азотная кислота пассивирует алюминий.
Так как оксид и гидроксид алюминия обладают амфотерными
свойствами, алюминий легко растворяется в водных растворах всех щелочей, кроме гидроксида аммония:
2 Аl + 6 КОН + 6 Н2О = 2 К3[Аl(ОН)6] + 3 Н2
Порошкообразный алюминий легко взаимодействует с галогенами, кислородом и всеми неметаллами. Для начала реакций необходимо нагревание, затем они протекают очень интенсивно и сопровождаются выделением большого количества теплоты:
2 Аl + 3 Вr2 = 2 АlВr3 (бромид алюминия)
4 Аl + 3 O2 = 2 Аl2O3 (оксид алюминия)
2 Аl + 3 S = Аl2S3 (сульфид алюминия)
2 Аl + N2 = 2 АlN (нитрид алюминия)
4 Аl + 3 С = Аl4С3 (карбид алюминия)
Сульфид алюминия может существовать только в твердом виде. В водных растворах он подвергается полному гидролизу с образованием гидроксида алюминия и сероводорода:
Аl2S3 + 6 Н2О = 2 Аl(ОН)3 + 3 Н2S
Алюминий легко отнимает кислород и галогены у оксидов и солей других металлов. Реакция сопровождается выделением большого количества теплоты:
8 Al + 3 Fе3О4 = 9 Fе + 4 Аl2O3
Этерификация (от др.-греч. αἰθήρ — эфир и лат. facio — делаю) — реакция образования сложных эфиров при взаимодействии кислот и спиртов:
RCOOH + R’OH ⇔ RCOOR' + Н2О
