
- •Химические свойства гидроксида цинка.
- •Химические свойства кетонов
- •1 Реакции присоединения
- •3 Реакция полимеризации
- •Химические свойства
- •Получение
- •Физические свойства
- •Общие химические свойства
- •Состав, структура жиров
- •Химические свойства
- •Физические свойства
- •Получение
- •Получение
- •Получение оксида азота (IV)
- •Физические свойства меди
- •Химические свойства хлора
- •Се́рная кислота́
- •Получение
- •Получение фосфорной кислоты
- •Химические свойства алканов
- •Механизм реакции
- •Физические свойства железа
- •Химические свойства железа
- •Реакции окисления спиртов
- •Химические свойства оксида марганца
- •Химические свойства спиртов.
- •Химические свойства оксида хрома (III)
- •Физические свойства алюминия
- •Химические свойства алюминия
- •Гидратация
- •Гидратация
- •Механизм реакции
- •Ограничения
- •Применение
ЦИНК — элемент II группы четвертого периода периодической системы элементов Д.И.Менделеева. В соединениях проявляет степень окисления +2. Физические свойства: Цинк — голубовато-белый металл, хрупкий при комнатной температуре, а при 100-150°С поддается прокатке и вытягивается. На воздухе покрывается защитной оксидной пленкой.
Химические свойства: Цинк является довольно активным металлом. 1. Легко взаимодействует со многими неметаллами: кислородом, галогенами, серой, фосфором: 2Zn + О2 = 2ZnО (оксид цинка) Zn + Сl2 = 2ZnCl2 (хлорид цинка) Zn + S = ZnS (сульфид цинка) 3Zn + 2Р = Zn3Р2 (фосфид цинка) 2. При нагревании взаимодействует с водой и сероводородом с выделением водорода: Zn + Н2О = ZnО + Н2 Zn + Н2S = ZnS + Н2 3. Взаимодействует с щелочами: — при сплавлении с ними образуются соли цинковой кислоты — цинкаты. Zn + 2NаОН(крист.) = Nа2ZnО2 + Н2 — при взаимодействии с водным раствором щелочи образуется комплексная соль цинковой кислоты (гидроксоцинкат натрия) Zn + 2NаОН + 2Н2О = Na[Zn(ОН)4] + Н2 4. Взаимодействует с кислотами: — с серной кислотой с образованием различных веществ в зависимости от концентрации кислоты Zn + 2Н2SО4 (конц.) = ZnSО4 + SО2 + 2Н2О 3Zn + 4Н2SО4(разб.) = 3ZnSО4 + S + 4Н2О 4Zn + 5Н2SО4(сильно разб.) = 4ZnSО4 + Н2S + 4Н2O — с азотной кислотой с образованием разных веществ в зависимости от концентрации кислоты: Zn + 4НNО3 (конц.) = Zn(NO3)2 + 2NО2 + 2Н2O 4Zn + 10НNО3(разб.) = 4Zn(NО3)2 + N2О + 5Н2О 4Zn + 10НNО3(сильно разб.) = 4Zn(NО3)2 + NН4NО3 + ЗН2О
Взаимодействие металлов c серной кислотой
А. Разбавленная серная кислота. Происходит образование соли металла и выделяется водород. В качестве окислителя в разбавленной серной кислоте выступают ионы водорода:
Fe + H2SO4(разб.) = Fe SO4 + H2↑, Fe – 2e → Fe+2 - восстановитель Fe0, 2H+ + 2e → H2 - окислитель Н+. |
Б. Концентрированная серная кислота. Происходит образование соли данного металла, воды и выделяется газообразный диоксид серы SO2. В качестве окислителя выступают ионы кислотного остатка SO42– (S+6):
Cu + 2 H2SO4 = CuSO4 + H2O + SO2, Cu0 – 2e → Cu+2 - восстановитель Cu, S+6 + 2e → S+4 - окислитель S+6. |
Промышленное получение кремния
«Свободный кремний можно получить прокаливанием с магнием мелкого белого песка, который представляет собой диоксид кремния:
При этом образуется бурый порошок аморфного кремния.»[4]
В промышленности кремний технической чистоты получают, восстанавливая расплав SiO2 коксом при температуре около 1800 °C в руднотермических печах шахтного типа. Чистота полученного таким образом кремния может достигать 99,9 % (основные примеси — углерод, металлы).
Способ получения кремния в чистом виде разработан Николаем Николаевичем Бекетовым.
Промышленное получение углекислого газа
CaCO3
+ 2HCl
![]() CaCl2
+ CO2
CaCl2
+ CO2
![]() +
H2O
+
H2O
Химические свойства галогеналканов
1. Галогеналканы легко вступают в реакции замещения:
![]() Примерами
таких реакций служит превращение
галогеналканов в спирты и амины:
Примерами
таких реакций служит превращение
галогеналканов в спирты и амины:
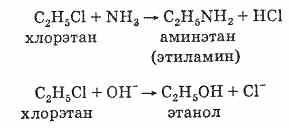 2.
Галогеналканы также легко вступают в
реакции отщепления. При этом образуются
галогеноводород и алкен.
(СН3)2C-СН2+Н2O+Сl-RCH=CH2+Н2O+Г-
— отщепление (СН3)3ССl+ОН-RCH2CH2OH+Г-
— замещение RСН2СН2Г+ОН-RСН2СН2Г+ОН-
3.
При добавлении раствора галогеналкана
в диэтиловом эфире СН3СН2ОСН2СН3 к
магниевой стружке происходит
экзотермическая реакция: магний
переходит в раствор и образуется реактив
Гриньяра формулы R—Mg—Г, где R — алкильная
или арильная группа, а Г — галоген.
эфир
R-Mg-ГRГ+Mg
2.
Галогеналканы также легко вступают в
реакции отщепления. При этом образуются
галогеноводород и алкен.
(СН3)2C-СН2+Н2O+Сl-RCH=CH2+Н2O+Г-
— отщепление (СН3)3ССl+ОН-RCH2CH2OH+Г-
— замещение RСН2СН2Г+ОН-RСН2СН2Г+ОН-
3.
При добавлении раствора галогеналкана
в диэтиловом эфире СН3СН2ОСН2СН3 к
магниевой стружке происходит
экзотермическая реакция: магний
переходит в раствор и образуется реактив
Гриньяра формулы R—Mg—Г, где R — алкильная
или арильная группа, а Г — галоген.
эфир
R-Mg-ГRГ+Mg

Химические свойства гидроксида цинка.
Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации):
![]()
![]()
Взаимодействие с кислотными оксидами:
![]()
Взаимодействие с избытком аммиака:
![]() ;
;
Взаимодействие со щелочами с образованием соли и воды :
![]() ;
;
Термическое разложение :
![]() ;
;
Взаимодействие неметаллов с серной кислотой
Концентрированная серная кислота может окислять неметаллы, например: S + 2H2SO4 = 3SO2 + 2H2O Окислительные свойства концентрированной серной кислоты могут также проявлятся с некоторыми сложными веществами – восстановителями, например: 2KBr + 2H2SO4 = Br2 + SO2 + K2SO4 + 2H2O
Промышленное получение оконного стекла
Na2CO3+CaCO3+6SiO2=Na2O*CaO*6SiO2+2CO2(выделение) при t=1500
Химические свойства кетонов
Взаимодействие со спиртами:
CH3COCH3 + 2C2H5OH → C2H5—O—C(CH3)2—O—C2H5 + H2O
c реактивами Гриньяра:
C2H5—C(O)—C2H5 + C2H5MgI → (C2H5)3—COMgI → (C2H5)3—COH,
Также кетоны реагируют с азотистыми основаниями, например, с аммиаком и первичными аминами с образованием иминов:
CH3—C(O)—CH3 + CH3NH2 → CH3—C(N—CH3)—CH3 + H2O
Химические свойства альдегидов
Высокая реакционноспособность связана с наличием высокополярной связи С=О. Проявляют свойства органических оснований.
1 Реакции присоединения
Восстановление. Альдегиды способны к восстановлению, основной продукт восстановления — первичные спирты.
НСНО + НН → СН3ОН
Присоединение синильной кислоты. Используется для удлинения углеродной цепи.
R—CHO + HCN → R-CH(OH)-CN
Присоединение гидросульфита натрия. Используется для выделения альдегидов из растворов.
R—CHO + NaHSO3 → R-CH(OH)-SO3Na
Присоединение спиртов с образованием полуацеталей (при избытке спирта и хлороводороде образуются ацетали)
2 Окисление. Альдегиды легко (значительно легче, чем спирты) окисляются в соответствующие карбоновые кислоты.
Реакция «серебряного зеркала». Альдегид + Ag2O (в аммиачном растворе) = Кислота + 2Ag. Тонкий слой осадка металлического серебра образует зеркальную поверхность (таким способом раньше получали зеркала)
СН3СНО + Ag2O--NH4OH,t--> CH3COOH + 2Ag↓
Реакция «медного зеркала». Окислителем здесь выступает свежеприготовленный (СuSO4+2NaOH→...) Cu(OH)2, гидроксид меди(II). Образуется кирпично-красный осадок оксида Cu(I)
R—CHO + 2Cu(OH)2 → R—COOH + Cu2O↓ + 2H2O
3 Реакция полимеризации
Линейная полимеризация образование параформальдегида (n=8-100) происходит при длительном стоянии или испарении формальдегида
nHCHO → [CH2O]n
образование полиформальдегида
nHCHO --Fe(CO)5--> [CH2O]n
Циклическая полимеризация Перегонка подкисленного альдегида c образованием триоксана (правильно записать в виде шестиугольника)
3HCHO ---t,H+-->-СН2-О-СН2-О-СН2-О-
3 Реакция поликонденсации При нагревании (с Н+ или ОН-) альдегида с фенолом образуются фенолформальдегидные смолы
Химические свойства железа
Железо — активный металл. 1. На воздухе образуется защитная оксидная пленка, препятствующая ржавению металла. 3Fe + 2O2 = Fe2O3 • FeO (Феррит железа) 2. Во влажном воздухе железо окисляется и покрывается ржавчиной, которая частично состоит из гидратированного оксида железа (III). 4Fe + 3О2 + 6Н2О = 4Fe(ОН)3 3. Взаимодействует с хлором, углеродом и другими неметаллами при нагревании: 2Fe + 3Cl2 = 2FeCl3 4.Железо вытесняет из растворов солей металлы, находящиеся в электрохимическом ряду напряжений правее железа: Fe + CuSO4 = FeSO4 + Cu 5. Растворяется в разбавленных серной и соляной кислотах c выделением водорода: Fe + 2Cl = FeCl2 + H2
Взаимодействие неметаллов с азотной кислотой
Азотная кислота окисляет неметаллы, при этом азот обычно восстанавливается до NO или NO2:
![]()
![]()
![]()
![]()
и сложные вещества, например:
![]()
Графит
Графит (от др.-греч. γράφω — пишу) — минерал из класса самородных элементов, одна из аллотропных модификаций углерода. Структура слоистая. Слои кристаллической решётки могут по-разному располагаться относительно друг друга, образуя целый ряд политипов, с симметрией от гексагональной сингонии (дигексагонально-дипирамидальный), до тригональной (дитригонально-скаленоэдрический). Слои слабоволнистые, почти плоские, состоят из шестиугольных слоёв атомов углерода. Кристаллы пластинчатые, чешуйчатые. Образует листоватые и округлые радиально-лучистые агрегаты, реже — агрегаты концентрически-зонального строения. У крупнокристаллических выделений часто треугольная штриховка на плоскостях (0001).
