
- •Химические свойства гидроксида цинка.
- •Химические свойства кетонов
- •1 Реакции присоединения
- •3 Реакция полимеризации
- •Химические свойства
- •Получение
- •Физические свойства
- •Общие химические свойства
- •Состав, структура жиров
- •Химические свойства
- •Физические свойства
- •Получение
- •Получение
- •Получение оксида азота (IV)
- •Физические свойства меди
- •Химические свойства хлора
- •Се́рная кислота́
- •Получение
- •Получение фосфорной кислоты
- •Химические свойства алканов
- •Механизм реакции
- •Физические свойства железа
- •Химические свойства железа
- •Реакции окисления спиртов
- •Химические свойства оксида марганца
- •Химические свойства спиртов.
- •Химические свойства оксида хрома (III)
- •Физические свойства алюминия
- •Химические свойства алюминия
- •Гидратация
- •Гидратация
- •Механизм реакции
- •Ограничения
- •Применение
Химические свойства оксида марганца
При нагревании с кислотами проявляет окислительные свойства, например, окисляет концентрированную соляную кислоту до хлора:
4HCl + MnO2 →(t) MnCl2 + 2H2O + Cl2↑.
С серной и азотной кислотами MnO2 разлагается с выделением кислорода:
2MnO2 + 2H2SO4 → 2MnSO4 + O2 + 2H2O.
При взаимодействии с сильными окислителями диоксид марганца окисляется до соединений Mn7+ и Mn6+:
3MnO2 + KClO3 + 6KOH → 3K2MnO4 + KCl + 3H2O.
Так, при окислении сернокислого раствора соли MnSO4 перманганатом калия в присутствии серной кислоты образуется чёрный осадок соли Mn(SO4)2.
2KMnO4 + 8H2SO4 (конц.) + 3MnSO4 = 5Mn(SO4)2 + K2SO4 + 8H2O
При сплавлении с щелочами и основными оксидами MnO2 выступает в роли кислотного оксида, образуя соли манганиты:
MnO2 + CaO → CaMnO3.
Является катализатором разложения пероксида (перекиси) водорода:
2H2O2 →(катализатор) 2H2O + O2↑.
Химические свойства спиртов.
Спирты отличаются разнообразными превращениями. Реакции спиртов имеют некоторые общие закономерности: реакционная способность первичных одноатомных спиртов выше, чем вторичных, в свою очередь, вторичные спирты химически более активны, чем третичные. Для двухатомных спиртов, в том случае, когда ОН-группы находятся у соседних атомов углерода, наблюдается повышенная (в сравнении с одноатомными спиртами) реакционная способность из-за взаимного влияния этих групп. Для спиртов возможны реакции, проходящие с разрывом как С–О, так и О–Н – связей.
1. Реакции, протекающие по связи О–Н.
При взаимодействии с активными металлами (Na, K, Mg, Al) спирты проявляют свойства слабых кислот и образуют соли, называемые алкоголятами или алкоксидами:
2CH3OH + 2Na 2CH3OK + H2
Алкоголяты химически не стабильны и при действии воды гидролизуются с образованием спирта и гидроксида металла:
C2H5OК + H2O C2H5OH + КOH
Эта реакция показывает, что спирты в сравнении с водой представляют собой более слабые кислоты (сильная кислота вытесняет слабую), кроме того, при взаимодействии с растворами щелочей спирты не образуют алкоголяты. Тем не менее, в многоатомных спиртах (в том случае, когда ОН-группы присоединены к соседним атомам С) кислотность спиртовых групп намного выше, и они могут образовывать алкоголяты не только при взаимодействии с металлами, но и со щелочами:
HO–CH2–CH2–OH + 2NaOH NaO–CH2–CH2–ONa + 2H2O
Когда в многоатомных спиртах НО-группы присоединены к не соседствующим атомам С, свойства спиртов близки к одноатомным, поскольку взаимовлияние НО-групп не проявляется.
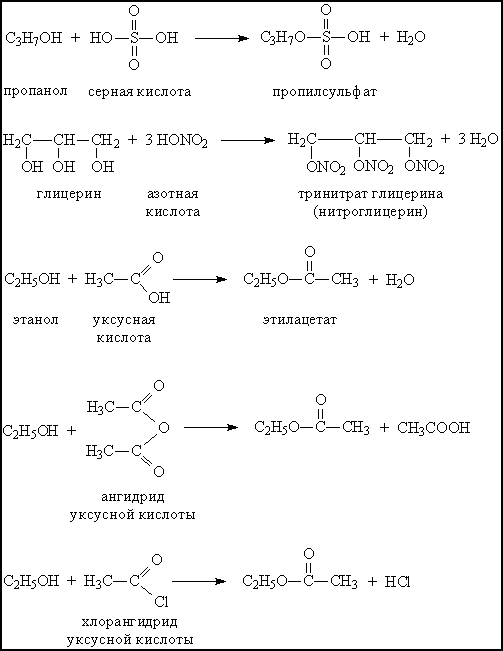
При взаимодействии с минеральными или органическими кислотами спирты образуют сложные эфиры – соединения, содержащие фрагмент R–O–A (А – остаток кислоты). Образование сложных эфиров происходит и при взаимодействии спиртов с ангидридами и хлорангидридами карбоновых кислот (рис. 6).
Химические свойства оксида хрома (III)
Относится к группе амфотерных оксидов. В высокодисперсном состоянии растворяется в сильных кислотах с образованием солей хрома(III):
Cr2O3 + 6HCl → 2CrCl3 + 3H2O,
Cr2O3 + 6H+ + 9H2O → 2[Cr(H2O)6]3+.
При сплавлении со щелочами и содой даёт растворимые соли Cr3+ (в отсутствие окислителей):
Cr2O3 + 2KOH → 2KCrO2 + H2O,
Cr2O3 + Na2CO3 → 2NaCrO2 + CO2↑.
Поскольку Cr2O3 — соединение хрома в промежуточной степени окисления, в присутствии сильного окислителя в щелочной среде он окисляется до хромата:
Cr2O3 + 3KNO3 + 2Na2CO3 → 2Na2CrO4 + 3KNO2 + 2CO2↑.,
а сильные восстановители его восстанавливают:
Cr2O3 + 2Al → Al2O3 + 2Cr.
Химические свойства гидроскида хрома (III)
Относится к группе амфотерных оксидов. В высокодисперсном состоянии растворяется в сильных кислотах с образованием солей хрома(III): Cr2O3 + 6HCl → 2CrCl3 + 3H2O, Cr2O3 + 6H+ + 9H2O → 2[Cr(H2O)6]3+. При сплавлении со щелочами и содой даёт растворимые соли Cr3+ (в отсутствие окислителей): Cr2O3 + 2KOH → 2KCrO2 + H2O, Cr2O3 + Na2CO3 → 2NaCrO2 + CO2↑. Поскольку Cr2O3 — соединение хрома в промежуточной степени окисления, в присутствии сильного окислителя в щелочной среде он окисляется до хромата: Cr2O3 + 3KNO3 + 2Na2CO3 → 2Na2CrO4 + 3KNO2 + 2CO2↑., а сильные восстановители его восстанавливают: Cr2O3 + 2Al → Al2O3 + 2Cr.
Дие́ны — органические соединения, содержащие две двойных связи углерод-углерод. В зависимости от взаимного расположения двойных связей диены подразделяются на три группы: сопряженные диены, в которых двойные связи разделены одинарной (1,3-диены), аллены с кумулированными двойными связями (1,2-диены) и диены с изолированными двойными связями, в которых двойные связи разделены несколькими одинарными. Гетероаналоги диенов, в которых один из ненасыщенных углеродных атомов замещён гетероатомом, называются гетеродиенами[1].
Обычно к диенам
относят ациклические и циклические
1,3-диены, образующие гомологические
ряды
общих формул
![]() и
и
![]() соответственно,
ациклические диены являются структурными
изомерами
алкинов.
соответственно,
ациклические диены являются структурными
изомерами
алкинов.
Химические свойства азота
Ввиду своей значительной инертности азот при обычных условиях реагирует только с литием:
6Li + N2 → 2Li3N,
при нагревании он реагирует с некоторыми другими металлами и неметаллами, также образуя нитриды:
3Mg + N2 → Mg3N2,
2B + N2 →2BN,
Наибольшее практическое значение имеет нитрид водорода (аммиак) NH3, получаемый взаимодействием водорода с азотом
Полимериза́ция
(др.-греч. πολυμερής — состоящий из многих частей) — процесс образования высокомолекулярного вещества (полимера) путём многократного присоединения молекул низкомолекулярного вещества (мономера, олигомера) к активным центрам в растущей молекуле полимера. Молекула мономера, входящая в состав полимера, образует т.наз. мономерное (структурное) звено. Элементный состав (молекулярные формулы) мономера и полимера приблизительно одинаков.
Обычно мономерами являются соединения, содержащие кратные связи, которые способны, раскрываясь, образовывать новые связи с другими молекулами, обеспечивая рост цепей.
Механизм полимеризации обычно включает в себя ряд связанных стадий:
инициирование — зарождение активных центров полимеризации;
рост (продолжение) цепи — процесс последовательного присоединения молекул мономеров к центрам;
передача цепи — переход активного центра на другую молекулу;
разветвление цепи — образование нескольких активных центров из одного;
обрыв цепи — гибель активных центров.
Полиэтиле́н
— термопластичный полимер этилена. Является органическим соединением и имеет длинные молекулы …—CH2—CH2—CH2—CH2—…, где «—» обозначает ковалентные связи между атомами углерода. Самый распространённый в мире пластик[1].
Представляет собой воскообразную массу белого цвета (тонкие листы прозрачны и бесцветны). Химически- и морозостоек, изолятор, не чувствителен к удару (амортизатор), при нагревании размягчается (80—120°С), при охлаждении застывает, адгезия (прилипание) — чрезвычайно низкая. Иногда в народном сознании отождествляется с целлофаном — похожим материалом растительного происхождения.
_____________________
((( Углерод реагирует со многими элементами. Соединения с неметаллами имеют свои собственные названия — метан, тетрафторметан.
Продукты горения углерода в кислороде являются CO и CO2 (монооксид углерода и диоксид углерода соответственно). Известен также неустойчивый недооксид углерода С3О2 (температура плавления −111 °C, температура кипения 7 °C) и некоторые другие оксиды (например C12O9, C5O2, C12O12). Графит и аморфный углерод начинают реагировать с водородом при температуре 1200 °C, с фтором при 900 °C.
Углекислый газ реагирует с водой, образуя слабую угольную кислоту — H2CO3, которая образует соли — карбонаты. На Земле наиболее широко распространены карбонаты кальция (минеральные формы — мел, мрамор, кальцит, известняк и др.) и магния (минеральная форма доломит).
Графит с галогенами, щелочными металлами и др. веществами образует соединения включения. При пропускании электрического разряда между угольными электродами в атмосфере азота образуется циан. При высоких температурах взаимодействием углерода со смесью Н2 и N2 получают синильную кислоту:
![]()
При реакции углерода с серой получается сероуглерод CS2, известны также CS и C3S2. С большинством металлов, алюминием и кальцием углерод образует карбиды, например:
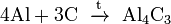 (карбид
алюминия);
(карбид
алюминия);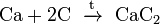 (карбид
кальция).
(карбид
кальция).
Важна в промышленности реакция углерода с водяным паром:
![]() (см.
газификация
твердых топлив).
(см.
газификация
твердых топлив).
При нагревании углерод восстанавливает оксиды металлов до металлов. Данное свойство широко используется в металлургической промышленности. )))
Физические и химические свойства щелочноземельных металлов.
Физические -
Все щёлочноземельные металлы — серые, твёрдые при комнатной температуре вещества. В отличие от щелочных металлов, они существенно более твёрдые, и ножом преимущественно не режутся (исключение — стронций). Плотность щёлочноземельных металлов с порядковым номером растёт, хотя явно рост наблюдается только начиная с кальция, который самый лёгкий из них (ρ = 1,55 г/см³), самый тяжёлый — радий, плотность которого примерно равна плотности железа.
Химические –
Щёлочноземельные металлы имеют электронную конфигурацию внешнего энергетического уровня ns², и являются s-элементами, наряду с щелочными металлами. Имея два валентных электрона, щёлочноземельные металлы легко их отдают, и во всех соединениях имеют степень окисления +2 (очень редко +1).
Химическая активность щёлочноземельных металлов растёт с ростом порядкового номера. Бериллий в компактном виде не реагирует ни с кислородом, ни с галогенами даже при температуре красного каления (до 600 °C, для реакции с кислородом и другими халькогенами нужна ещё более высокая температура, фтор — исключение). Магний защищён оксидной плёнкой при комнатной температуре и более высоких (до 650 °C) температурах и не окисляется дальше. Кальций медленно окисляется и при комнатной температуре вглубь (в присутствии водяных паров), и сгорает при небольшом нагревании в кислороде, но устойчив в сухом воздухе при комнатной температуре. Стронций, барий и радий быстро окисляются на воздухе, давая смесь оксидов и нитридов, поэтому их, так же и как щелочные металлы (и кальций) хранят под слоем керосина.
Оксиды и гидроксиды щёлочноземельных металлов имеют тенденцию к усилению основных свойств с ростом порядкового номера: Be(OH)2 — амфотерный, нерастворимый в воде гидроксид, но растворим в кислотах (а также проявляет кислотные свойства в присутствии сильных щелочей), Mg(OH)2 — слабое основание, нерастворимое в воде, Ca(OH)2 — сильное, но малорастворимое в воде основание, Sr(OH)2 — лучше растворимо в воде, чем гидроксид кальция, сильное основание (щёлочь) при высоких температурах, близких к точке кипения воды (100 °C), Ba(OH)2 — сильное основание (щёлочь), по силе не уступающее KOH или NaOH, и Ra(OH)2 — одна из сильнейших щелочей, очень коррозионное вещество.
Механизм реакции радикального замещения на примере мената
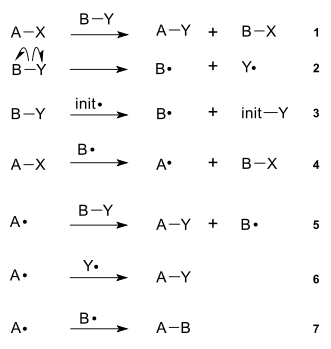
1. Первая стадия (2,3) — инициирование цепи. Она может начаться спонтанно, фотохимически, электрохимически, посредством нагревания или путем химического иницирования[1].
2. Вторая стадия (4,5) — развитие цепи. На этой стадии радикалы реагируют с молекулами, образуя продукты реакции и новые радикалы.
3. Третья стадия (6,7) — обрыв цепи или рекомбинация свободных радикалов.
Реакции радикального замещения ускоряются в условиях генерирования свободных радикалов и замедляются в присутствии веществ, улавливающих свободные радикалы.
