
- •1.1,1.2Химия и технология пр-ва полиамидных (па) волокон. Классификация па волокон, перспективы развития.
- •1) Аминокислот и их лактамов .
- •2.4 Технология и аппаратурное оформление синтеза пка
- •2.6 Непрерывные технологические процессы получения высокомолекулярного пка
- •2.11 Технологические варианты формования пка нитей и волокон
- •2.12 Технология и аппаратура для перевода пка в вязко-текучее состояние
- •2.20 Пром способ удаление низкомолекулярных соединений из поликапроамида.
- •2.21 Сушка гранулята пка
- •2.22 Конструктивные особенности прядильных машин для формования поликапроамидных текстильных нитей
- •3.3. Синтез аг-соли, химико-технологические аспекты синтеза.
- •3.9 Свойства и области применения технических и кордных нитей на основе па66.
- •3.10. Технологические схемы получения гладких и текстурированных текстильных нитей на основе ра66
- •3.11. Многониточное формование
- •3.12, 3.13 Всё про па-66 (полигексаметиленадипамид)
- •3.14 Свойства и области применения ра66 текстильных нитей
- •Методы гранулирования пэт.
- •4.1. Состояние и перспективы развития пр-тва пэф в-н и нитей.
- •4.2.Пэф нити на основе поли(этилентерефталата), поли(пропилентерефталата), поли(бутилентерефталата), поли(гидрокиалканоата).
- •4.3. Номенклатура полиэфирных волокон и нитей
- •5.0.0 Технологические особенности ориентационного вытягивания пэф комплексных нитей
- •5.25 Способы повышения адгезии полиэфирных технических нитей к резине
- •5.0 Свойства волокнообразующего пэт
- •5.3 Свойства дмт, предъявляемые требования.
- •5.4 Основные закономерности реакции пк дгт
- •5.9 Кинетическая модель и механизм процесса этерификации терефталевой кислоты этиленгликолем
- •5.10 Особенности проведения, технологические схемы и параметры получения пэтф по непрерывному способу из тфк и эг
- •5.11.Технология форм-я пэф в-н и нитей
- •Вопрос 5.13
- •5.19 Параметры процесса формования полиэфирных волокон и нитей
- •5 .20 Принципы аппаратурного оформления производства полиэфирных текстурированных нитей
- •5.26 Технологические схемы получения комплексных
- •5.27 Каблирование в производстве полиэфирных кордных нитей.
- •5.33 Способы обдува при получении штапельного волокна.
- •5.34 Отделка полиэф.Жгут.Волокна,закон-ти апп.Оформл.Ориент.Вытяжки,авиважа,термофикс.
- •5.35. Полиэфирные волокна шерстяного, хлопчатобумажного и льняного типов
- •5.36. Свойства, области применения полиэфирных штапельных волокон
- •5.37 Нетканые материалы на основе пэтф. Свойства, области применения.
- •6.5 Технологическая схема и аппаратурное оформление процесса получения полибутилентерефталатного волокна.
- •6.6 Свойства и области применения поли(бутелентерефталатных) волокон
- •6.8. Технологическая схема и аппаратурное оформление процесса формования полилактидных волокон
- •6.9 Свойства и области применения полилактидных волокон
- •7.1 Номенклатура полипропиленовых волокон и нитей
- •7.5 Особен процесса нитеобраз пп нитей poy and fdy
- •8.1 Технологическая схема процесса «спан-бонд»: подготовка полимера к переводу во вязко-текучее состояние.
- •8.4 Принциы аппаратурного оформления пр-сса «спан-бонд».
- •8.10. Cвойства и области применения нетканых материалов “спан-бонд”
- •8.1 Общие представления о строении и структуре волокнообразующих полиуретанов
- •8.2 Исходные вещества для синтеза волокнообразующих полиуретанов
- •8.3 Химические реакции при синтезе волокнооб.Полиуретанов.
- •8.9 Технологические параметры формования полиуретановых нитей по «расплавному» методу
- •8.10 Свойства и области применения полиуретановых волокон
- •2.9 Подготовка высокомолекулярного пка к формованию.
- •2.10 Технологические особенности переработки высокомоле- кулярного пка в технические нити.
- •2.17 Физико-химические закономерности ориентационной вытяжки поликапроамидных высокопрочных высокотермостойких (нмнт) кордных нитей и методы аппаратурного оформления этой стадии процесса формования
- •2.18 Современные технологические процессы производства поликапроамидных текстильных текстурированных нитей
- •2.27 Технологические схемы и параметры регенерации капролактама
- •3.1 Номенклатура полигексаметиленадипамидных нитей
- •5.7 Химия и технология получения волокнообразующего пэт при использовании в качестве исходного сырья тфк и эг.
- •5.8 Способы получения тфк.
- •Вопрос 7.2 Синтез изотактического полипропилена.
- •7.9 Свойства и области применения полипропиленовых волокон
- •8.7. Принципы формирования нетканого полотна из свежесформованных филаментов по технологии «спан-понд»
- •8.8 Способы формования полиуретановых нитей типа спандекс, эластан
- •5.39 Производство бикомпонентных полиэфирных волокон
- •2.5 Основные требования, предъявляемые к волокнообразующему пка.
- •5.3 Свойства дмт, предъявляемые требования.
- •2.7. Химизм, закономерности, параметры процесса получения высокомолекулярного пка.
- •2.8. Двухстадийный способ получения гранулята высокомолекулярного пка.
- •5.5. Технологические процессы получения пэт по периодической и непрерывной схемам на основе дмт и эг, параметры и принципы аппаратурного оформления.
- •2,25 Текстильно-технологические и физико-механические свойства поликапроамидных текстильных нитей
- •2.26Способы улавливания кл, выделяющегося в процессе нитеобразования
- •Описание технологических схем и аппаратурного оформления стадии твердофазной дополиконденсации пэт
- •5.24 Закономерности нитеобразования, ориентационного вытягивания и термофиксации при формовании полиэфирных технических нитей hmls, hmht, а также швейных ниток
- •7.8 Схема получения одноосноориентированных пленок, их фибриллирование, текстильная обработка пленочных (фибриллированных) нитей
- •8.7 Технологические схемы получения полиуретанов
5.0 Свойства волокнообразующего пэт
Интегральная схема синтеза ПЭТ выражается следующим уравнением:
n Н)О-СН2-СН2-О-СО-С6Н4-СО-(О-СН2-СН2-ОН →поликонденсация
полипереэтерификация
Н-[О-СН2-СН2-О-СО-С6Н4-СО-]n-О-СН2-СН2-ОН+(n-1)НО-СН2-СН2-ОН ЭГ←гликолиз
Реакция синтеза ПЭТ обратимый процесс, смещающийся в сторону образования полимера тем полнее, чем полнее удаляется ЭГ и чем ближе соотношение реагирующих функциональных групп к эквимольному. Введение к-л иных функциональных групп смещает равновесие в сторону исх. продукта и вызывает такие реакции деструктивного расщепления ПЭТ как алкоголиз, ацетолиз, гидролиз. Повышение т-ры ускоряет как прямую, так и обратную р-ции. Реакция проводится при увеличивающейся вязкости расплава и при т-ре близких к т-ре термической деструкции полимера Тд. В таких условиях возможно отщепление функциональных групп ДГТ и образ-ся ПЭТ с образованием целого ряда нежеланных побочных продуктов. Благодаря наличию в первичной структуре ПЭТ метиленовых групп ~СН2~ и гетерокислородного атома -О- реализуется незначительная, но какая-то определенная гибкость полимерной цепи. В целом этиленгликолевые группировки ~О-СН2-СН2-О~ придают полимеру гибкость, но вкл-е в цепь ароматических циклов придает полимеру жесткость. Это регулярно построенный линейный полужестко-цепной, труднокристаллизирующйся, но способный к кристаллизации полимер. Это и определяет технологические особенности формования и последующей переработки полиэфирных волокон.
Основные показатели качества
1. Мn=(20-40)тыс
СП=100-210, в зависимости от назначения ПЭТ с большей Мn не использ., т.к. получаются вязкие расплавы.
Мn ПЭТ оценивается, т.е. х-ся удельной вязкостью ηуд, а след-но характеристической вязкостью [η] разбавленных растворов ПЭТ в подходящих растворителях. Используется вискозиметрический метод контроля Мn. ηотн=τр-ра/τр-ля, где τ- время истечения,с.
ηуд=τр-ра-τр-ля/ τр-ля= ηотн -1
Расчет приведенной вязкости:ηпривед= ηуд/c, где с- конц. р-ра ПЭТ(обычно меньше 1г на 100 мл р-ля). Характеристическая вязкость: [η]=( ηуд/c)с→0
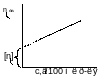
 ,
lg[η]=lgK+αlgMv
,
lg[η]=lgK+αlgMv
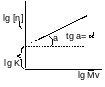
[η] имеет ед.размерности обратную концентрации, т. е. 100мл/г или IUPAC дл/г(деце 10-1). Т.о. уд. вязкость дает относительную х-ку ПЭТ. На ОАО «Могилевхимволокно» для оперирования целыми цифрами уд. вязкости увеличена в 1000 раз. Напр. в лабр-рии получ. ηуд=0,840 (ДХУ-дихлоруксусная к-та Сl2СНСООН), (о-ХТ орто-хлорфенол)
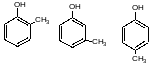
 Помимо
ДХУ и о-ХФ на др. предприятиях используется
м-крезол и трикрезол:
Помимо
ДХУ и о-ХФ на др. предприятиях используется
м-крезол и трикрезол:
По методике фирмы ДЮПОН испол-ся гексофторизопропанол (ГФиП)
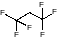 При нагревании
ПЭТ растворяется в сим-тетрохлорэтане
При нагревании
ПЭТ растворяется в сим-тетрохлорэтане
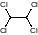 ,а также в смеси сим-тетрохлорэтана и
фенола
,а также в смеси сим-тетрохлорэтана и
фенола
 , в анилине
, в анилине
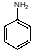 .
.
2. Температурные х-ки ПЭТ
2.1 Тпл=250-2750С, в зав-сти отМn
Тпл- это т-ра агрегатного перехода полимера из тв. в жидкое,т. е. расплав, но плавление полимера сопровождается нарушение как ближнего так и дальнего порядка во взаимном расположении макромолекул, поэтому Тпл полимеров принято наз. т-рой макроплавления.
2.2 Тс=75-900С, в зав-ти от α-степени кристалличности.
Тс- это т-ра фазового перехода полимера из аморфного в высокоэластичное состояние (ВЭС). След-но Тс-это проявление свободы сегментарного движения макромолекул. Чем больше кристалличность, упорядоченность макромолекул, тем меньше подвижность макромолекул, тем выше Тс. При введении Н2О Тс снижается, а это означает, что макромолекулы ПЭТ в присутствии Н2О приобретают сегментарную подвижность при более низкой т-ре. Это объясняется тем, что вода явл-ся структурным пластификатором ПЭТ.
2.3 Тmaх.кр.=1800С. След-но, для достижения сегментарной подвижности макромолекул не обязательно переводить полимер в жидкое (ВТС), при этом надо учитывать, что в присутствии Н2О, как структурного пластификатора, процессы кристаллизации заметно ускоряются, поэтому отдельные партии гранулята ПЭТ отлич. различным содержанием влаги. Сушка приводит к получению неоднородного полимера по степени кристалличности, а это осложняет технологическую возможность получения гомогенных расплавов.
2.4 Т-ра липкости Тл=220-2400С
При этой т-ре гранулят полимера становится липким. При транспортировке гранулята в токе горячего воздуха, Твоздуха должна быть немного ниже Тл. Иначе гранулы полимера будут прилипать к стенкам транспортирующих устройств.
3. Плотность ρ и степень кристалличности α
ρ-явл-ся важнейшей х-кой любого хим. соед-я
α-только ВМС
На формование поступает частично закристаллизованный полимер, и в зав-ти от α, плотность может изменяться в следующих пределах:
ρ =1380-1420-1430
кг/м3
=1380-1420-1430
кг/м3
Плотность является косвенной мерой выражается α.
 ,
где ρкр-плотность
закристал-го образца ПЭТ, для расчета
принимается ρкр=1448
кг/м3,
ρ- плотность анализир-го образца ПЭТ,
кг/м3,
ρам
– плотность аморфизир-го образца ПКА,
кг/м3.
ρам=1359
кг/м3.
,
где ρкр-плотность
закристал-го образца ПЭТ, для расчета
принимается ρкр=1448
кг/м3,
ρ- плотность анализир-го образца ПЭТ,
кг/м3,
ρам
– плотность аморфизир-го образца ПКА,
кг/м3.
ρам=1359
кг/м3.
5.2. Способы получения ДМТ и ЭГ.
ДМТ получают в основном двумя путями: 1) этерификация метанолом «сырой» ТФК ;2) окисление п-ксилола до п-ТК, ее этерификация метанолом, последующее окисление метильной группы до кислотной и превращение в ДМТ или совместное окисление п-ксилола, метилового эфира п-ТК и монометилового эфира ТФК и последующая их этерификация.
Процесс получения ДМТ постоянно развивается, усовершенствуется, модернизируется. Ниже приводятся некоторые способы получения ДМТ.
1) Каталитическое окисление п-ксилола до образования п-толуиловой
кислоты и монометилтерефталата с последующей этерификацией образовавшихся
продуктов метанолом происходит по схеме:
2С6H4(CH3)2 +О2-----> C6H4(CH3)COOH-1,4 + C6H4(COOH)COOCH3-1,4
п-ксилол кат n-толуиловая кислота монометилтерефталат
CH3OH
С6H4(CH3)COOH +C6H4(COOH)COOCH3-1,4------>C 6H4(COOCH3)2-1,4
n-толуиловая монометалтерефталат диметилтерефталат
кислота
2) Каталитическое окисление п-ксилола до образования терефталевой кислоты с последующей этерификацией метанолом происходит по схеме:
+О 2,кат
С6H4(CH3)2 --------> C6H4(COOH)2-1,4
n-ксилол t,Р терефталевая
кислота
C 6H4(COOH)2-1,4 + 2CH3OH -----> C 6H4(COOCH3)2-1,4 + 2H 2O
терефталевая диметилтерефталат
кислота
Сырьем для получения ДМТ служит п-ксилол. В основе всех процессов, используемых для синтеза ДМТ, лежит метод Виттен). В дальнейшем процесс был модифицирован различными фирмами с целью улучшения его экономических показателей. Самый распространенный процесс разработан фирмой Dynamit Nobel AG (Германия). Применение данной фирмой нового катализатора (кобальто-марганцевый) окисления п-ксилола позволило проводить реакции окисления и этерификации без растворителей. При этом удалось получить более высокий выход продукта. Согласно процессу фирмы Dynamit Nobel смесь п-ксилола и возвратного п-метилтолуилата окисляют воздухом при температуре 140-1700С и давлении 0.4-0.8 МПа в присутствии катализатора на основе тяжелого металла собразованием п-толуиловой кислоты и монометилтерефталата. Продукты окисления подвергают этерификации метанолом при температуре 250-2800С и давлении 2.0-2.5 МПа. Сырой ДМТ, отбираемый снизу ректификационной колонны очищают перекристаллизацией из метанола, центрифугируют и перегоняют с получением ДМТ сорта "для волокна" . Реакцию этерификации терефталевой кислоты в ДМТ проводят в три стадии. Hа первой - реакция протекает при высоких температурах и давлении.
ЭТИЛЕНГЛИКОЛЬ (1,2-этандиол) НО-СН2-СН2-ОН, мол. м. 62,07; бесцв. вязкая гигроскопич. жидкость без запаха, сладковатого вкуса; т. пл.-12,7 °С, т. кип. 197,6 °С, 100°С/16 мм рт. ст.; 1,1088; 1,4316; 19,83 мПа х с (20 °С); 48,4 мН/м (20 °С); 7,3 х 10-30 Кл-м (30 °С); х ур-ние температурной зависимости давления пара в интервале 25-90 °С: Хорошо раств. в воде, спиртах. кетонах и др., умеренно - в бензоле. толуоле. диэтиловом эфире. В этиленгликоль плохо раств. растит. и животные масла и не раств. минер. масла, парафины. каучук, ацетил- и этил-целлюлоза, поливинилхлорид. В промышленности этиленгликоль получают гидратацией этиленоксида. Процесс проводят при 130-150 °С и давлении 1,5-2 МПа. В качестве побочных продуктов образуются ди-, три- и полигликоли. В присут. кислоты и щелочи скорость реакции возрастает, но возникает проблема коррозии оборудования. Как правило, производство этиленгликоля объединяют с произ-вом этиленоксида; при этом используют очищенный товарный этиленоксид, что снижает себестоимость этиленгликоль, но ухудшает его качество. Первое пром. производство этиленгликоля основывалось на гидролизе дихлорэтана водным раствором соды при 200 °С и давлении 10 МПа:
С1СН 2СН 2С1 + Na2CO3 + Н2О НОСН2СН2ОН + 2NaCl + СО2
Этиленгликоль может быть получен взаимод. этиленоксида с СО2 при температуре 80-120 °С и давлении 2-5 МПа в присутствии галогенидов щелочных металлов:

Этот метод позволяет использовать водный р-р этиленоксида (1:1), выход 97-98%. При уменьшении добычи нефти и резком увеличении стоимости этилена представляют интерес методы синтеза этиленгликоль из альтернативного сырья: синтез.газа. метанола, СО и воды при температуре 200 °С и давлении 70 МПа либо в жидкой фазе при 40 МПа в присутствии оксидных медно-магниевых или родиевых катализаторов; из СО и Н2 - через диэфиры щавелевой кислоты.
Основной промышленный способ получения этиленгликоля - гидратация окиси этилена:
C2H4O + H2O --> HOCH2CH2OH
Процесс проводят при 130-150°C и давлении 1.5-2МПа при 8-15 кратном избытке воды. Выход продукта достигает 90%. Скорость реакции увеличивается в присутствии кислот и щелочей, однако при этом возникает проблема коррозии оборудования. Основные примеси в процессе - олигомеры - диэтиленгликоль, триэтиленгликоль и другие полиэтиленгликоли, причем количество примесей возрастает с увеличением доли окиси этилена в реакционной смеси.
