
Обработка результатов измерения
Задание: по экспериментально определенным длинам волн первых трех линий видимой серии атома водорода рассчитать и сравнить экспериментальное и теоретическое значения постоянной Ридберга; рассчитать энергию основного состояния атома водорода и потенциал его ионизации; построить в масштабе схему энергетических уровней водородного атома и изобразить на ней переходы, соответствующие изученному спектру, и переход, соответствующий ионизации атома водорода.

1. Для каждой серии измерений (для каждой линии) рассчитать среднее значение длины волны λср и из формулы (5) найти соответствующее экспериментальное значение постоянной Ридберга. Результаты расчётов занести в табл. 1, округлив в соответствии с 2 (см. ниже). Сравнить с примерными данными, приведенными ниже в таблице
2. Для одной из серий измерений рассчитать абсолютную погрешность найденного значения постоянной Ридберга в соответствии с правилами нахождения погрешностей для косвенно измеренных величин (дифференцированием – см. теорию нахождения погрешностей измерений).
3. Рассчитать среднее экспериментальное значение постоянной Ридберга по данным табл. 1 и сравнить с принятым табличным значением (1,09676576×107 м -1).
4. По формуле (1) рассчитать энергии основного и первых трех возбужденных состояний атома водорода. Энергии выразить в эВ. На миллиметровой бумаге в масштабе (эВ) построить схему энергетических уровней атома водорода. На схеме изобразить переходы, соответствующие линиям Hα, Hβ, Hγ , и переход, соответствующий ионизации атома.
5. Исходя из определения, рассчитать энергию ионизации атома водорода и потенциал его ионизации.
6.
Для
определения постоянной Ридберга можно
воспользоваться методом наименьших
квадратов (см. приложение),
для
чего следует построить график функции
![]() от
от
 .
График, соответственно, должен иметь
вид прямой линии. Коэффициент
наклона В
прямой
к оси абсцисс и будет являться
экспериментально найденным значением
постоянной Ридберга R (рис. 5). Сравнить
величины постоянной Ридберга, полученные
в п.1 по ф. (5) и графически в п.6. Метод
наименьших квадратов позволяет также
оценить значение ошибки в определении
постоянной Ридберга.
Определив по графику постоянную Ридберга,
вычислите постоянную Планка по формуле,
вытекающей из ф. (4)
.
График, соответственно, должен иметь
вид прямой линии. Коэффициент
наклона В
прямой
к оси абсцисс и будет являться
экспериментально найденным значением
постоянной Ридберга R (рис. 5). Сравнить
величины постоянной Ридберга, полученные
в п.1 по ф. (5) и графически в п.6. Метод
наименьших квадратов позволяет также
оценить значение ошибки в определении
постоянной Ридберга.
Определив по графику постоянную Ридберга,
вычислите постоянную Планка по формуле,
вытекающей из ф. (4)
 .
(6)
.
(6)
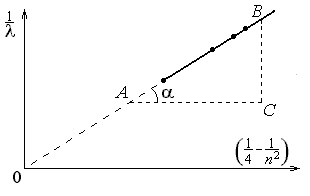
Рис. 5.
К графическому определению постоянной Ридберга по зависимости 1/ от (1/4 1/n2): показан характер зависимости величины 1/ от (1/4 1/n2) при n 2. График имеет вид прямой, которая выходит из точки с координатами (0;0). Прямая имеет угловой коэффициент наклона к оси абсцисс, равный постоянной Ридберга R
7. Проверьте внимательно по тексту разделов «Методика измерений» и «Обработка результатов измерений», все ли вами верно выполнено и рассчитано.
Контрольные вопросы и задания
1. Расскажите о модели строения атома Дж.Томсона. В чем проявилась ее несостоятельность? Расскажите о модели строения атома Резерфорда-Бора. Какие эксперименты Э.Резерфорда привели к созданию Н.Бором его теории?
2. Какого вида бывают спектры?
3. Сформулируйте, поясните и запишите формулами постулаты Бора. Почему теория Н.Бора называется полуклассической?
4. Выведите, следуя Бору, формулы для радиусов круговых орбит электронов, а также формулу для энергии электрона в атоме водорода. Какие формулы дает квантовая механика? Чем объясняется имеющиеся сходства/различия?
5. Какой физический смысл имеет главное квантовое число? Какие квантовые числа вы знаете и каков их физический смысл?
6. Почему опыты Франка и Герца считаются подтверждением теории Бора?
7. Какие еще явления, кроме спектра электрона в атоме водорода, являлись необъяснимыми с точки зрения классической науки начала 20 века?
8. Какие закономерности наблюдаются в атомных спектрах? Что такое спектральная серия?
9. Запишите обобщенную формулу Бальмера и поясните ее. Что называется спектральными термами? Начертите энергетическую диаграмму атома водорода и покажите стрелками переходы, соответствующие сериям Лаймана, Бальмера, Пашена.
10. Найдите связь постоянной Ридберга с энергией атома водорода в некотором стационарном состоянии.
11. Изобразите схему уровней энергии атома водорода. Что такое потенциал возбуждения и потенциал ионизации?
12. Как возникают линии Hα, Hβ, Hγ?
13. Опишите устройство монохроматора-спектрометра, используемого в вашей работе.
14. Решите задачу, предложенную преподавателем по теме «Атом Бора».
