
Лабораторная работа № 310
по курсу общей физики, раздел «Квантовая физика»
«ИЗУЧЕНИЕ СПЕКТРА АТОМА ВОДОРОДА»
Цель работы: Исследовать спектр атомарного водорода, вычислить постоянную Ридберга.
Приборы и принадлежности: проградуированный монохроматор-спектрометр МУМ, оптическая скамья с блоком источника излучения с водородной лампой и источником её питания.
Теоретическая часть
Из квантовой механики следует, что энергии электронов в атомах могут принимать только определенные дискретные значения. Состояния, отвечающие этим значениям энергии, называются энергетическими уровнями. При переходе электронов на более низкие уровни излучаются спектральные линии. Совокупность линий, отвечающих переходам на один и тот же нижний уровень, образует спектральную серию. Наиболее простой является система энергетических уровней атома водорода. Квантовая теория дает для значений энергии водородного атома формулу:
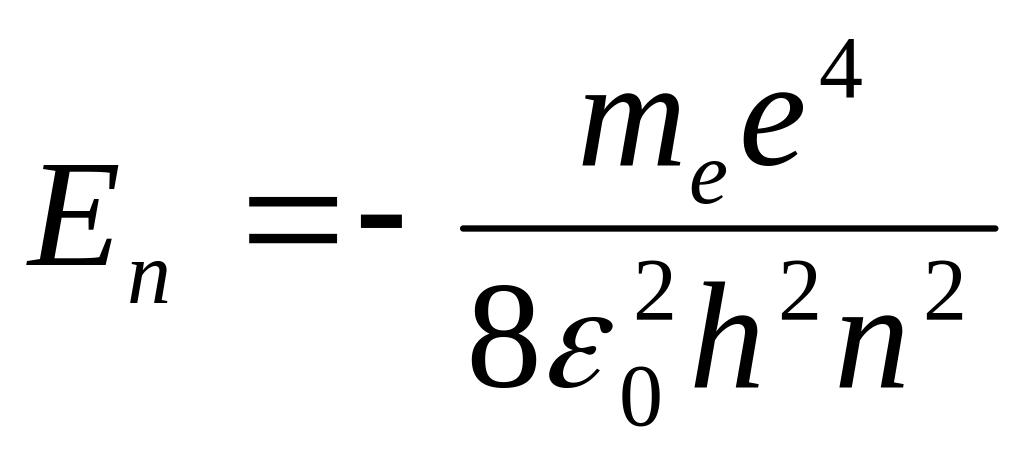 ,
(
,
(![]() )
(1)
)
(1)
где n – главное квантовое число, me – масса электрона, e – заряд электрона, e0 – электрическая постоянная, h – постоянная Планка.
Энергию кванта, излучаемого при переходе из состояния с номером m в состояние с номером n, можно найти из соотношения:
![]() ,
(2)
,
(2)
где λmn – длина волны, а с – скорость света в вакууме.
Из (1) и (2) следует, что длины волн спектральных линий атома водорода могут быть рассчитаны по формуле:
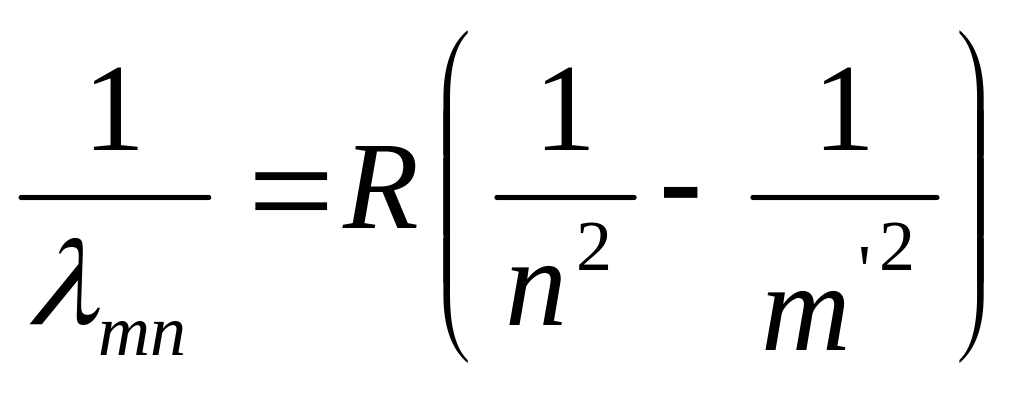 ,
(3)
,
(3)
 (4)
(4)
где R – является константой, называемой постоянной Ридберга.
Формула (3) называется обобщенной формулой Бальмера. Эта формула была известна еще задолго до построения квантовой механики (уравнение Э.Шрёдингера было получено в 1926 году). Она являлась обобщением формулы, найденной опытным путем швейцарским физиком И.Бальмером в 1885 году для известных тогда линий спектра водорода. В 1913 году датский физик Н.Бор, сделав некоторые допущения, содержащиеся в двух высказанных им постулатах (формула (2) соответствует второму постулату Бора), сумел дать теоретическое объяснение спектральным закономерностям, наблюдаемым для атома водорода, в частности, дал вывод формулы (3). Для атома водорода теория Бора даёт те же возможные значения энергии, что и квантовая механика. Однако, попытки, используя те же допущения, построить теорию такого простого атома, как атом гелия, потерпели полную неудачу. Совокупность линий, определяемая формулой (3) при n=1 и m=2, 3, 4, …, образует серию, обнаруженную в 1906 году Т. Лайманом. Эта серия лежит в ультрафиолетовой области спектра (серия Лаймана). Первая из инфракрасных серий (n=3, m=4, 5, 6, …) была обнаружена в 1908 году Ф. Пашеном и носит его имя. Следующая (n=4, m=5, 6, 7, …) была обнаружена только в 1922 году Ф. Брэкетом. Серия Бальмера (1885 г.) лежит в видимой и близкой ультрафиолетовой области спектра (примерно от 360 нм до 660 нм). Ей соответствуют переходы на уровень с номером n=2 с уровней с номерами m=3, 4, 5, … Для серии Бальмера формула (3) принимает вид:
 ,
m=3,
4 … (5)
,
m=3,
4 … (5)
Такую форму записи формулы впервые ввел И. Ридберг в 1890 году. Возможные переходы в водородном атоме можно представить наглядно с помощью схемы энергетических уровней, приведенной на рис. 1. Из рисунка видно, что линии в спектре водорода можно расположить по сериям. Для всех линий одной и той же серии значение n остается постоянным, а m может принимать любые целые значения, начиная с n+1. Состояние атома с минимальной энергией Е1 называется основным. Если атом получит извне некоторое количество энергии, то в зависимости от ее величины он может перейти в одно из возбужденных состояний. При этом электрон оказывается на одном из уровней с номерами m=2, 3, 4, … Такое состояние системы является неустойчивым. Через время порядка 10-8 с электрон из возбужденного состояния переходит на уровень с меньшим значением энергии. Избыток энергии будет испущен согласно формуле (2) в виде светового кванта. В конечном счете, атом возвращается в основное состояние. Поскольку одновременно излучается огромное количество атомов, в спектре излучения наблюдаются все возможные в данных условиях линии, хотя в каждом из атомов в данный момент совершается лишь один какой-либо из возможных переходов. При получении энергии извне электрон может не только перейти на лежащий выше уровень, но и вообще оторваться от атома. Минимальное количество энергии, которое требуется, чтобы оторвать электрон от атома, находящегося в основном состоянии, называется энергией ионизации атома или энергией связи электрона в атоме. Иногда используется понятие потенциала ионизации. Под потенциалом ионизации обычно понимают величину, равную разности потенциалов, которую должен пройти в электрическом поле электрон, чтобы приобрести энергию, равную энергии ионизации атома.
Аналогично вводится понятие потенциала возбуждения атома.
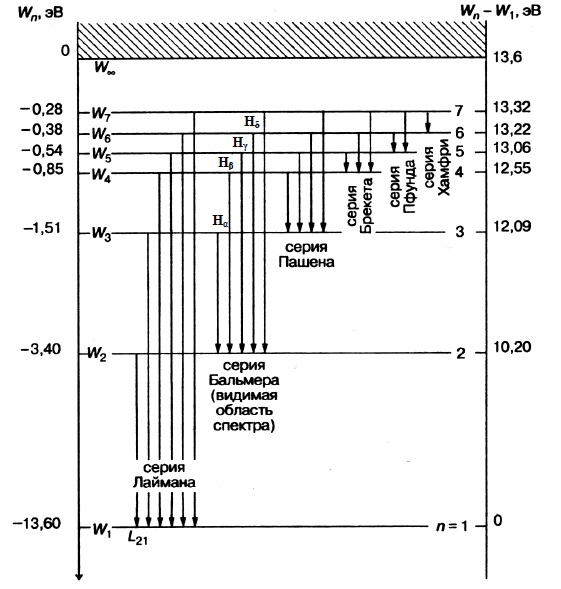
Рис. 1. Серии атома водорода
Следует отметить, что согласно формуле (1) энергии, соответствующие всем уровням атома (кроме уровня с n=∞), имеют отрицательные значения. Связано это с тем, что за нуль потенциала поля ядра, при выводе формулы (1), был выбран потенциал в бесконечно удаленной от него точке. Тем самым в качестве нуля энергии выбрали энергию электрона, расположенного вдалеке от протона. Самое маленькое значение энергии соответствует n=1. Энергия возрастает к нулю с ростом n.
В данной работе изучается видимая серия Бальмера (в видимом диапазоне длин волн или частот), для которой, как известно (см. выше), n=2. Обычно удается измерить длины волн только для первых трех линий этой серии. Величина m для них 6 принимает значения 3, 4, 5. Линии эти соответственно обозначаются символами Ha, Hb, Hg. Иногда удается увидеть линию Hd , для которой m=6.
Описание установки
Схема экспериментальной установки изображена на рис. 2. В состав установки входят следующие основные элементы: монохроматор-спектрометр МУМ; оптическая скамья, на которой на рейтерах установлен блок источника излучения БИИ. В этом блоке находятся водородная лампа ВЛ и источник её питания. На одной боковой стенке блока установлен тумблер "СЕТЬ" 1, а на противоположной ручка регулировки яркости водородной лампы 2. В выходной патрубок блока вставлен конденсор К монохроматора-спектрометра МУМ. Монохроматор-спектрометр МУМ используется в работе для измерения длин волн спектральных линий. Он предназначен для исследования спектров в диапазоне длин волн от 200 нм до 800 нм. Схема прибора изображена на рис. 2. Световой пучок проходит через конденсор К, который фокусирует его на входной щели 3. Щель имеет фиксированную ширину 0,25 мм и определяет ширину наблюдаемых спектральных линий. Далее, световой пучок, отражаясь от зеркала 4, падает наотражательную дифракционную решётку ДР, установленную на поворотном устройстве 5. Решётка может поворачиваться вокруг вертикальной (перпендикулярной к плоскости рисунка) оси при помощи ручки 6, соединённой механически с отсчетным устройством ОУ. При вращении ручки 6 дифракционная решётка поворачивается, и в поле зрения окуляра 9 (в данной комплектации специальный съемный окуляр отсутствует) попадают различные участки спектра, отражённые зеркалом 7. Окуляр 9, используемый для наблюдения спектра, устанавливают в выходной патрубок спектрометра. Его положение регулируется наблюдателем. При измерении длин волн перед окуляром устанавливают щель 8 шириной 0,05 мм. Первые три цифры в окне ОУ соответствуют длине волны в нм. Справа в окошке по рискам отсчитывают десятые доли длины волны в нм.

Рис. 2. Схема лабораторной установки
Методика измерений
Задание: определить экспериментально длины волн первых трех линий видимой серии атома водорода.
Ознакомьтесь с данными лабораторной установки (техническое описание и паспорт).
Внимание! Перед включением необходимо проверить заземление установки.
Внимание! Дать излучателю прогреться в течение 3–5 мин. Через каждые 40–45 минут работы установки необходимо отключать установку на 5–10 минут во избежание повреждения водородной лампы!
Поставить щели, обеспечивающие возможность наблюдения спектральных линий. Для этого рекомендуется на входе зрительной трубы монохроматора поставить щель 0,25 мм (или 1,0 мм) на выходе – 1,0 мм.
Включают установку выключателем "СЕТЬ". Наблюдая через окуляр и поворачивая ручку регулировки яркости 2 по часовой стрелке, зажигают водородную лампу, устанавливают необходимую, комфортную яркость её свечения и производят предварительную фокусировку. Вращая ручку 6, наблюдают с помощью окуляра 9 спектр водородной лампы, записывая соответствующие линиям длины волн. Следует отметить, что в спектре водородной лампы наряду с линиями атомного спектра наблюдается спектр молекулярного водорода. В промежутке между Ha и Hb располагаются несколько красно-желтых и зеленых сравнительно слабых молекулярных полос, перед Hg располагаются две слабые размазанные молекулярные полосы синего цвета.
4. Поиск линий желательно начинать с наиболее интенсивной красной линии Нα. Для этого следует медленно вращать ручку 6 монохроматора в пределах 640–670 нм, дожидаясь появления в смотровом окне монохроматора соответствующей линии, контролируя значение длины волны по индикатору цифрового счетчика длин волн ОУ. Вращение ручки против часовой стрелки соответствует движению в область уменьшения длины волны, по часовой – увеличение длины волны.
5. После обнаружения спектральной линии, для уточнения её положения (для уточнения длины волны λ) можно поставить щели меньшой ширины, например на входе 0,25 мм; на выходе 0,25 мм, однако, следует помнить, что уменьшение ширины щелей сопровождается резким уменьшением интенсивности света.
6. Записать значение длины волны Нα в таблицу 1, определяя по шкале монохроматора соответствующую длину волны согласно примеру, рис. 3.
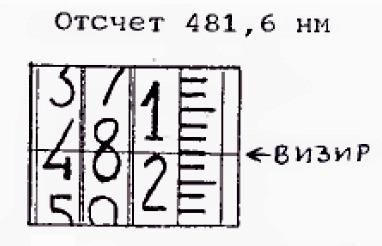
Рис. 3. Пример снятия показаний со шкалы волн монохроматора
7. Заменив щели на более широкие, обеспечивающие продолжение поиска линий (на входе 0,25 мм (или 1,0 мм) на выходе – 1,0 мм), и, медленно вращая ручку монохроматора 6 в область уменьшения длины волны, продолжить поиск линий. Следующая яркая интенсивная линия Нβ – зелено-голубая. В промежутке между Нα и Нβ располагаются несколько красно-желтых и зеленых сравнительно слабых молекулярных полос, внимание на которые обращать не следует. Уточнив длину волны Нβ, записать её значение в таблицу 1.
8. Продолжить поиск линий, вращая ручку в сторону уменьшения длины волны. Третья линия атомарного водорода - Нγ – фиолетово-синяя. Перед этой линий также могут располагаться слабые размытые молекулярные полосы синего цвета. Уточнив положение линии Нγ, записать значение длины волны, соответствующей этой линии в таблицу 1.
9. Четвертая линия – Нδ – фиолетовая (темно-фиолетовая). Однако её не всегда удается найти. Если Нδ видна, также записать значение длины волны, соответствующей этой линии в таблицу 1.
Следует иметь в виду, что некоторые линии (особенно в красной и красно-оранжевой области) не всегда удается разглядеть по причине их малой интенсивности и большой интенсивности желтого дублета (см. например, рис. 4).
Рис. 4. Группы линий (дублеты) в спектре водорода
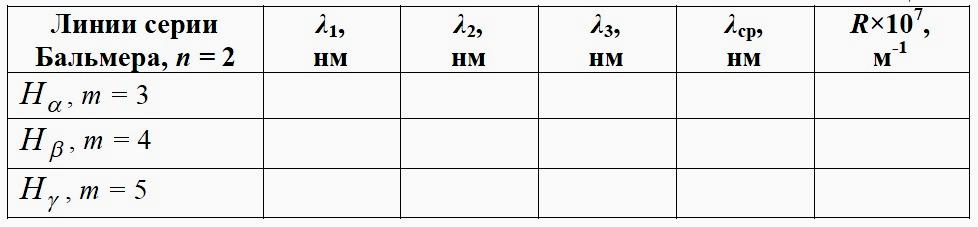
Измеренные значения заносят в табл. 1 (следует провести не менее трёх измерений для каждой линии, т.е. повторить пп.4–9 еще два раза). При измерениях можно приближенно ориентироваться на данные таблицы 2.
Таблица 1. Возможный вид таблицы с данными измерений

или
10. По окончании работы необходимо отключить питание установки выключателем «СЕТЬ» (на задней панели излучателя) и отключить сетевую вилку излучателя от питающей сети.
Таблица 2. Ориентировочные длины волн для спектра водорода

