
- •47. Внутрикл. Обмен а,к. Декарбоксилирование l-аминокисл. Физиологич. Значение образующихся продуктов.
- •48. Пути образования и обезвреживания аммиака в организме. Осн. Конечные продукты азотного обмена у человека и животных.
- •49.Биосинтез мочевины: последовательность ферментативных реакций. Связь орнитинового цикла и цтк.
- •50. Внутриклет. Обмен а,к. Траснаминирование а,к. : реакции и их биологич. Значение, механизмы действия аминотрансфераз.
- •51. Внутриклеточный обмен а,к. Прямое и непрямое дезаминирование свободных l- аминокислот в тканях. Глутаматдегидроггеназа и ее роль в обмене а,к.
- •52. Глюконеогенез из а,к. Глюкопластические а,к.
- •53. Специализированные пути метаболизма цикл. А,к- фенилаланина и тирозина.. Заболевания, связанные с нарушением обмена фенилаланина и тирозина.
- •54. Перевар.И всасыв. Белков в жкт. Протеолитич. Ферменты и регуляция их активности. Транспорт а,к в клетки
51. Внутриклеточный обмен а,к. Прямое и непрямое дезаминирование свободных l- аминокислот в тканях. Глутаматдегидроггеназа и ее роль в обмене а,к.
Дезаминирование аминокислот – реакция отщепления a-аминогруппы от аминокислоты с выделением аммиака. Различают два типа реакций дезаминирования: прямое и непрямое. Прямое дезаминирование – непосредственное отщепление аминогруппы от аминокислоты без промежуточных посредников. В живой природе возможны следующие типы прямого дезаминирования: окислительное, восстановительное, гидролитическое и путем внутримолекулярной перестройки. Но у человека дезаминирование происходит преимущественно окислительным путем в результате чего образуется соответствующая a-кетокислота и выделяется аммиак. Процесс идет с участием ферментов оксидаз. Выделены оксидазы L-аминокислот, превращающие L-изомеры аминокислот, и D-оксидазы. Большинство аминокислот не способно дезаминироваться в одну стадию, подобно глутамату. Аминогруппы таких аминокислот перносятся на a-кетоглутарат с образованием глутаминовой кислоты, которая затем подвергается прямому окислительному дезаминированию. Такой механизм дезаминирования аминокислот в 2 стадии получил название трансдезаминирования или непрямого дезаминирования. Он происходит с участием 2 ферментов аминотрансферазы и глутаматдегидрогеназы. Значение этих реакций в обмене аминокислот очень велико, так как непрямое дезаминирование – основной способ дезаминирования большинства аминокислот. Обе стадии непрямого дезаминирования обратимы, что обеспечивает как катаболизм аминокислот, так и возможность образования практически любой аминокислоты из соответствующей a-кетокислоты. Обратная последовательность реакций, при которой происходит синтез аминокислот из кетокислот, получила название трансреаминирования.
Доказано существование 4 типов дезаминирования аминокислот (отщепление аминогруппы). Выделены соответствующие ферментные системы, катализирующие эти реакции, и идентифицированы продуктыреакции. Во всех случаях NH2-группа аминокислоты освобождается в виде аммиака.
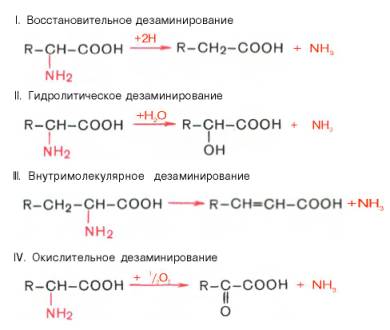
Помимо аммиака, продуктами дезаминирования являются жирные кислоты, оксикислоты и кетокислоты. Для животных тканей, растений и большинства аэробных микроорганизмов преобладающим типом реакцийявляется окислительное дезаминирование аминокислот, за исключением гис-тидина, подвергающегося внутримолекулярному дезаминированию.
.
Глутаматдегидрогеназа животных тканей является одним из наиболее изученных ферментов азотистого обмена. Это олигомерный фермент (мол. масса 312000), состоящий из 6 субъединиц (мол. масса каждой около 52000) и проявляющий свою основную активность только в мультимерной форме. При диссоциацииэтой молекулы на субъединицы, наступающей легко в присутствии НАДН, ГТФ и некоторых стероидных гормонов, фермент теряет свою главную глутаматдегидрогеназную функцию, но приобретает способность дезаминировать ряд других аминокислот. Это свидетельствует об аллостерической природеглутаматдегидрогеназы, действующей как регуляторный фермент в аминокислотном обмене.
Помимо перечисленных 4 типов дезаминирования аминокислот и ферментов, катализирующих эти превращения, в животных тканях и печени человека открыты также три специфических фермента (серин- и треонин-дегидратазы и цистатионин-γ-лиаза),катализирующих неокислительное дезаминированиесоответственно серина, треонина и цистеина.
