
- •1.Введение
- •2.Физико-химические свойства ортофосфорной кислоты.
- •3. Получение h3po4 термическим способами.
- •4.Функциональная схема производства экстракционной фосфорной кислоты.
- •4.1.Сернокислотное разложение апатита.
- •4.2. Утилизация отходов при производстве фосфорной кислоты.
- •5.Список литературы.
Министерство образования и науки Российской Федерации
ФГАОУ ВПО УрФУ имени Первого президента России Б.Н. Ельцина
Химико-технологический институт
Кафедра Технологии неорганических веществ
Реферат
Тема: «Производство экстракционной фосфорной кислоты»
Выполнили: Ефимова Ю.
Нуриева С.
Гр: Х-390601 Б
Проверила: Гашкова В. И.
Екатеринбург 2012
Оглавление.
1.Введение 3
2.Физико-химические свойства ортофосфорной кислоты. 4
3. Получение H3PO4 термическим способами. 5
4.Функциональная схема производства экстракционной фосфорной кислоты. 6
4.1.Сернокислотное разложение апатита. 8
4.2. Утилизация отходов при производстве фосфорной кислоты. 10
5.Список литературы. 16
1.Введение
Фосфорная кислота H3PO4 является важнейшим промежуточным продуктом в производстве концентрированных фосфоросодержащих удобрений. Кроме того, фосфорная кислота используется в производстве различных технических солей, фосфорорганических соединений, в том числе инсектицидов, полупроводников, ионообменных смол, а также для создания защитных покрытий на металлах. Очищенная или так называемая пищевая фосфорная кислота используется в пищевой промышленности, для приготовления кормовых концентратов и фармацевтических препаратов. Сырьё для производства фосфорной кислоты . Фосфор извлекают из фосфатных руд их разложением. В настоящее время наибольшее распространение получило кислотное разложение руд, содержащих более 25% Р2О5. Фосфорная кислота образуется непосредственно при растворении руды, т.е. прямым извлечением соединений фосфора экстракцией. Отсюда название продукта - экстракционная фосфорная кислота (ЭФК). Из более бедных руд получают термическую фосфорную кислоту. Процесс основан на восстановлении фосфора из природных фосфатов коксом при высоких температурах и дальнейшем получении H3PO4 из фосфора.
Целью реферата является получение общих сведений о процессе, сырье, способах получения и использования. Важной задачей также является рассмотрение основной технологической схемы получения фосфорной кислоты. Основу экологической части является описание основных отходов, образующихся в процессе получения фосфорной кислоты – газообразных, жидких, твердых и методов их рациональной переработки (либо утилизации, очищения) в более полезные и широко используемые материалы.
2.Физико-химические свойства ортофосфорной кислоты.
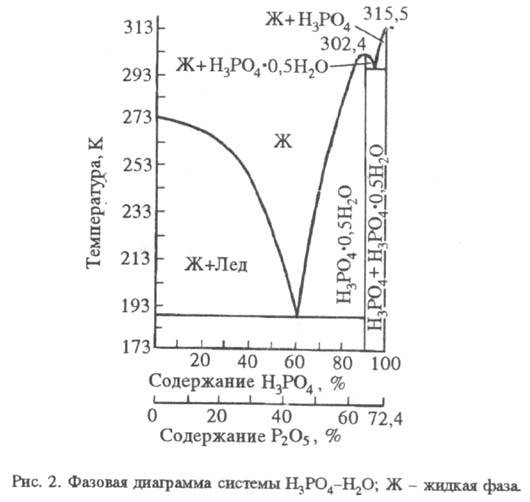
Ортофо́сфорная кислота — неорганическая кислота с химической формулой H3PO4, которая при стандартных условиях представляет собой бесцветные гигроскопичные кристаллы. При температуре выше 213 °C она превращается в пирофосфорную кислоту H4P2O7. Очень хорошо растворима в воде. Обычно ортофосфорной (или просто фосфорной) кислотой называют 85 % водный раствор (бесцветная сиропообразная жидкость без запаха). Растворима также в этаноле и других растворителях. Фосфорная кислота смешивается с водой в любых соотношениях. Разбавленные водные растворы имеют кисловатый вкус. Из высококонцентрированных растворов кристаллизуется в виде гемигидрата (полугидрата) H3PO4•0,5H2O- бесцветные кристаллы моноклинной сингонии (а = 0,7922 нм, b = 1,2987 нм, с = 0,7470 нм, = 109,9°; пространственная группа Р21/a). Молекула безводной H3PO4 и ее кристаллогидрата содержит тетраэдрическую группу PO4. В безводной H3PO4 образуются водородные связи типа P — О — H ... O = P расстояние между атомами кислорода 0,253 нм, которые удерживают структуры PO4 в виде слоев, параллельных одной из плоскостей кристалла. Водородные связи сохраняются и в концентрированных (70-80%) растворах H3PO4, что отчасти обусловливает ее сиропообразную природу. В разбавленных до 40-50% растворах отмечена более устойчивая водородная связь фосфат-анионов с молекулами воды, а не с другими фосфат-анионами. В растворах H3PO4имеет место обмен атомами кислорода между группами PO4 и водой. H3PO4- сильная кислота, K1= 7,1•10-3 (рКа 2,12), K2= 6,2•10-8 (рКа 7,20), K3= 5,0•10-13 (рКа 12,32); значения K1 и K2 зависят от температуры. Диссоциация по первой ступени экзотермична, по второй и третьей - эндотермична. Фазовая диаграмма системы H3PO4- H2O приведена на рис. 2. Максимум кривой кристаллизации - при температуре 302,4 К и содержании H3PO491,6% (твердая фаза - гемигидрат).
Фосфорная кислота при нормальных условиях малоактивна и реагирует лишь с карбонатами, гидроксидами и некоторыми металлами. При этом образуются одно-, двух- и трехзамещенные фосфаты. При нагревании выше 80 0C реагирует даже с неактивными оксидами, кремнеземом и силикатами. При повышенных температурах H3PO4 - слабый окислитель для металлов. При действии на металлическую поверхность раствором H3PO4 с добавками Zn или Mn образуется защитная пленка (фосфатирование). Фосфорная кислота при нагревании теряет воду с образованием последовательно пиро- и метафосфорных кислот.
