
- •Загальні технологічні аспекти виробництва сталі у кисневому конвертері
- •Будова кисневого конвертера і фурми для продування
- •Лекція 4 футерівка кисневих конверерів
- •Лекція 7. Взаємодія струменя кисню з розплавом
- •7.1 Питома інтенсивність продувки киснем
- •7.2 Взаємодія струменя кисню з розплавом
- •Глибина реакційної зони при інтенсивному зневуглецьовані
- •Лекція 8 Шихтові матеріали та вимоги до них
- •Лекція 9 Особливості виведення домішок з металу
- •Отже, за рівноваги металу зі шлаком
- •При основності шлаку в 2,5 і (FeO) 15 % [p] 0,01 %. Найінтенсивніше фосфор переходить в шлак на початку і наприкінці продування, коли активно розчиняється вапно.
- •Тепловий баланс і температурний режим процесу
- •Автоматизація процесів конвертерного виробництва сталі
- •Якість та сортамент конвертерної сталі. Перспективи розвитку конверторного виробництва
- •Основи планування киснево-конвертерних цехів
- •Охолодження та очищення конвертерних газів
Лекція 9 Особливості виведення домішок з металу
Продування має три періоди при виробництві низьковуглецевих сталей і два – середню і високовуглецевих. Але чітких меж між періодами немає. (рис. ) стр.130.
У І періоді швидко (до сотих часток) окислюються [Si], [Mn] i [P] (до певної концентрації), уповільнено - [С]. У ІІ період інтенсивно окислюється [С], а вміст [Mn] і [Р] спочатку стабільний, а наприкінці частково відновлюється у наслідок підвищення температури. У ІІІ періоді швидко окислюється [Fe]. У зв’язку зі зростанням (FeO) [Mn] і [Р] частково окислюються, а окислення [С] уповільнюється через низький вміст [С].
Окислення [Si] інтенсивно окислюється з першої хвилини продування за реакцією
[Si] + 2(FeO) = (SiO2) + 2[Fe],
що протікає переважно у вторинній реакційній зоні та на межі метал-шлак. Отже
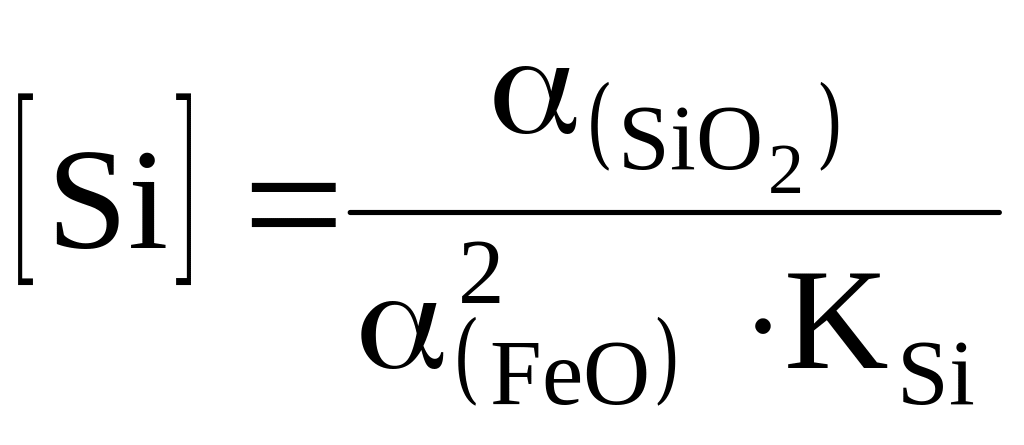
Окислюванню[Si] сприяє мала (SiO2), велика (FeO) і КSi (низька температура ванни). Тому [Si] окислюється за перших 20 % часу продування. Далі [Si] істотно не відновлюється в результаті збільшення основності і протікання реакції
(SiO2) + 2(CaO) = (2CaOSiO2),
тобто зростання (2CaOSiO2) і падіння вільного (SiO2).
Окислення – відновлення [Mn].
[Mn] має менш високу, ніж [Si], спорідненість з киснем, але швидко окислюється на початку продування за реакцією
[Mn] + (FeO) = (MnO) + [Fe],
що протікає там же, де і окислюється [Si]. Отже
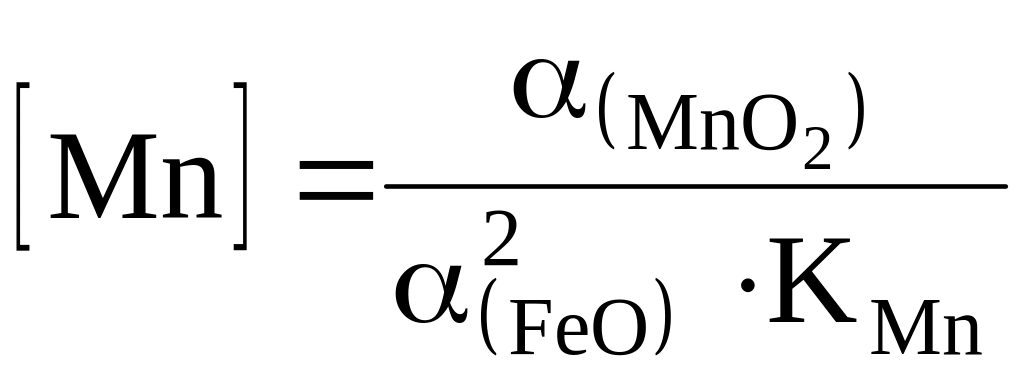
Окисленню [Mn] сприяє мала (MnO), величина (FeO) і КMn (низька температура ванни). З підвищенням температури, (MnO) і зниженні (FeO) швидкість окислення [Mn] спадає, бо система метал-шлак наближається до рівноваги. Усередині продування вміст [Mn] стабілізується, потім [Mn] відновлюється до певного максимального значення. Відновленню [Mn] сприяє зменшення КMn у зв’язку зі зростанням температури, і збільшення коефіцієнту активності (MnО) через підвищення основності шлаку, що превалює над розведенням (MnО) окислами кальцію і заліза. При низькому вмісті [С] заключна частина продування супроводжується окисленням [Mn], що пояснюється різким збільшенням (FeO) наприкінці продування.
Окислення [С].
Максимальна швидкість вигорання [С] досягається після окислення [Si] і завершення часткового окислення [Mn] і [Р]. Водночас умови (термодинамічні та масообміні) перших 20-25 % тривалість продування сприятливі для окислювання [С] за сумарною реакцією
[С] + 0,5 {O2} = {CO},
бо на окислення [C] використовується не лише кисень дуття, а й велика частина накопиченого в шлаці (FeO), що підтверджується зниженням (FeO).
Значення VC визначається іО2 і коефіцієнтом використання кисню дуття Квик, який залежить від положення фурми і стану шлаку.
![]()
де
![]()
![]() -
маса вуглецю, кг/1 м3
О2,
окисленого за сумарною реакцією.
-
маса вуглецю, кг/1 м3
О2,
окисленого за сумарною реакцією.
Слід відзначити, що 0,05 кисню втрачається на окислення {CO} до {CO2} і ще 0,05 - [Fe] до (Fe2 O3), бо випарюється 2 кг Fe на 1 м3 О2.
Якщо
іО2
= 2-6 м3/(тхв.),
то
![]() .
При [С] = 0,2-0,3 %, що є критичним, VС
різко зменшується, бо велика частка
кисню витрачається на накопичення кисню
в металі і (FeО) в шлаці. Якщо [С] = 0,05 %, то
при і
= 2-6 м3/(тхв.)
VС=
0,03-0,1 % [С]/хв.
.
При [С] = 0,2-0,3 %, що є критичним, VС
різко зменшується, бо велика частка
кисню витрачається на накопичення кисню
в металі і (FeО) в шлаці. Якщо [С] = 0,05 %, то
при і
= 2-6 м3/(тхв.)
VС=
0,03-0,1 % [С]/хв.
Видалення [Р]
[Р] окислюється при високому вмісті [С] за сумарними реакціями:
2[Р] + 5(FeJ) + 3(CaO) = (3CaOP2O5) + 5[Fe]
2[P] + 5(FeO) + 4(CaO) = (4CaOP2O5) + 5[Fe]
