
Напряжённость поля
При оценке напряженности поля для горизонтального фореза принято пренебрегать конкретной геометрией камеры и измерять расстояние непосредственно между электродами.
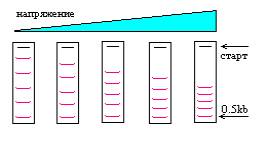
На рисунке показана схема форезов, при разном напряжении. Форезы проводились разное время, так, чтобы 0.5kb фрагмент прошел одинаковое расстояние. Видно, что проведение фореза при высоком напряжении эквивалентно уменьшению длины геля.
Разумный компромисс между скоростью и качеством фореза для высококачественных или препаративных форезов: ~2V/cm(можно меньше для ON форезов). Для аналитических форезов приемлемое качество сохраняется до ~6V/cm.
DNA особенно легко теряет EtBr при повышенной температуре (что обычно случается, если гонять форезы при высоком напряжении).
EtBr при форезе движется от (+) к (-). Если хочется, чтобы он не уходил из геля, лучше ввести его и в форезный буфер.
Количество dna, которое можно наносить на дорожку
Нижний предел определяется используемым методом детекции. Если применяется окрашивание EtBr, то не стоит надеяться увидеть <10ng на 5mm полоску.
Верхний предел: слишком большое количество DNA на дорожке приводит к двум неприятным эффектам:
изменению подвижности полосы в геле (идёт быстрее). Так что не надо сразу паниковать, когда, например, слишком большое количество pDNA идёт быстрее, чем разбавленная исходная плазмида. (к такому же эффекту может привести и слишком большое количество RNA в препарате pDNA).
при визуальной или при денситометрической оценке количества DNA получаются заниженные оценки (точность совсем низкая, начиная приблизительно с 0.5 µg на 5mm дорожку). Оптимальный диапазон для денситометрического определения: 0.02-0.15 µg на полоску.
Буфер для внесения
Присутствие красителя:
облегчает внесение в лунку;
позволяет иметь представление, где в геле находится фрагмент;
но в то же время:
может мешать наблюдению фрагментов под UV;
может оказаться нежелательной примесью при элюции фрагмента из геля.
Подвижность красителей в гелях с различной концентрацией агарозы:
% |
Подвижность красителей |
|||
КЦ |
Крезоловый кр. |
Бромфен. синий |
OrangeG |
|
0,7 |
~10.5 (9-15) |
~3.8 (3.2-4.5) |
~0.8 (0.7-1.2) |
~0.15 (0.1-0.2) |
0,8 |
~8 (7-9) |
~2.9 (2.7-3.2) |
~0.5 (0.4-0.6) |
< 0.25 |
1,0 |
~6 (4.8-7) |
~2.2 (2-2.5) |
~0.5 (0.4-0.6) |
< 0.25 |
1,5 |
~2.2 (1.8-2.6) |
~1.0 (0.9-1.3) |
~0.25 |
<< 0.25 |
2,0 |
~0.75 (0.6-0.9) |
~0.35 (0.3-0.4) |
< 0.25 |
<< 0.25 |
Выбор красителя:
Бромфеноловый синий и ксиленцианол — (стоковые растворы 1% в H2O; рабочая концентрация в 1х буфере ~0.005-0.02%) могут заметно мешать наблюдению фрагментов под UV. По нашему опыту, элюция фрагмента в РEG вместе с любым из этих красителей не оказывает заметного влияния на меченье, лигирование и трансформацию.
Cresol red (Na соль) — (стоковый раствор 50mM в H2O; рабочая концентрация в 1х буфере ~0.1mM) совместим с ферментативными реакциями, практически не мешает наблюдению под UV.
OrangeG — (стоковый раствор 1% в формамиде; рабочая концентрация в 1х буфере ~0.01-0.05%) наиболее подвижный краситель, практически всегда находится вне "рабочей зоны". Заметен под UV.
Краситель в буфере нужен лишь для того, чтобы образец был легко заметен в лунке и в геле. Обычно приводимые в методиках ~0.025% для бромфенолового синего и ксиленцианола (в 1х буфере) по нашему мнению слишком большое количество.
Лучше иметь на столе
буфера с различными красителями.
различные разведения буфера для внесения (10х, 2х, 1х). При этом образец любого объема собирается из двух компонентов (буфер+образец), а не из трех (буфер+ вода + образец).
1x если объем образца < 25%
2x ==> 25-75%;
10x ==> 75%
Буфер для загрузки образцов в гели, 6×
(10 мМ Трис-HCl, 0,03% бромфеноловый синий, 0,03% ксиленцианол ФФ, 0,15% Оранжевый Ж, 60% глицерин, 60 мМ ЭДТА, pH 7,6)
Буфер для загрузки образцов в гели c ДСН, 6×
(Применяется для анализа образцов ДНК, содержащих большое количество ДНК-связывающих белков (гель-электрофорез ДНК после рестрикции, лигирования или дефосфорилирования.)
Буферные системы
Для электрофореза белков в полиакриламидном геле в качестве буферных растворов используют: Трис-HCl, Трис-трицин, TBE, TBE с мочевиной, Bis-Tris.
Красители и материалы для визуализации результатов электрофореза:
флуоресцентные красители для белков:
Sypro Ruby
Flamingo
Oriole
колориметрические красители для белков:
Кумасси
окрашивание цинком
окрашивание серебром
окрашивание медью
красители для нуклеиновых кислот:
окрашивание серебром
бромистый этидий
детекция на блоттах
биотиновые комплексы
авидиновые комплексы
комплексы с HRP и AP
Для визуализации результатов электрофореза чаще всего используют окрашивание гелей красителем Кумасси (en:Coomassie blue) или серебром. Для проведения вестерн блоттинга белки переносят из геля на нитроцеллюлозную мембрану.
