
Гель-фільтрація
Для розділення білків часто використовують хроматографічні методи, які базуються на розподілі речовин між двома фазами, одна з яких є рухомою, інша ж нерухома. В основу хроматографічних методів закладені різні принципи: гель-фільтрації, йонного обміну, адсорбції, та ін..
Метод розділеня білків за допомогою гель-фільтраційної хроматографії базується на тому, що речовини, які відрізняються за молекулярною масою, по-різному розділяються між рухомою та нерухомою фазами. Таким чином, за допомогою цього методу можна швидко розділити білки у відповідності з їхніми розмірами та формою молекул.
Носієм для хроматографії є гель, що складається з поперечно-зшитої тривимірної молекулярної сітки сформованої у вигляді гранул. Найчастіше використовують сефадекси. Сефадекси (separation pharmacia dextran) - це продукти взаємодії полісахарида декстрана з епіхлоргідрином (рис.2.).
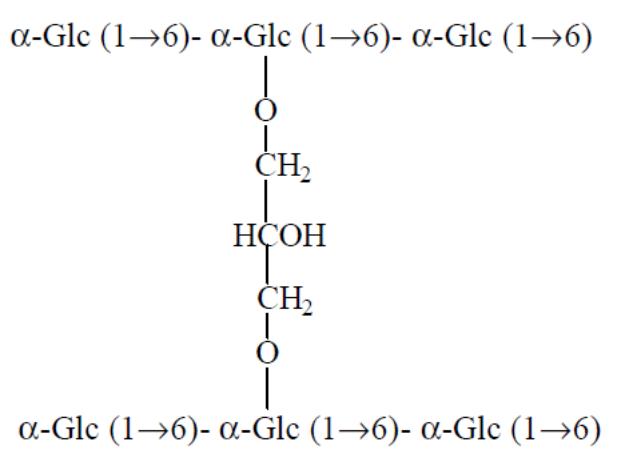
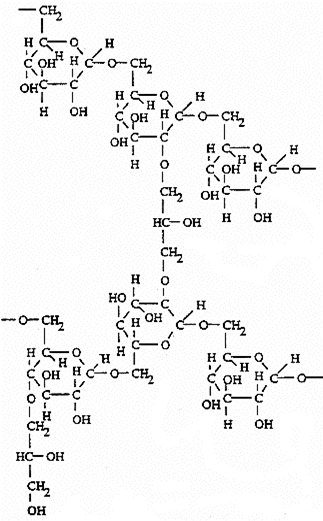
Рис.2. Структура сефадекса
Сефадекси є стійкими до дії органічних розчинників, розчинів лугів, і розбавлених кислот, а також нерозчинні у воді. Завдяки великому вмісту гідроксильних груп, гранули сефадекса легко набухають у водному середовищі, або ж у буферному розчині, з утворенням гелю, яким і заповнюють хроматографічну колонку. Чим вища здатність геля до набухання, тим вищий номер сефадекса. Робочий діапазон рН складає 2-10. Існує декілька типів сефадексів, які різняться між собою за розмірами, кількістю та величиною гранул. При розділенні суміші білків використовують сефадекси тонкого або супертонкого зерніння (G-100, G-250). Чим менші частини гелю, тим ефективніше проходить розділення
Нерухома фаза - це рідина всередині гранул сефадекса, в яку можуть проникати низькомолекулярні речовини і білки з невеликою молекулярною масою. Суміш білків, що наносять на хроматографічну колонку, вимивають, пропускаючи через колонку розчинник. Разом з фронтом розчинника рухаються і молекули білків, з великою молекулярною масою і розмірами, які не дифундують всередину зерен сефадекса. Таким чином - вони першими вимиваються із колонки. Більш дрібні молекули дифундують всередину гранул сефадекса і на деякий час попадають в нерухому фазу, в результаті чого їх рух сповільнюється (рис.3.). Величина пор визначає розмір молекул, які можуть проникати всередину гранул.
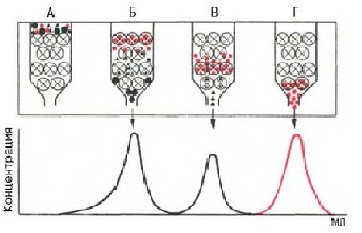
Рис. 3. Схема гель-хроматографії на колонці з сефадексом.
(Великі кружечка з хрестиком - зерна сефадекса, малі чорні і червоні кружечка та трикутники - білки з різною молекулярною масою)
А- колонка на початку роботи
Б,В,Г - колонка в різні періоди роботи. ( розділення білкових компонентів в залежності від молекулярної маси та величини молекул).
Електрофоретичне розділення білків
Метод електрофорезу базується на відмінностях в швидкості руху білків в електричному полі, яка визначається величиною заряду білка при певних значеннях рН і іонної сили розчину. Так, швидкість руху білків в електричному полі пропорційна їх сумарному заряду. Білки, які мають сумарний заряд негативний рухаються до анода (+), а позитивно заряджені білки рухаються до катода (-).
Електрофорез проводять на різних носіях, включаючи - на папері. Останнім часом широкого поширення набули методи зонального електрофорезу білків на твердих розчинах: гелях крохмалю, поліакриламіду, агарози та ін. Їхні переваги в тому, що виключається можливість розмивання границі білкок-розчинник в результаті дифузії, та для аналізу необхідна невелика кількість білка. Також на відміну від електрофорезу на папері, де швидкість руху білків пропорційна тільки їх сумарному заряду, в поліакриламідному гелі швидкість руху білків пропорційна їх молекулярній масі, оскільки білки попередньо денатурують. В результаті цього можна отримати більше різноманітних фракцій білка. Якщо білки попередньо не денатурувати швидкість їх міграції в гелі буде залежати не тільки від молекулярної маси, а й від величини молекул, форми молекул та сумарного заряду. Для виявлення білкових фракцій гель обробляють барвником, молекули якого зв’язуються з білковою глобулою. Зазвичай, використовують кумасі яскраво-синій. Після цього гель відмивають від барвника, що залишився незв’язаним, і пофарбовані полоси білка стають добре помітними неозброєним оком.
