- •Министерство образования Российской Федерации
- •Выполнил студент группы 35-12 Алексеев а.А.
- •Содержание
- •Цель практической работы
- •Введение
- •Методы определения остаточных напряжении классификация и анализ методов определения остаточных напряжений
- •Определение остаточных напряжений и релаксации их в деталях произвольной формы методом профилированной координатной сетки.
- •Оригинальная часть задания.
Оригинальная часть задания.
Сорбция - это поглощение одного вещества другим.
Поглотитель - сорбент,
поглощаемое вещество - сорбат.
Если поглощение происходит только в поверхностном слое сорбента, т.е. происходит поверхностная сорбция, она называется адсорбцией.
Если же сорбат продиффундировал по всему объёму сорбента, т.е. если произошла объёмная сорбция, она называется абсорбцией.
По механизму протекания процесса сорбция подразделяется на:
физическую,
химическую.
При физической сорбции между сорбентом и сорбатом происходит только межмолекулярное взаимодействие, т.е. сцепление достаточно непрочное, и со временем начинается обратный процесс - процесс отдачи поглощённого вещества, и в конце концов устанавливается равенство скоростей обоих процессов:
Vадсорбции == Vдесорбции
При химической сорбции (хемосорбции) между сорбентом и сорбатом возникает химическое взаимодействие, в результате чего между ними образуется третье вещество, рис.2.

Рис.2
Химическая сорбция намного прочнее физической, десорбция самопроизвольно практически не происходит.
Ещё одно отличие между физической и химической сорбцией заключается в том, что при повышении температуры физическая сорбция уменьшается, а химическая увеличивается.
В чистом виде физическая и химическая сорбция встречаются редко, чаще всего сорбция включает элементы их обеих.
Адсорбция происходит на границе раздела следующих фаз:
твёрдое тело - газ;
твёрдое тело - раствор;
раствор - газ.
Адсорбция на границе твёрдое тело - газ:
Г - величина адсорбции
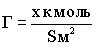 ,
,
где
х - количество адсорбата , к моль S - площадь адсорбента, м2.
В случае, если площадь адсорбента измерить трудно, то площадь его поверхности заменяют его массой
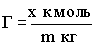 .
.
В данном случае (поглощение газа твёрдым адсорбентом) адсорбция является функцией температуры и газового давления.
Г= f (T, P)
Адсорбция происходит при постоянной температуре (T = const). Величина адсорбции является функцией аргумента Р:
Г = f (P)
Это равенство имеет графическое выражение, рис.3, которое называется изотермой адсорбции.
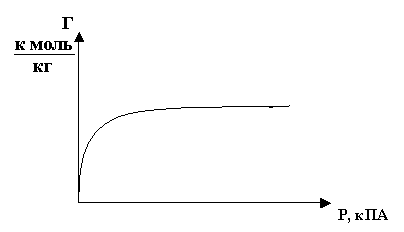
Рис.3
Участок прямой соответствует равновесному состоянию:
V адсорбции = V десорбции.
Существует уравнение Фрейндлиха, графическое выражение которого позволяет этот график представить в виде прямой:
Х = кP1/n - уравнение Фрейндлиха
Х - количество адсорбата на 1 г адсорбента к, 1/n - константы Р - газовое давление, кПа.
Прологарифмируем это уравнение:
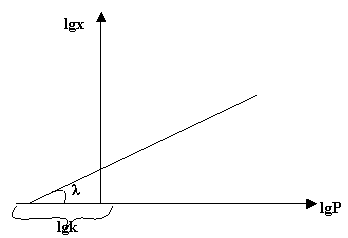
lg X = lg к + 1/n lg P, рис.4
|
Тангенс угла наклона прямой (tgλ) равняется величине 1/n. Отрезок, отсекаемый по оси х, равен величине lgк |
Рис. 4
Адсорбция твердым адсорбентом из раствора
Адсорбируются из раствора растворенные вещества. Величина адсорбции для растворов является функцией температуры и молярной концентрации раствора.
Г= f (Т,Св) |
Т - const |
Величина адсорбции становится функцией молярной концентрации раствора
Г=f(CB), рис.5
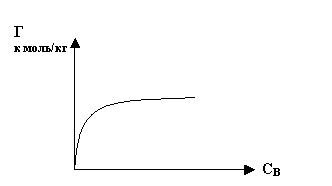
Рис. 5
Адсорбция из растворов имеет существенные отличия от газовой адсорбции. Это вызвано следующими причинами:
на адсорбенте может адсорбироваться не только растворенное вещество, но и сам растворитель. Чем лучше протекает адсорбция растворителя, тем труднее будет адсорбироваться растворенное вещество;
растворитель может растворять адсорбент. Чем лучше растворитель растворяет адсорбент, тем труднее протекает на нём адсорбция;
скорость адсорбции из раствора зависит от скорости диффузии. В результате обеднения извлекаемым веществом слоев воды, прилежащих к адсорбенту, дальнейшая адсорбция определяется скоростью диффузии поглощаемого вещества к адсорбенту. Как известно, диффузия в жидкостях достаточно медленный процесс, поэтому для ускорения адсорбции прибегают к перемешиванию раствора.
Эти три особенности вносят значительные погрешности в изотерму адсорбции.
Поглощение растворённого вещества из раствора зависит от его строения.
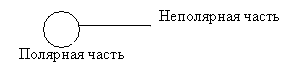
Рассмотрим поверхностно - активные, или дифильные (двояколюбящие), вещества .
Дифильные вещества состоят из двух частей:
полярной;
неполярной.
Поверхностно - активными веществами (ПАВ) являются следующие классы веществ:
спирты,
альдегиды,
карбоновые кислоты:
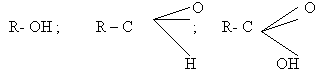
Углеводородные радикалы (CH3-; C2H5-; C17H35- и т.д) представляют собой неполярную часть ПАВ'а, которая может быть как угодно длинной.
Функциональные группы
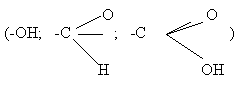
представляют полярную часть ПАВ'а. Примеры ПАВ'ов: олеиновая кислота (С17H33COOH), мыло (C17H35COONa).
Рассмотрим изменение поверхностного натяжения жидкости при увеличении в ней концентрации ПАВ'а, рис.6.

Рис.6
Молекулы ПАВ'а менее полярны, чем молекулы воды. Благодаря этому взаимодействие молекул воды между собой сильнее, чем молекул воды с молекулами ПАВ'а. В результате молекулы ПАВ'а будут вытесняться из раствора в поверхностный слой. Повышение концентрации третьего вещества в поверхностном слое, в частности, молекул ПАВ'а, приводит к понижению поверхностного натяжения.
Адсорбция из растворов электролитов
Адсорбция из растворов электролитов происходит на, так называемых, адсорбентах ионного строения, которыми служат труднорастворимые электролиты, например, Al (OH)3 Bi I3.
Адсорбенты ионного строения адсорбируют на своей поверхности или ионы, входящие в их кристаллическую решётку, или ионы, имеющие с ними близкое химическое строение.
AB = A+ + B-
Электролит АВ может адсорбировать на своей поверхности катионы A+ или анионы B-.
Золями называют такие коллоидно - дисперсные системы, в которых дисперсионной средой (т.е. растворителем) является вода.
Золи подразделяются на:
гидрофильные;
гидрофобные.
Гидрофильные золи образуются такими веществами, как крахмал, желатин, яичный желток и белок и многие краски.
Приготовление гидрофильных золей не требует специальных методов.
В гидрофильных золях вода играет двоякую роль: она является одновременно растворителем и стабилизатором. Молекулы воды, гидратируя частицы дисперсной фазы, не позволяют им подходить друг к другу и слипаться, т.е. они препятствуют процессу коагуляции. В этом заключается стабилизирующая роль воды. Гидрофобные золи образуются такими веществами, как трудно растворимые гидроксиды и соли, металлы, а также многие органические вещества.
Приготовление гидрофобных золей требует специальных методов.
Эти методы подразделяются на физические и химические.
И физические, и химические методы подразделяются на:
дисперсионные, т.е. разукрупняющие;
конденсационные, т.е. укрупняющие.
Физический дисперсионный метод , рис.7
Рис.7 |
Этим методом обычно получают золи металлов, как правило, благородных. В колбе находится раствор щёлочи децинормальной концентрации. В колбу введены электроды, выполненные из того метала, золь которого надо получить. К электродам подводится постоянное напряжение порядка 110 В. Один электрод закреплён неподвижно, а второй с помощью микровинта имеет вертикальное перемещение. Электроды сводят на такое расстояние, чтобы между ними возникла дуга, в пламени которой металл испаряется. |
В данной системе дисперсионной средой служит раствор щёлочи, дисперсной фазой - распылённый в дуге металл.
Дисперсные системы неустойчивы без третьего обязательного компонента - стабилизатора. Стабилизатором служат мельчайшие частицы оксида металла, которые образуются при распылении. Эти мельчайшие частицы оксида оседают на частицах металла, являясь стабилизатором. Оксиды металлов гидрофильны, молекулы воды из раствора образуют гидратную стабилизирующую систему.
Список литературы
1. Материаловедение: Учебник для вузов / Б.Н. Арзамасов, В.И. Макарова, Г.Г. Мухин и др.; Под общ. ред. Б.Н Арзамасова, Г.Г. Мухина. -3-е изд. стереотип. - М.: Изд-во МГТУ им. Н.Э. Баумана, 2002. - 648 с.
2. Ивасышин Г.С. Определение остаточных напряжений и релаксации их в деталях произвольной формы методом профилированной координатной сетки. Новые методы расчетов. Экспресс-информация «Межотраслевые вопросы науки и техники». - М.: ГОСИН-ТИ, 1979.-Вып. 11.-С. 1-4.
3. Способ определения релаксации остаточных напряжений в деталях: а. с. СССР №328324, МКИ G01 В5/30. Бюлл. изобр. -1972, №6 / Г.С. Ивасышин.
4. Основы трибологии (трение, износ, смазка): Учебник для техническихвузов.2-ое изд. перераб. и доп./ А.В. Чичинадзе, Э.Д. Браун, Н.А.Буше и др.; Под общ. ред.- А.В.Чичинадзе. - М.: Машиностроение, 2001. -г 664 с.
5. Гаркунов Д.Н. Триботехника (конструирование, изготовление и эксплуатация машин): Учебник: - 5-е изд., перераб. и доп. - М,: «Издательство МСХА», 2002. - 632 с.
6. Машков Ю.К., Полещенко К.Н., Поворазнкж С.Н., Орлов П.В. Трение и модифицирование материалов трибосистем. -М.: Наука, 2002. - 280 с.
7. Ивасышин Г.С. Методика исследования коэффициента Пуассона в процессе релаксации металлов//Известия вузов. -М.: Машиностроение, 1983. №4. - С. 137-140.
8. Ивасышин Г.С. Влияние упругого последействия материала шпинделей на сопротивление качению в шпиндельных опорах // Известия вузов. - М.: Машиностроение, 1987. №9.-С. 125-130.