
Лабораторная работа № 17 «Получение и коагуляция коллоидного раствора» Теоретическая часть
Системы, в которых вещество раздроблено до частиц 1…100 нм, находящихся в какой-либо среде (газ, жидкость, твердое тело) во взвешенном состоянии, называются коллоидными.
Для приготовления коллоидных растворов следует получить частицы размером от 1 до 100 нм, подобрать дисперсионную среду, в которой не растворяется вещество частиц, и обеспечить устойчивость частиц. В качестве вещества коллоидных частиц в водных средах служат металлы, оксиды, гидроксиды, сульфиды и другие малорастворимые соединения металлов и неметаллов.
Частицы соответствующих размеров получают либо измельчением крупных частиц, например на коллоидных мельницах, методом диспергирования, либо объединением (конденсацией) атомов, молекул, ионов.
К методам конденсации относятся чаще всего химические методы (реакция двойного обмена, гидролиз, окисление-восстановление и т.д.). Коллоидные растворы с водной дисперсионной средой называются золями.
Рассмотрим процесс возникновения коллоидных частиц на примере химической конденсации при образовании новой фазы в результате реакции обмена между раствором йодида калия, взятым в избытке, и раствором нитрата серебра:
![]()
При
этом в растворе образуются микрокристаллики
AgJ
большей или меньшей дисперсности. После
окончания реакции в растворе присутствуют
и ионы Ag+,
ионы J−;
их концентрации связаны произведением
растворимости
![]() .
Так как KJ
взят в избытке, то ионы J−
начнут переходить из раствора в твердую
фазу и занимать вакантные места,
достраивая кристаллическую решетку.
При этом твердая фаза приобретает
отрицательный заряд, а жидкая –
положительный. Избыточные катионы в
растворе (в данном случае – К+)
«подтянутся» к адсорбированным ионам
J−
вследствие кулоновского взаимодействия,
и на поверхности частиц
AgJ
образуется двойной электрический слой
(ДЭС).
.
Так как KJ
взят в избытке, то ионы J−
начнут переходить из раствора в твердую
фазу и занимать вакантные места,
достраивая кристаллическую решетку.
При этом твердая фаза приобретает
отрицательный заряд, а жидкая –
положительный. Избыточные катионы в
растворе (в данном случае – К+)
«подтянутся» к адсорбированным ионам
J−
вследствие кулоновского взаимодействия,
и на поверхности частиц
AgJ
образуется двойной электрический слой
(ДЭС).
Если
в указанной реакции обмена взять в
избытке раствор AgNO3,
то достраивать кристаллическую решетку
будут ионы серебра и твердая фаза
приобретет положительный заряд, а
достройку ДЭС будут осуществлять ионы
![]() .
В первом случае (избыток
КJ)
потенциалопределяющими ионами будут
J−,
а противоионами – ионы К+.
Во втором случае (избыток AgNO3)
потенциалопределяющими ионами будут
ионы Ag+,
а противоионами – ионы
.
В первом случае (избыток
КJ)
потенциалопределяющими ионами будут
J−,
а противоионами – ионы К+.
Во втором случае (избыток AgNO3)
потенциалопределяющими ионами будут
ионы Ag+,
а противоионами – ионы
![]()
Таким образом, заряд коллоидной частицы всегда определяется родственными ионами стабилизатора, способными достраивать кристаллическую решетку или преимущественно адсорбироваться на поверхности (правило Фаянса – Панета).
Частицу дисперсной фазы в микрогетерогенной системе вместе с двойным электрическим слоем называют мицеллой. Схематически строение мицеллы AgJ в избытке AgNO3 изображено на рисунке:
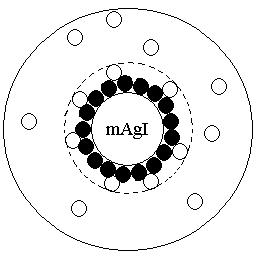
Внутри мицеллы находится кристалл, состоящий из молекул AgJ. Эту часть мицеллы, согласно терминологии, предложенной Н.П. Песковым, называют агрегатом, так как она состоит из агрегата атомов, молекул или ионов, образующих дисперсную фазу.
На поверхности кристалла адсорбируются ионы, в нашем случае ионы Ag+, достраивающие его кристаллическую решетку и придающие ему электрический заряд. Агрегат вместе с адсорбированными на нем потенциалопределяющими ионами образуют ядро мицеллы.
В непосредственной близости от ядра в адсорбированном слое находится часть противоионов , которые настолько прочно связаны силами электростатического и адсорбционного взаимодействия, что в электрическом поле они движутся совместно с ядром к катоду. Эти противоионы вместе с эквивалентным числом потенциалопределяющих ионов Ag+ формально можно рассматривать как недиссоциированные молекулы.
Ядро вместе с частью прочно связанных с ним противоионов называется коллоидной частицей. В отличие от электронейтральной мицеллы коллоидная частица имеет заряд. Остальные противоионы, находящиеся ближе к периферийной части мицеллы, образуют диффузный слой мицеллы. Из-за ослабления с увеличением расстояния кулоновских и адсорбционных сил ионы диффузионного слоя остаются относительно свободными и в электрическом поле, будут двигаться к аноду. Граница между диффузным слоем и собственно коллоидной частицей называется плоскостью, или границей скольжения, обозначенной на рисунке пунктирной линией.
Строение мицеллы можно также представить удобной для написания формулой. Например, для золя AgJ, межмолекулярной жидкостью, которой является слабый раствор AgNO3, можно написать следующую формулу:
![]()
 Ядро
Ядро
 Коллоидная
частица
Коллоидная
частица
Мицелла
Здесь m[AgJ] соответствует числу ионов Ag+ и J− , содержащихся в агрегате мицеллы; nAg+ – потенциалопределяющих ионов; (n – x) причем m >> n. В случае избытка KJ мицелла имеет строение
![]()
Следует отметить, что мицелла в этом случае будет заряжена отрицательно, так как согласно правилу Фаянса – Панета достройку кристалла будет осуществлять родственные ионы J− .
Ионогенная часть мицеллы может образовываться не только за счет адсорбции стабилизирующего электролита, содержащего родственные ионы. Стабилизация мицелл золей может происходить и за счет адсорбции индифферентного электролита. Например, добавление в систему металл – вода раствора NaCl приводит к избирательной адсорбции анионов Сl− на поверхности металла, и коллоидные частицы золя заряжаются в этом случае отрицательно.
Известны случаи, когда ионогенная часть мицеллы образуется из вещества самого агрегата: мицеллы золя кремнезема, мицеллы ПАВ.
В основе химической конденсации могут лежать не только обменные, но и окислительно-восстановительные реакции, реакции гидролиза и т.п.
Коллоидные растворы обладают кинетической устойчивостью благодаря броуновскому движению коллоидных частиц, которое препятствует оседанию частиц под влиянием силы тяжести. Агрегативная устойчивость коллоидных растворов возникает из-за наличия у коллоидных частиц одноименного электрического заряда, что сохраняет степень дисперсности и препятствует слипанию частиц, способствует образованию сольватной оболочки в растворах вокруг частиц.
Процесс потери агрегативной устойчивости и укрупнение частиц золя приводит к потере его кинетической устойчивости, которая выражается в образовании осадка в процессе коагуляции.
Коагуляция золей введением в коллоидный раствор электролитов определяется правилом значности Шульце-Гарди (1900 г.): коагулирующим действием обладает ион электролита, который имеет заряд, противоположный заряду гранулы (коллоидной частицы); коагулирующее действие тем сильнее, чем выше заряд иона-коагулятора.
