
- •88.Аминокислоты. Структура. Номенклатура. Хим. Свойства.
- •90. Окислительное расщепление аминокислот в химических и биохимических процессах (трансаминирование, дезаминирование и декарбоксилирование), биологическая роль продуктов этих реакций.
- •93. Днк. Нуклеотидный состав и структура днк. Работы э. Чергаффа, д. Уотсона и ф. Крика. Физико-химические свойства днк.
- •94. Рнк. Типы рнк. Первичная, вторичная и третичная структура рнк. Роль т-рнк в биосинтезе белка.
- •95. Динуклеотиды: над, надф и фад. Их биологические функции.
- •96.Моно-, олиго- и полинуклеотиды. Структура нуклеозидов и нуклеотидов. Нуклеозид ди- и трифосфаты. Атф: строение и роль в энергетическом обмене.
- •97. Представление о метаболизме липидов. Жирные кислоты, входящие в состав липидов, и их окисление в организме.
- •98.Липиды. Жирные кислоты.
- •99.Биологические мембраны
- •Монос-ды. Клас-я, стереохимия, таутомерия, хим-е св-ва по гидроксильной/ым и карбонильным гр-пам, специфич-е св-ва. Важнейшие предст-ли монос-в и их биолог-я роль.
- •101. Полисахариды. Крахмал и гликоген, их строение. Понятие о катаболизме полисахаридов в организме. Целлюлоза, строение и свойства. Химическая переработка целлюлозы и применение ее производных.
- •102. Представление о классификации и строении витаминов, гормонов, простаноидов. Их биологическая роль. Использование в медицине и сельском хозяйстве.
- •103. Понятие об изопреноидах. Натуральный и синтетический каучуки.
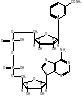
94. Рнк. Типы рнк. Первичная, вторичная и третичная структура рнк. Роль т-рнк в биосинтезе белка.
 Строение
молекул РНК во многом сходно со строением
молекул ДНК. Однако имеется и ряд
существенных отличий. В
молекуле РНК вместо дезоксирибозы в
состав нуклеотидов входит рибоза,
вместо тимидилового нуклеотида (Т) —
уридиловый (У). Главное отличие от ДНК
состоит в том, что молекула РНК
представляет собой одну цепь. Цепочки
РНК значительно короче ДНК.
Строение
молекул РНК во многом сходно со строением
молекул ДНК. Однако имеется и ряд
существенных отличий. В
молекуле РНК вместо дезоксирибозы в
состав нуклеотидов входит рибоза,
вместо тимидилового нуклеотида (Т) —
уридиловый (У). Главное отличие от ДНК
состоит в том, что молекула РНК
представляет собой одну цепь. Цепочки
РНК значительно короче ДНК.
В клетке существует несколько видов РНК, которые различаются по величине молекул, структуре, расположению в клетке и функциям:
1. Информационная (матричная) РНК(иРНК). Этот вид наиболее разнороден по размерам и структуре. иРНК представляет собой незамкнутую полинуклеотидную цепь. Она синтезируется в ядре при участии фермента РНК-полимеразы, комплементарна участку ДНК, на котором происходит ее синтез. Несмотря на относительно низкое содержание (3—5% РНК клетки), она выполняет важнейшую функцию в клетке: служит в качестве матрицы для синтеза белков, передавая информацию об их структуре с молекул ДНК. Каждый белок клетки кодируется специфической иРНК, поэтому число их типов в клетке соответствует числу видов белков.
2. Рибосомная РНК (рРНК). Это одноцепочечные нуклеиновые кислоты, образующие в комплексе с белками рибосомы — органеллы, на которых происходит синтез белка. Рибосомные РНК синтезируются в ядре. Информация об их структуре закодирована в участках ДНК, которые расположены в области вторичной перетяжки хромосом. Рибосомные РНК составляют 80% всей РНК клетки, поскольку в клетке имеется огромное количество рибосом. Рибосомные РНК обладают сложной вторичной и третичной структурой, образуя петли на комплементарных участках, что приводит к самоорганизации этих молекул в сложное по форме тело. В состав рибосом входит три типа рРНК у прокариот и четыре типа рРНК у эукариот.
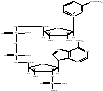
3. Транспортная РНК (тРНК). Молекула тРНК состоит в среднем из 80 нуклеотидов. Содержание тРНК в клетке — около 15% всей РНК. Функция тРНК — перенос аминокислот к месту синтеза белка. Число различных типов тРНК в клетке невелико (20—60). Все они имеют сходную пространственную организацию. Благодаря внутрицепочечным водородным связям молекула тРНК приобретает характерную вторичную структуру, называемую клеверным листом. Трехмерная же модель тРНК выглядит несколько иначе. В тРНК выделяют четыре петли: акцепторную (служит местом присоединения аминокислоты), антикодоновую (узнает кодон в иРНК в процессе трансляции) и две боковые.
95. Динуклеотиды: над, надф и фад. Их биологические функции.
В переносе электронов от субстратов к молекулярному кислороду прин-ют уч-е: 1) пиридинзависимые дегидрогеназы коферментами служат либо НАД, либо НАДФ; 2) флавинзависимые дегидрогеназы (флавиновые ферменты), у кот-х роль простетической группы играют ФАД.
Пиридинзависимые дегидрогеназы: относ-ся большая гр-па ферментов, кот-е катализ-ют восст-е НАД+ и НАДФ разл-ми орг-ми субстратами. Коферменты НАД и НАДФ явл-ся динуклеотидами, в кот-х мононукл-ды связаны между собой через остатки фосфорной к-ты. В состав одного из нуклеотидов вх-т амид никотиновой к-ты (вит-н РР}, др-й предст-ет собой АМФ. В мол-ле НАДФ им-ся еще один остаток фосфорной к-ты, присоед-й к рибозе АМФ в положении 2'.
Никотинамидадениндинуклетид (НАД+) Никотинамидадениндинуклетидфосфат (НАДФ+)
Катализируемые пиридинзависимыми дегидрогеназами реакции можно отобразить так:
С убстрат-
Н2 + НАД(Ф)+↔субстрат + НАД(Ф)Н
+ Н+
убстрат-
Н2 + НАД(Ф)+↔субстрат + НАД(Ф)Н
+ Н+
Спос-сть НАД+ и НАДФ+ играть роль промежут-го переносчика водорода связана с нал-ем в их стр-ре амида никотиновой к-ты. В электронно-протонной форме обратимое гидрирование — дегидрирование (присоед-е и отдача протонов электронов) этих коферментоз может быть предст-но с пом-ю след-го ур-я:
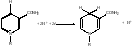
НАД+ НАДН
При переносе 2х восст-х эквивалентов от субстрата на НАД~ один из них вкл-ся в восст-й кофермент в виде водорода, а др-й — в виде электрона. Свободный ион Н+ ост-ся в среде. Для простоты обозначения обычно восст-е формы НАД и НАДФ изображают символами НАДН-- и НАДФ Н 2.
Окисленные и восст-е формы пиридиннуклеотидных коферментов обладают разл-ми спектрами поглощ-я в УФ-области. Это св-во данных коферментов позволяет исп-ть спектрофотометрические методы анализа для быстрого колич-го опр-я ряда субстратов — доноров водорода, а также иссл-я акт-сти НАД- и НАДФ-зависимых дегидрогеназ.
Биол-е значение:в кл-х НАД-зависимые дегидрогеназы преимущ-но участвуют в процессах, связанных с переносом электронов и протонов от органических субстратов к кислороду. В свою очередь НАДФ-зависимые дегидрогеназы играют существенную роль в реакциях биосинтеза (например, высших жирных кислот, стеринов и др.). В соответствии с этим коферменты НАД и НАДФ различаются по своей внутриклеточной локализации: НАД концентрируется главным образом в митохондриях, а большая часть НАДФ находится в цитоплазме (цитозоле) клеток.
Некоторые дегидрогеназы присутствуют как в цитоплазме, так и в митохондриях клетки. Цитоплазматические дегидрогеназы способны взаимодействовать только с теми пиридиновыми нуклеотидами (коферментами), которые находятся в цитозоле. Митохондриальные дегидрогеназы обычно взаимодействуют только с пиридиновыми нуклеотидами, которые локализованы в матриксе митохондрий. Заметим, что цитозольный и митохондриальный пулы НАД и НАДФ отделены друг от друга митохондриальной мембраной, которая для этих коферментов непроницаема. •
Флавиновые ферменты
Следующим акцептором атомов водорода является группа флавиновых ферментов, которые содержат в качестве кофермента (простетической группы) одно из двух производных витамина В; (рибофлавина): флавин-адениндинуклеотид (ФАД).
ФАД очень прочно, в отличие от коферментов НАД и НАДФ присоединены к ферменту (точнее, к апоферменту) и не отщепляются от него ни на одной из стадий (ФАД)
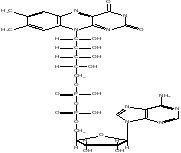
Флавинадениндинуклеотид (ФАД)
В некоторых случаях (например, при окислении сукцината или жирных кислот) флавиновые ферменты могут играть роль первичных дегидрогеназ, т. е. прямо, без участия НАД и НАДФ-зависимых дегидрогеназ, принимать электроны и протоны при окислении субстратов. Таким ферментом, в частности, является СДГ. Коферментом СДГ служит ФАД.
Активной частью молекулы ФАД или ФМН является изоаллоксазиновое кольцо рибофлавина, к .атомам азота которого могут присоединяться два атома водорода, т. е. два электрона и два протона.
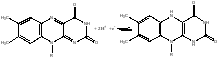
Многие из флавиновых дегидрогеназ являются сложными олигомерными образованиями. Установлено, что флавиновый фермент тесно связан с железосерным белком участвующим в передаче электронов и протонов на кофермент Q. Железо-серные белки имеют небольшую молекулярную массу порядка 10 000 Да и содержат несколько атомов негемового железа. Эти атомы собраны в несколько групп, в которых они объединены с равным числом атомов серы.
