
- •88.Аминокислоты. Структура. Номенклатура. Хим. Свойства.
- •90. Окислительное расщепление аминокислот в химических и биохимических процессах (трансаминирование, дезаминирование и декарбоксилирование), биологическая роль продуктов этих реакций.
- •93. Днк. Нуклеотидный состав и структура днк. Работы э. Чергаффа, д. Уотсона и ф. Крика. Физико-химические свойства днк.
- •94. Рнк. Типы рнк. Первичная, вторичная и третичная структура рнк. Роль т-рнк в биосинтезе белка.
- •95. Динуклеотиды: над, надф и фад. Их биологические функции.
- •96.Моно-, олиго- и полинуклеотиды. Структура нуклеозидов и нуклеотидов. Нуклеозид ди- и трифосфаты. Атф: строение и роль в энергетическом обмене.
- •97. Представление о метаболизме липидов. Жирные кислоты, входящие в состав липидов, и их окисление в организме.
- •98.Липиды. Жирные кислоты.
- •99.Биологические мембраны
- •Монос-ды. Клас-я, стереохимия, таутомерия, хим-е св-ва по гидроксильной/ым и карбонильным гр-пам, специфич-е св-ва. Важнейшие предст-ли монос-в и их биолог-я роль.
- •101. Полисахариды. Крахмал и гликоген, их строение. Понятие о катаболизме полисахаридов в организме. Целлюлоза, строение и свойства. Химическая переработка целлюлозы и применение ее производных.
- •102. Представление о классификации и строении витаминов, гормонов, простаноидов. Их биологическая роль. Использование в медицине и сельском хозяйстве.
- •103. Понятие об изопреноидах. Натуральный и синтетический каучуки.
Монос-ды. Клас-я, стереохимия, таутомерия, хим-е св-ва по гидроксильной/ым и карбонильным гр-пам, специфич-е св-ва. Важнейшие предст-ли монос-в и их биолог-я роль.
Монос-ды предст-ют собой соед-я со смешанными функц-ми. Они сод-т альдегидную или ке-тогруппу и неск-ко гидроксильных групп, т. е. явл-ся альдегидоспиртами или кетоноспиртами. Следов-но, углеводы явл-ся полигидроксикарбонильными соед-ми.
Монос-ды с альдегидной группой наз-ся альдозами, с кетогруппой — кетозами. По числу углеродных атомов в мол-ле монос-ды дел-ся на тетрозы, пентозы, гексозы и т. д..
Альдозы и кетозы с один-м числом атомов углерода изомерны между собой. Наибольшее значение среди монос-в имеют гексозы и пентозы.
Структура моносахаридов. Для изобр-я строения монос-в исп-ют проекционные формулы Фишера. Циклические формы принято изображать перспективными формулами Хеуорса.
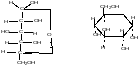
Физ-е св-ва: Монос-ды – бесцв-е кристал-е в-ва, сладкие на вкус, хор. раствор-е в воде, нераствхе в эфире, плохо раствхе в спирте. Сладость моносх-в различна. Напр., фруктоза слаще глюкозы в 3 раза.
Хим-е св-ва: Монос-ды — это соед-я со смешанными функц-ми. В раств-х сущ-ет динамич-е равновесие между неск-ми таутомерными формами монос-в, поэтому в зав-сти от усл-й и реагентов они могут реагир-ть в открытой или циклич-й форме. При этом равновесие смещ-ся в сторону образ-я той формы, кот-я вступает во взаимод-е. Химе свва моносахв обуслны налем: а) карбонильной грпы в открытых формах монос-в; б) спиртовых гидроксильных групп как в откр-х, так и в циклич-х формах монос-в; в) полуацетальной гидрокс-й группы в циклич-х формах монос-в.
1. Р-ции с уч-ем альдегидной группы глюкозы (т. е. свойства глюкозы как альдегида).
Восстановление (гидрирование) с обр-ем многоат-го спирта:
CH2-(CHOH)4-COH + H2 →Ni CH2-(CHOH)4-CH2OH
2. Окисление: Глюкоза легко окисл-ся. В зав-сти от хар-ра ок-лей получ-ся разл-е прод-ты. 1) Ок-е под действием слабых (мягких) ок-лей с обр-ем глюконовой к-ты. К таким р-циям отн-ся кач-е р-ции на глюкозу как альдегид: р-ция с аммиачным р-ром оксида серебра (I) Ag2O (р-ция «серебряного зеркала») и реакция с Си(ОН)2 в щелочной среде при нагревании:
Глюкоза + Ag2O →NH4OH CH2OH-(CH-OH)4-COOH + 2Ag глюконовая к-та
2) Ок-е под действием сильных ок-лей (напр., HNO3) с обр-ем двухосновной глюкаровой к-ты:
Глюкоза + HNO3 = COOH-(CH-OH)4-COOH глюкаровая кислота
II. Р-ции глюкозы с уч-ем гидроксилъных групп (т. е. св-ва глюкозы как многоат-го спирта):
Взаимод-е с Си(ОН)2 на холоду с обр-ем глюконата меди (II) (кач-я р-ция на глюкозу как многоат-ый спирт).
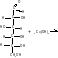

Взаимод-е с ангидридами или галогенангидрида-ми к-т (
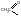 )
с обр-ем сложных
эфиров
)
с обр-ем сложных
эфировВзаимод-е с галогеналканами с обр-ем простых эфиров:
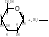
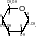
Взаимодействие со спиртами с образованием гликозидов/
III. Брожение (ферментация) монос-в: это расщепл-е монос-в под влиянием биолог-х кат-в — ферм-в, вырабат-мых микроорг-ми. Разные микроорг-мы выз-ют разл-е виды брожения. Название вида брожения опр-ся назв-ем образ-хся прод-в брожения. Брожение — сложный многост-й биохим-й процесс. Суммарные уравнения разл-х типов брожения глюкозы.
Спиртовое брожение: С6Н12О6 = 2С2Н5ОН + 2СО2
Маслянокислое брожение: С6Н12О6 = СН3-СН2-СН2-СООН + 2Н2+ 2СО2
Молочнокислое брожение: C6H12O6 = ферменты= 2 СH3-CHOH-COOH
Лимоннокислое брожение:C6H12O6 +3[O]=ферменты= HOOC-CH2-COHCOOH-COOH + 2H2O
Получение и применение глюкозы
В промышленности глюкозу получают гидролизом крахмала и целлюлозы.
