
- •88.Аминокислоты. Структура. Номенклатура. Хим. Свойства.
- •90. Окислительное расщепление аминокислот в химических и биохимических процессах (трансаминирование, дезаминирование и декарбоксилирование), биологическая роль продуктов этих реакций.
- •93. Днк. Нуклеотидный состав и структура днк. Работы э. Чергаффа, д. Уотсона и ф. Крика. Физико-химические свойства днк.
- •94. Рнк. Типы рнк. Первичная, вторичная и третичная структура рнк. Роль т-рнк в биосинтезе белка.
- •95. Динуклеотиды: над, надф и фад. Их биологические функции.
- •96.Моно-, олиго- и полинуклеотиды. Структура нуклеозидов и нуклеотидов. Нуклеозид ди- и трифосфаты. Атф: строение и роль в энергетическом обмене.
- •97. Представление о метаболизме липидов. Жирные кислоты, входящие в состав липидов, и их окисление в организме.
- •98.Липиды. Жирные кислоты.
- •99.Биологические мембраны
- •Монос-ды. Клас-я, стереохимия, таутомерия, хим-е св-ва по гидроксильной/ым и карбонильным гр-пам, специфич-е св-ва. Важнейшие предст-ли монос-в и их биолог-я роль.
- •101. Полисахариды. Крахмал и гликоген, их строение. Понятие о катаболизме полисахаридов в организме. Целлюлоза, строение и свойства. Химическая переработка целлюлозы и применение ее производных.
- •102. Представление о классификации и строении витаминов, гормонов, простаноидов. Их биологическая роль. Использование в медицине и сельском хозяйстве.
- •103. Понятие об изопреноидах. Натуральный и синтетический каучуки.
90. Окислительное расщепление аминокислот в химических и биохимических процессах (трансаминирование, дезаминирование и декарбоксилирование), биологическая роль продуктов этих реакций.
Процесс отщепления карбоксильной группы аминокислот в виде СО2 получил название декарбоксилирования. Несмотря на ограниченный круг аминокислот и их производных, подвергающихся декарбоксилированию в животных тканях, образующиеся продукты реакции – биогенные амины – оказывают сильное фармакологическое действие на множество физиологических функций человека и животных. В животных тканях установлено декарбоксилирование следующих аминокислот и их производных: тирозина, триптофана, 5-окситриптофана, валина, серина, гистидина, глу-таминовой и γ-оксиглутаминовой кислот, 3,4-диоксифенилаланина, цис-теина, аргинина, орнитина, S-аденозилметионина и α-аминомалоновой кислоты. Помимо этого, у микроорганизмов и растений открыто де-карбоксилирование ряда других аминокислот.
В живых организмах открыты 4 типа декарбоксилирования аминокислот:
1. α-Декарбоксилирование, характерное для тканей животных, при котором от аминокислот отщепляется карбоксильная группа, стоящая по соседству с α-углеродным атомом. Продуктами реакции являются СО2 и биогенные амины:
![]()
2. ω-Декарбоксилирование, свойственное микроорганизмам. Например, из аспарагиновой кислоты этим путем образуется α-аланин:
![]()
3. Декарбоксилирование, связанное с реакцией трансаминирования:
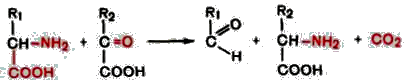
В этой реакции образуются альдегид и новая аминокислота, соответствующая исходной кетокислоте.
4. Декарбоксилирование, связанное с реакцией конденсации двух молекул:
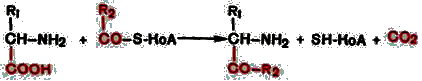
Эта реакция в тканях животных осуществляется при синтезе δ-амино-левулиновой кислоты из глицина и сукцинил-КоА и при синтезе сфинголипидов, а также у растений при синтезе биотина.
Реакции декарбоксилирования в отличие от других процессов промежуточного обмена аминокислот являются необратимыми. Они катализируются специфическими ферментами – декарбоксилазами аминокислот, отличающимися от декарбоксилаз α-кетокислот как белковым компонентом, так и природой кофермента. Декарбоксилазы аминокислот состоят из белковой части, обеспечивающей специфичность действия, и простетической группы, представленной пиридоксальфосфатом (ПФ), как и у трансаминаз.
Механизм
реакции декарбоксилирования
аминокислот
в соответствии с общей теорией
пиридоксалевого катализа
сводится к образованию ПФ-субстратного
комплекса, представленного, как и в
реакциях трансаминирования,
шиффовым
основанием ПФ и аминокислоты:
Реакции по карбоксильной группе:
В живых организмах эта реакция протекает под воздействием ферментов─ декарбоксилаз:
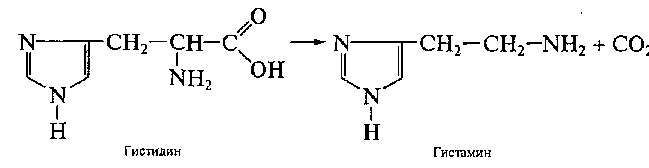
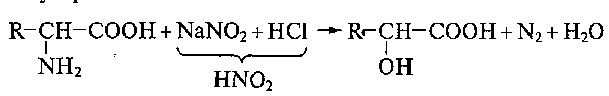
Возможно гидролитическое дезаминирование аминокислот:
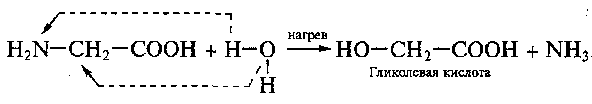
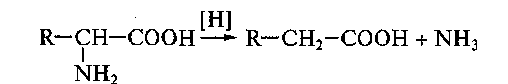
91,92. Белки. Первичная стр-ра. Биолог-е значение аминок-й последоват-сти. Расшифровка первичной стр-ры белков. Структурные ур-ни в архитектуре и простр-й орг-ции белков. Классиф-я белков по пространственному строению.
Белки – это высокомолек. cоед-я (полипептиды), мол-лы которых представлены 20-ю альфа – ам-кислотами, соед-ми пептидными связями – СО - NН
Сущ-т:Прост. белки – сост-е из одних аминок-т. Напр., растит. белки – проламины, белки кров. плазмы – альбулины и глобулины. Сложн. белки – помимо аминокислот им-т в св. сост. другие орг-е соед-я (нукл. кислоты, липиды, углеводы), соед-я фосфора, металлы. Им. сложн. названия нуклеопротеиды, гликопротеиды и т. д.
Простейш. аминокислота – глицин NH2 – CH2 – COOH.
Но разн. ам-кислоты могут содержать различные радикалы CH3 – CHNH2 –COOH-H – O - - CH2 – CHNH2 – COOH
Структура белков. Обр-е линейных мол-л белков происходит в рез-те соед-я ам-кислот друг с другом. Карбокс. группа одной ам-кислоты сближ-ся с аминогруппой другой, и при отщеплении мол-лы воды между аминокислотными остатками возникает прочная ковал. связь, наз-я пептидной.
Под первичной стр-рой подразум-т порядок, послед-ть располож-я аминокислотных ост-ков в полипептидной цепи. К настоящ. времени расшифр-на первичная структура десятков тысяч разных белков, (инсулина (51 аминокислотный остаток), миоглобина человека (153 аминокислотных остатка), гемоглобина человека, цитохрома С из сердечной мышцы человека (104), лизоцима молока человека (130), химотрипсиногена быка (245) и мн. др. белков, в т. ч. ферментов и токсинов. Если в состав белка входит неск. полипептидных цепей, объед-х в одну белковую мол-лу посредством дисульф. связей и нековал. взаимод-й, или если одна полипептидная цепь сод-т внутренние дисульф. связи, то задача опред-я первичной структуры несколько осложняется, так как необх. предв-ое разъед-ние эт. цепей и связей.
Выводы:
1. Первич. стр-ра белков уникальна и детерм-на генетически. Каждый индивид-й гомогенный белок хар-ся уникальной послед-ю аминокислот: частота замены аминокислот привод. не только к структ-ным перестройкам, но и к изм-м физ.-хим. св-в и биол-х функций.
2. Стабиль-ть первичной структуры обесп-ся в осн. пептидными связями; возм-но участие небольшого числа дисульф. связей.
3. В полипептидной цепи могут быть обнаружены разнообр-е комбинации аминокислот; в полипептидах относ-но редки повторяющиеся послед-ти.
4. В некоторых ферментах, обл-х близ-ми каталитич-ми св-ми, встреч-ся идентичные пептидные стр-ры, содерж-е неизм-е участки и вариабельные послед-ти аминокислот, особ. в областях их активных центров. Этот принцип структ-го подобия наиб. типичен для ряда протеолитических ферментов: трипсина, химотрипсина и др.
5. В первичной структуре полипептидной цепи детерм-ны вторич., третич. и четвертич. стр-ры белковой мол-лы, опред-щие ее общую пространст-ю конформацию.
Расшифровка первичной структуры белка
Для опред-я первич-й стр-ры отдельной, хим-ки гомогенной полипептидной цепи в первую очередь м-дами гидролиза выясняют аминокислотный состав, точнее, соотн-е каждой из 20 аминокислот в образце гомогенного полипептида. Затем приступ. к опред-ю хим. природы концевых аминокислот полипептидной цепи, содержащей одну своб. NH2-группу и одну своб. СООН-группу.
Классификация белков по пространственному строению. Исходя из особ-й вторич-й и третич-й стр-ры. В соотв. с этим различ-т α-, β-, α+β- и α/β-белки. α-Белки сод-т только α-спирали (не менее 60%), β-белки – только β-стр-ры (не менее двух антипаралл-х цепей), α+β-белки – те и др-е стр-ры в пред-х одной полипептидной цепи (пример – молекулы лизоцима), а класс α/β-белков сод-т множ-во α- и β-структур, черед-ся вдоль полипептидной цепи или домена. Домены создаются объединением и чередованием α-спиралей и β-слоев, между которыми откр-ся более рыхлые стр-ры.
