
Курсовая робота по химии
На тему:
«Галогены»
Ученика 10-Ж классу
ФТЛ при ХНТУ та ДНУ
Корнеева Олега
План
Общая характеристика
понятия про галогены, их положения в П.С.
Строения атомов, степень окисления, окисления
Физические свойства
Химические свойства
Добыча и применение
Вывод
Общая Характеристика
1.1
Галогены (от греч. halos - соль и genes - образующий) - элементы главной подгруппы VII группы периодической системы: фтор, хлор, бром, йод, астат.
Символ элемента
|
F |
Cl |
Br |
I |
At |
Порядковый номер
|
9 |
17 |
35 |
53 |
85 |
Строение внешнего электронного слоя
|
2s22p5 |
3s23p5 |
4s24p5 |
5s25p5 |
6s26p5 |
Энергия ионизации, эВ
|
17,42 |
12,97 |
11,84 |
10,45 |
~9,2 |
Сродство атома к электрону, эВ
|
3,45 |
3,61 |
3,37 |
3,08 |
~2,8 |
Относительная электроотрицательность (ЭО)
|
4,0 |
3,0 |
2,8 |
2,5 |
~2,2 |
Радиус атома, нм
|
0,064 |
0,099 |
0,114 |
0,133 |
– |
Межъядерное расстояние в молекуле Э2, нм
|
0,142 |
0,199 |
0,228 |
0,267 |
– |
Энергия связи в молекуле Э2 (25°С), кДж/моль
|
159 |
243 |
192 |
157 |
109 |
Степени окисления
|
-1 |
-1, +1, +3, +4, +5, +7 |
-1, +1, +4, +5, +7 |
-1, +1, +3, +5, +7 |
– |
Агрегатное состояние
|
Бледно-зел. газ |
Зел-желт. газ |
Бурая жидкость |
Темн-фиол. кристаллы |
Черные кристаллы |
t°пл.(°С)
|
-219 |
-101 |
-8 |
114 |
227 |
t°кип.(°С)
|
-183 |
-34 |
58 |
185 |
317 |
(г*см-3 )
|
1,51 |
1,57 |
3,14 |
4,93 |
– |
Растворимость в воде (г / 100 г воды)
|
реагирует с водой |
2,5 : 1 по объему |
3,5 |
0,02 |
– |
1) Общая электронная конфигурация внешнего энергетического уровня - nS2nP5.
2) С возрастанием порядкового номера элементов увеличиваются радиусы атомов, уменьшается электроотрицательность, ослабевают неметаллические свойства (увеличиваются металлические свойства); галогены - сильные окислители, окислительная способность элементов уменьшается с увеличением атомной массы.
3) Молекулы галогенов состоят из двух атомов.
4) С увеличением атомной массы окраска становится более темной, возрастают температуры плавления и кипения, а также плотность.
5) Сила галогеноводородных кислот возрастает с увеличением атомной массы.
6) Галогены могут образовывать соединения друг с другом (например, BrCl)
1.2
Они легко присоединяют по одному электрону, проявляя степень окисления -Такую степень окисления галогены имеют в соединениях с водородом и металлами.
Однако атомы галогенов, кроме фтора, могут проявлять и положительные степени окисления : +1, +3, +5, +7. Возможные значения степеней окисления объясняются электронным строением, которое у атомов фтора можно представить схемой
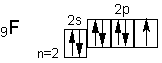
Будучи наиболее электроотрицательным элементом, фтор может только принимать один электрон на 2р-подуровень.У него один не спаренный электрон, поэтому фтор бывает только одновалентным, а степень окисления всегда -1.
Электронное строение атома хлора выражается схемой

У атома хлора один не спаренный электрон на 3р-подуровне и обычном (невозбужденном) состоянии хлор одновалентен. Но поскольку хлор находится в третьем периоде, то у него имеется еще пять орбиталей 3d-подуровня,в которых могут разместиться 10 электронов.
В возбужденном состоянии атома хлора электроны переходят с 3p - и 3s-подуровней на 3d-подуровень(на схеме показано стрелками). Разъединение (распаривание) электронов, находящихся в одной орбитали,увеличивает валентность на две единицы. Очевидно, хлор и его аналоги (кроме фтора)могут проявлять лишь нечетную переменную валентность 1, 3, 5, 7и соответствующие положительные степени окисления. У фтора нет свободных орбиталей, а значит, при химических реакциях не происходит разъединения спаренных электронов в атоме. Поэтому при рассмотрении свойств галогенов всегда надо учитывать особенности фтора и соединений.
Водные растворы водородных соединений галогенов являются кислотами: НF — фтороводородная (плавиковая),НСl — хлороводородная (соляная), НВr — бромводородная, НI — йодоводородная.
Физические свойства
Название элемента |
Год открытия |
Агрегатное состояние |
Температура Плавления |
Температура кипения |
Цвет |
|||
Фтор F2 |
А.Муассан в 1886 г. |
Газ |
-219C |
-183C. |
светло-желтый |
|||
Хлор Cl2 |
К. Шееле в 1774 г. |
Газ |
-101C |
-34°С. |
желто-зеленый |
|||
Бром Br2 |
Ж.Баларом в 1826 г |
Жидкость
|
-8C |
58C. |
Бурая |
|||
Йод I2
|
Б. Куртуа в 1811 г. |
Жидкость |
114C |
185C |
темно-фиолетовый |
|||
Аста́т At |
Д. Корсон, К. Макензи, Э. Сегре 1940 |
Твердое Вещество |
302 °C |
337 °C. |
сине-чёрный |
|||
Фтор
Бледно-жёлтый газ, в малых концентрациях запах напоминает одновременно озон и хлор, очень агрессивен и ядовит.
Фтор имеет аномально низкую температуру кипения (плавления). Это связано с тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (кратность связи в остальных галогенах примерно 1,1)
Хлор
Газообразный хлор относительно легко сжижается. Начиная с давления в 0,8 МПа (8 атмосфер), хлор будет жидким уже при комнатной температуре. При охлаждении до температуры в −34 °C хлор тоже становится жидким при нормальном атмосферном давлении. Жидкий хлор — жёлто-зелёная жидкость, обладающая очень высоким коррозионным действием (за счёт высокой концентрации молекул). Повышая давление, можно добиться существования жидкого хлора вплоть до температуры в +144 °C (критической температуры) при критическом давлении в 7,6 МПа.
При температуре ниже −101 °C жидкий хлор кристаллизуется в орторомбическую решётку с пространственной группой Cmca и параметрами a=6,29 Å b=4,50 Å, c=8,21 Å[7]. Ниже 100 К орторомбическая модификация кристаллического хлора переходит втетрагональную, имеющую пространственную группу P42/ncm и параметры решётки a=8,56 Å и c=6,12 Å[7].
Бром
При обычных условиях бром — красно-бурая жидкость с резким неприятным запахом, ядовит, при соприкосновении с кожей образуются ожоги. Бром — одно из двух простых веществ (и единственное из неметаллов), наряду со ртутью, которое при комнатной температуре является жидким. Плотность при 0 °C — 3,19 г/см³. Температура плавления (затвердевания) брома −7,2 °C, кипения 58,8 °C, при кипении бром превращается из жидкости в буро-коричневые пары, при вдыхании раздражающие дыхательные пути. Стандартный электродный потенциал Br2/Br− в водном растворе равен +1,065 В.
Обычный бром состоит из изотопов 79Br (50,56 %) и 81Br (49,44 %). Искусственно получены радиоактивные изотопы.
Йод
Природный иод состоит только из одного изотопа — иода-127. Конфигурация внешнего электронного слоя 5s2p5. В соединениях проявляет степени окисления −1, 0, +1, +3, +5 и +7 (валентности I, III, V и VII).
Радиус нейтрального атома иода 0,136 нм, ионные радиусы I−, I5+ и I7+ равны, соответственно, 0,206; 0,058-0,109; 0,056-0,067 нм. Энергии последовательной ионизации нейтрального атома иода равны, соответственно: 10,45; 19,10; 33 эВ. Сродство к электрону −3,08 эВ. По шкале Полинга электроотрицательность иода 2,66, иод принадлежит к числу неметаллов.
Иод при обычных условиях — твердое чёрно-серое вещество с металлическим блеском и специфическим запахом. Пары имеют характерный фиолетовый цвет, так же, как ирастворы в неполярных органических растворителях, например в бензоле — в отличие от бурого раствора в полярном спирте. Иод при комнатной температуре представляет собой темно-фиолетовые кристаллы со слабым блеском. При нагревании при атмосферном давлении он сублимируется (возгоняется), превращаясь в пары фиолетового цвета; при охлаждении пары иода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки иода от нелетучих примесей.
Астат
Ввиду малого количества доступного для изучения вещества, физические свойства этого элемента плохо изучены и, как правило, построены на аналогиях с более доступными элементами.
Астат — твёрдое вещество сине-чёрного цвета, по внешнему виду похожее на иод[5]. Для него характерно сочетание свойств неметаллов (галогенов) и металлов (полоний, свинец и другие). Как и иод, астат хорошо растворяется в органических растворителях и легко ими экстрагируется. По летучести немного уступает иоду, но также может легко возгоняться[5].
Температура плавления 302 °C, кипения (возгонки) 337 °C.
Химические свойства
Все галогены проявляют высокую окислительную активность, которая уменьшается при переходе от фтора к йоду. Фтор — самый активный из галогенов, реагирует со всеми металлами без исключения, многие из них в атмосфере фтора самовоспламеняются, выделяя большое количество теплоты, например:
2Аl + 3F2 = 2АlF3 + 2989 кДж,
2Fе + 3F2 = 2FеF3 + 1974 кДж.
Без нагревания фтор реагирует и со многими неметаллами (H2, S, С, Si, Р)— все реакции при этом сильно экзотермические, например:
Н2 + F2 = 2НF + 547 кДж,
Si + 2F2 = SiF4(г) + 1615 кДж.
При нагревании фтор окисляет все другие галогены по схеме
Hal2 + F2 = 2НаlF
где Наl = Сl, Вr, I, причем в соединениях НаlF степени окисления хлора, брома и иода равны +1.
Наконец, при облучении фтор реагирует даже с инертными (благородными) газами:
Хе + F2 = ХеF2 + 152 кДж.
Взаимодействие фтора со сложными веществами также протекает очень энергично. Так, он окисляет воду, при этом реакция носит взрывной характер:
3F2 + ЗН2О = F2О↑ + 4НF + Н2О2.
Свободный хлор также очень реакционно способен, хотя его активность и меньше, чем у фтора. Он непосредственно реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов. Для сравнения приведем уравнения реакций хлора с теми же простыми веществами, что и для фтора:
2Аl + ЗСl2 = 2АlСl3(кр) + 1405 кДж, 2Fе + ЗСl2 = 2АlСl3(кр) + 804 кДж,
Si + 2Сl2 = SiCl4(Ж) + 662 кДж, Н2 + Сl2 = 2НСl(г)+185кДж.
Особый интерес представляет реакция с водородом. Так, при комнатной температуре,без освещения хлор практически не реагирует с водородом, тогда как при нагревании или при освещении (например, на прямом солнечном свету) эта реакция протекает со взрывом по приведенному ниже цепному механизму:
Cl2 + hv → 2Сl,
Сl + Н2 → НСl + Н,
Н + Cl2 → НСl + Сl,
Сl + Н2 → НCl + Н и т.д.
Возбуждение этой реакции происходит под действием фотонов (hv),которые вызывают диссоциацию молекул Сl2 на атомы — при этом возникает цепь последовательных реакций,в каждой из которых появляется частица, инициирующая начало последующей стадии.
Реакция между Н2 и Сl2 послужила одним из первых объектов исследования цепных фотохимических реакций. Наибольший вклад в развитие представлений о цепных реакциях внес русский ученый, лауреат Нобелевской премии (1956 г) Н.Н. Семенов.
Хлор вступает в реакцию со многими сложными веществами, например замещения и присоединения с углеводородами:
СН3-СН3 + Сl2 → СН3-СН2Сl + НСl,
СН2=СН2 + Сl2 → СН2Cl - СН2Сl.
Хлор способен при нагревании вытеснять бром или иод из их соединений с водородом или металлами:
Сl2 + 2НВr = 2НСl + Вr2,
Сl2 + 2НI = 2НСl + I2,
Сl2 + 2КВr = 2КСl + Вr2,
а также обратимо реагирует с водой:
Сl2 + Н2О ![]() НСl + НСlO -
25 кДж.
НСl + НСlO -
25 кДж.
Хлор, растворяясь в воде и частично реагируя с ней, как это показано выше, образует равновесную смесь веществ, называемую хлорной водой.
Заметим также, что хлор в левой части последнего уравнения имеет степень окисления 0.В результате реакции у одних атомов хлора степень окисления стала -1 (в НСl), у других +1 (в хлорноватистой кислоте НОСl). Такая реакция — пример реакции самоокисления-самовосстановления, или диспропорционирования.
Хлор может таким же образом реагировать (диспропорционировать) с щелочами:
Сl2 + 2NаОН = NаСl + NаСlO + Н2О (на холоде),
ЗСl2 + 6КОН = 2КСl + КClO3 + ЗН2О (при нагревании).
Химическая активность брома меньше, чем у фтора и хлора, но все же достаточно велика в связи с тем,что бром обычно используют в жидком состоянии и поэтому его исходные концентрации при прочих равных условиях больше, чем у хлора.
Для примера приведем реакции взаимодействия брома с кремнием и водородом:
Si +2Вr2 = SiBr4(ж) + 433 кДж,
Н2 + Вr2 = 2НВr(г) + 73 кДж.
Являясь более «мягким» реагентом, бром находит широкое применение в органической химии.
Отметим, что бром, так же, как и хлор, растворяется в воде, и, частично реагируя с ней, образует так называемую«бромную воду», тогда как йод практически в воде не растворим и не способен ее окислять даже при нагревании;по этой причине не существует «йодной воды».
Йод существенно отличается по химической активности от остальных галогенов.Он не реагирует с большинством неметаллов, а с металлами медленно реагирует только при нагревании. Взаимодействие же иода с водородом происходит только при сильном нагревании,реакция является эндотермической и сильно обратимой:
Н2 + I2 2НI - 53 кДж.
Таким образом, химическая активность галогенов последовательно уменьшается от фтора к йоду. Каждый галоген в ряду F - I может вытеснять последующий из его соединений с водородом или металлами, т.е.каждый галоген в виде простого вещества способен окислять галогенид-ион любого из последующих галогенов:

