
62. Металлы в окружающей среде.МЕТАЛЛЫ — это вещества, обладающие высокой электропроводностью и теплопроводностью, ковкостью, пластичностью и металлическим блеском. Эти характерные свойства металла обусловлены наличием свободно перемещающихся электронов в его кристаллической решетке. Из известных в настоящее время 107 химических элементов 85 относятся к металлам. В соответствии с местом, занимаемым в периодической системе, различают переходные (элементы побочных подгрупп) и непереходные металлы (элементы главных подгрупп). Металлы главных подгрупп характеризуются тем, что в их атомах происходит последовательное заполнение электронных s- и р-подуровней. В атомах металлов побочных подгрупп происходит достраивание d- и f-подуровней.Нахождение металлов в природе. Многие металлы широко распространены в природе. Так, содержание некоторых металлов в земной коре следующее: алюминия — 8,2% железа — 4,1% кальция — 4,1% натрия — 2,3% магния — 2,3% калия - 2,1 % титана — 0,56%. Большое количество натрия и магния содержится в морской воде: — 1,05%, — 0,12%. В природе металлы встречаются в различном виде:
— в самородном состоянии: серебро , золото , платина , медь , иногда ртуть
— в виде оксидов: магнетит Fe3O4, гематит Fe2О3 и др.
— в виде смешанных оксидов: каолин Аl2O3 • 2SiO2 • 2Н2О, алунит (Na,K)2O • АlО3 • 2SiO2 и др.
— различных солей: сульфидов: галенит PbS, киноварь НgS, хлоридов: сильвин КС1, галит NaCl, сильвинит КСl• NаСl, карналлит КСl • МgСl2 • 6Н2О, сульфатов: барит ВаSO4, ангидрид Са8О4 фосфатов: апатит Са3(РО4)2, карбонатов: мел, мрамор СаСО3, магнезит МgСО3. Многие металлы часто сопутствуют основным природным минералам: скандий входит в состав оловянных, вольфрамовых руд, кадмий — в качестве примеси в цинковые руды, ниобий и тантал — в оловянные. Железным рудам всегда сопутствуют марганец, никель, кобальт, молибден, титан, германий, ванадий. Тяжелые металлы – группа химических элементов, имеющих плотность 5 г/см3. Для их биологической классификации правильнее руководствоваться атомной массой, т.е. считать тяжелыми металлы с относительной массой более 40. К тяжелым металлам отнесена группа элементов, имеющих большое биохимическое и физиологическое значение. Это так называемые микроэлементы – медь (Cu), цинк (Zn), молибден (Mo), кобальт (Co), марганец (Mn).
63. Предмет и задачи химии окружающей среды.
Химия окружающей среды как одно из новых направлений естествознания, возникла в 70-х годах двадцатого столетия. Это сравнительно молодая отрасль науки, которая закладывает естественнонаучную основу экологического образования, даёт представление о том, как протекают в объектах окружающей среды естественные физико-химические процессы, и как они проявляются в различных временных масштабах. Химия окружающей среды базируется на основных законах и понятиях классической химии применительно к природным системам, рассматривает механизмы аккумуляции, трансформации и миграции природных веществ и элементов, даёт возможность, предсказать потенциальные пути их взаимодействия с чужеродными соединениями, привносимыми в объекты окружающей среды в результате производственной и бытовой деятельности человека. Химия окружающей среды включает сведения об эволюции химических элементов от их возникновения до происхождения органической материи и, в конечном итоге – жизни, как самого прекрасного, что существует на нашей планете. В отличие от химической экологии она включает сведения о химиче-
ских процессах во Вселенной и на Земле, об их энергетическом балансе, а также о структуре, свойствах и составе атмосферы, гидросферы и литосферы, в их естественном состоянии, не отягощенном антропогенным воздействием. Эти знания необходимы для того, чтобы научиться рациональному природопользованию и умению находить эффективные пути разработки и внедрения мероприятий по защите природной среды от загрязнений Предметом химии окружающей среды являются химические процессы и связи в природных экосистемах, позволяющие прогнозировать их динамику в естественном состоянии и трансформацию происходящую вследствие внешних влияний.
64. Осадочный цикл, глины, минералы и их классификация.
Осадочный цикл (также седиментационный цикл, от англ. sedimentary cycle) — в геологии последовательность смены режима накопления осадков, которая повторяется в ходе геологического развития территории. Длительность циклов варьируется от кратковременных, вызванных климатическими изменениями до длительных (180—240 млн лет), соответствующих альпийской, герцинской, каледонской складчатостям, а также более древним этапам развития геосинклиналей. Часто выделяются осадочные циклы средней продолжительности (десятки и сотни тысяч лет), которые привели к образованию угленосных мезоциклов, а также циклов в отложениях на морском дне. Гли́на — мелкозернистая осадочная горная порода, пылевидная в сухом состоянии, пластичная при увлажнении. Глина состоит из одного или нескольких минералов группы каолинита (происходит от названия местности Каолин в Китае), монтмориллонита или других слоистых алюмосиликатов (глинистые минералы), но может содержать и песчаные и карбонатные частицы. Как правило породообразующим минералом в глине является каолинит, его состав: 47 % (мас) оксида кремния (IV) (SiO2), 39 % оксида алюминия (Al2О3) и 14 % воды (Н2O). Al2O3 и SiO2 — составляют значительную часть химического состава глинообразующих минералов. Диаметр частиц глин менее 0,005 мм; породы, состоящие из более крупных частиц, принято классифицировать как лёсс. Большинство глин — серого цвета, но встречаются глины белого, красного, жёлтого, коричневого, синего, зелёного, лилового и даже чёрного цветов. Окраска обусловлена примесями ионов — хромофоров, в основном железа в валентности 3 (красный, желтый цвет) или 2 (зеленый, синеватый). Минералы, содержащиеся в глинах:Каолинит (Al2O3·2SiO2·2H2O)Андалузит, дистен и силлиманит (Al2O3·SiO2) Галлуазит (Al2O3·SiO2·H2O)
Гидраргиллит (Al2O3·3H2O)Диаспор (Al2O3·H2O)Корунд (Al2O3)Монотермит (0,2[K2MgCa]0·Al2O3·2SiO2·1,5H2O)Монтмориллонит (MgO·Al2O3·3SiO2·1,5H2O)Мусковит (K2O·Al2O3·6SiO2·2H2O)Наркит (Al2O3·SiO2·2H2O)Пирофиллит (Al2O3·4SiO2·H2O). Основным источником глинистых пород служит полевой шпат, при распаде которого под воздействием атмосферных явлений образуются каолинит и другие гидраты алюминиевых силикатов. Некоторые глины осадочного происхождения образуются в процессе местного накопления упомянутых минералов, но большинство из них представляют собой наносы водных потоков, выпавшие на дно озёр и морей.Глина — это вторичный продукт земной коры, осадочная горная порода, образовавшаяся в результате разрушения скальных пород в процессе выветривания.
Минералы – твердое природное неорганическое кристаллическое вещество. Минералы – естественные дискретные органически целостные системы взаимодействующих атомов, упорядоченных с трёхмерной неограниченной периодичностью их равновесных положений, являющиеся относительно неделимыми структурными элементами горных пород и дисперсных фазовогетерогенных образований. Минералы – твердое природное тело,имеющее кристаллическое строение состав которого можно выразить формулой ( поваренная соль-галит;полевой шпат, входящий в состав фарфора и фаянса).
В 4 в. Аристотель разделил окужающий мир на 3 царства: животные, растения и минералы. До начала 16 в. Не знали разницы между минералами, горными породами, окаменелостями, рудами и искусственными продуктами. Впервые термин «Минерал» ввел А. Мангус: « То, что из рудника или ископаемое - минерал». В эпоху Возрождения произошел рассвет промышленного производства и торговли, увкличился спрос на металлы, и спрос вызвал интенсивное освоение рудных месторождений, развитие горного дела. Началось развитие минералогии. После возникновения Биохимии стали изучать поведение химических элементов в земной коре. Минералогия становится химией земной коры.
Классификация минералов.
1)Сульфиды
2)Сульфосоли
3)Фториды
4)Хлориды, бромиды, йодиды
5)Простые и сложные окислы
6)Гидроксилы
7)Нитраты
8)Карбонаты
9)Сульфаты
10)Хроматы
11)Вольфраматы и молибдаты
12)Фосфаты, ванадаты, арсенаты
13)Бораты
14)Силикаты
Поскольку жидкости и газы не имеют собственных формы и размера то не считаются минералами. На земле находятся в виде смеси.
65. Источники попадания пестицидов в окружающую среду. Основной источник поступления пестицидов в воздушную среду — обработка ими сельскохозяйственных культур, семян, лесных угодий, водоемов. Именно переносом по воздуху можно объяснить широкое распространение в окружающей среде стойких веществ, которые могут обнаруживаться на значительном расстоянии от мест их применения.
Поведение в воздухе.При мелкодисперсном распылении, особенно при авиаобработках, препараты могут адсорбироваться в воздухе твердыми частицами и переноситься потоками воздуха. Так, установлено, что при опыливании леса на деревьях обрабатываемого участка задерживается только около 50 % пестицида, остальное количество какое-то время находится в воздухе, а затем оседает на растения и почву на значительном расстоянии от места обработки. Особенно большой снос происходит при использовании высоколетучих препаратов. Воздух загрязняется сильнее при опыливании, чем при опрыскивании.Пестициды попадают в воздушную среду вместе с почвенной пылью при ветровой эрозии, а также при обработке почвы и при уборке урожая. Значительное их количество обнаруживается в атмосферной пыли районов, где практикуется интенсивная химическая обработка.Пестициды могут поступать в воздушную среду и с влажных поверхностей в результате возгонки с водным паром и вследствие испарения с поверхности почвы и растений. Наиболее высокая концентрация препаратов в воздухе отмечается к середине дня, когда температура его повышается до максимальной. Из атмосферы пестициды и их метаболиты попадают в воду, почву, продолжая циркулировать в окружающей среде.Поведение в воде.Вода служит основным средством транспорта пестицидов в окружающей среде. В открытые водоемы они могут попадать со сточными водами предприятий, которые их выпускают, при авиационной и наземной обработках сельскохозяйственных угодий и лесов, с дождевыми и талыми водами, а также при непосредственной обработке открытых водоемов для уничтожения водорослей, моллюсков, переносчиков заболеваний человека и животных, сорных растений. Поведение в почве.Пестициды вносят в почву для уничтожения почвообитающих вредителей, нематод, сорняков, возбудителей бактериальных и грибных заболеваний. Попадают они в почву и после обработки надземных органов растений: смываются выпадающими осадками, сносятся ветром.Пестициды могут поступать в почву в виде их остатков, содержащихся в листьях, корнях и т. д. В почве в зависимости от условий они могут оставаться в неизмененном состоянии и сохранять свою токсичность в течение более или менее продолжительного времени. Вещества, внесенные в почву в виде гранул, сохраняются в ней более продолжительное время, чем порошковидные или жидкие. Как правило, препараты более стойки в почвах с высоким содержанием органического вещества и илистой фракции.
66. Круговорот галогенов в природе.
67. Причины загрязнения почв пестицидами.
Причина-Сельское хозяйство. Удобрения, ядохимикаты,применяемые в сельском и лесном хозяйстве для защиты растений от вредителей,болезней и сорняков. Загрязнение почв и нарушение нормального круговорота веществ происходит в результате недозированного применения минеральных удобрений и пестицидов. Пестициды, с одной стороны, спасают урожай, защищают сады, поля, леса от вредителей и болезней, уничтожают сорную растительность,освобождают человека от кровососущих насекомых и переносчиков опаснейших болезней (малярия, клещевой энцефалит и др.), с другой стороны – разрушают естественные экосистемы, являются причиной гибели многих полезных организмов,отрицательно влияют на здоровье людей. Известно, что нормальный рост растений определяется различными физическими, химическими и биологическими процессами, которые протекают в почве. При попадании в почву пестициды могут быть включены в эти процессы с их накоплением в растениях. Кроме того, они сохраняют устойчивость в почве длительное время, что также обуславливает их накопление в пищевых цепях. Пестициды обладают рядом свойств,усиливающих их отрицательное влияние на окружающую среду. Технология применения определяет прямое попадание на объекты окружающей среды, где они передаются по цепям питания, долгое время циркулируют по внешней среде,попадай из почвы в воду, из воды в планктон, затем в организм рыбы и человека или из воздуха и почвы в растения, организм травоядных животных и человека.Вместе с навозом в почву нередко попадают болезнетворные бактерии, яйца гельминтов и другие вредные организмы, которые через продукты питания попадают в организм человека.
Необходимость применения пестицидов в сельском хозяйстве обусловлена тем, что без них урожайность сельскохозяйственных культур резко падает и составляет лишь 20-40% от возможной при их применении. Трудно себе представить уничтожение колорадского жука на картофельных плантациях без применения пестицидов.
68. Роль фосфора в эвтрофировании водоемов.
Фосфор в природных водах. По сравнению с азотом фосфор значительно более подвижен (входит в состав энергетических молекул АТФ-АДФ). Естественно, скорость оборачиваемости фосфора намного выше и составление его баланса более сложно.
Ведущая роль фосфора в процессах эвтрофирования обусловила более глубокое внимание к этому элементу, что выразилось в явном преобладании работ, посвященных его режиму и круговороту в природных водах. Можно сказать, что исследование цикла фосфора в природных водах в настоящее время стало одной из важнейших проблем изучения качества воды водоемов. Прежде чем рассматривать вопросы трансформации фосфора в водохранилищах целесообразно обобщить существующие представления о закономерностях его круговорота и классификации форм его существования в природных водах.
Формы фосфора в природных водах. Роль фосфора как биогенного элемента определяется его участием в энергетических и анаболических процессах в растительных клетках. Фосфор присутствует в ткани клеток фитопланктона в составе многих соединений, наиболее важный их которых – ортофосфат (существующий в виде Н2РО4- при 3 < рН < 7 или НРО42- при 8 < рН < 12). Фосфатные группы выступают основой нуклеиновых кислот АТФ и ФДФ – основных энергоносителей живой клетки.
Аналитическое определение соединений фосфора почти повсеместно базируется на колориметрическом методе определения фосфатов, разработанным Дениже [Deniges, 1920] и введенным в практику лимнологических исследований Аткинсом [Atkins, 1923]. Метод основан на реакции ортофосфата с молибдатом в кислой среде с образованием окрашенного комплексного соединения.
Круговорот фосфора .В круговороте фосфора, в отличие от круговоротов углерода и азота, отсутствует газовая фаза. Фосфор в природе в больших количествах содержится в минералах горных пород и попадает в наземные экосистемы в процессе их разрушения. Выщелачивание фосфора осадками приводит к поступлению его в гидросферу и соответственно в водные экосистемы. Растения поглощают фосфор в виде растворимых фосфатов из водного или почвенного раствора и включают его в состав органических соединений – нуклеиновых кислот, систем переноса энергии (АДФ, АТФ), в состав клеточных мембран. Другие организмы получают фосфор по пищевым цепям. В организмах животных фосфор входит в состав костной ткани, дентина.
В процессе клеточного дыхания происходит окисление органических соединений, содержащих фосфор, при этом органические фосфаты поступают в окружающую среду в составе экскретов. Организмы-редуценты минерализуют органические вещества, содержащие фосфор, в неорганические фосфаты, которые вновь могут быть использованы растениями и, таким образом, снова вовлекаться в круговорот.
Поскольку в круговороте фосфора отсутствует газовая фаза, фосфор как и другие биогенные элементы почвы, циркулирует в экосистеме лишь в том случае, если отходы жизнедеятельности откладываются в местах поглощения данного элемента. Нарушение круговорота фосфора может происходить, например, в агроэкосистемах, когда урожай вместе с извлеченными из почвы биогенами перевозится на значительные расстояния, и они не возвращаются в почву в местах потребления.
После неоднократного потребления фосфора организмами на суше и в водной среде, в конечном итоге он выводится в донные осадки в виде нерастворимых фосфатов. После поднятия осадочных пород над уровнем моря в ходе большого круговорота вновь начинают действовать процессы выщелачивания и бигенного разрушения.
Внесение фосфорных удобрений, представляющих собой продукты переработки осадочных пород, позволяет восполнить потребленный фосфор в регионах с интенсивным сельскохозяйственным производством. Однако, смыв удобрений с полей, а также поступление в водоемы фосфатов с продуктами жизнедеятельности животных и человека может приводить к перенасыщению водных экосистем фосфатами и нарушению в них экологического равновесия.
Сопоставление скоростей процессов превращения фосфора в водоемах приводит к необходимости разделять круговорот фосфора на «быстрый» (биологический) и «медленный» (гидролого-геохимический). Быстрый круговорот определяется метаболическим обменом в процессе биологического потребления и биохимической трансформацией различных форм фосфора. Медленный связан с внешним балансом фосфора, его переносом с водными массами и определяет общий уровень содержания фосфора в водоеме. Для процессов трансформации фосфора важное значение имеет вертикальное расслоение водных масс и существование эпилимниона и гиполимниона.
В преимущественно безоблачную и безветренную погоду, обычную для стационарных антициклонов, при достаточной концентрации минерального фосфора в поверхностном быстро прогревающемся слое воды в утренние часы быстро увеличивается биомасса фитопланктона. Поглощение при этом водорослями неорганического углерода ведет к повышению в трофогенном слое величины рН и к кристаллизации в воде СаСО3. Как показали наши наблюдения, образующиеся кристаллики кальцита имеют микронный размер и поэтому становятся хорошим сорбентом ортофосфатов, что ускоряет снижение концентрации выедаемого водорослями минерального фосфора в этом слое, тормозя развитие фотосинтеза во второй половине дня. С началом вечернего охлаждения водной поверхности в такую погоду начинает развиваться ночная конвекцию, увлекающая в глубину из трофогенного слоя не только водоросли и детрит, но и кристаллы кальцита с сорбированным на них фосфором. Попадая в трофолитический слой, где доминируют процессы деструкции и происходит частичное окисление детрита (вызывающее снижение концентрации О2 и рост рН), кристаллы частично растворяются, а десорбированные и регенирированные при разложении детрита ортофосфаты восходящими конвективными токами воды к утру поднимаются снова к водной поверхности, обеспечивая восполнение запаса питательных веществ для утреннего роста фитопланктона.
При нередких в такую погоду слабых ветрах (1-3 м/с) в послеполуденные часы возникает сгон тонкого, наиболее прогретого днем поверхностного слоя воды с обильным фитопланктоном к наветренному берегу. В его заливах накапливаются особенно большие биомассы синезеленых водорослей, концентрация которых здесь может достигать значений, свойственных гипертрофным водоемам. В то же время в зоне сгона у подветренных участков берега к поверхности поднимается относительно прозрачная вода с большим содержанием растворенных питательных веществ, регенерированных в слое скачка. Это создает условие для локального ускорения здесь продукционного процесса в конце светлой части суток.
Подобные схемы круговорота фосфора характерны и для озер. Важно отметить, что для гиполимниона важнейшим элементом круговорота выступает обмен фосфором между донными отложениями и водной массой. Многочисленные исследования этой проблемы показали, что донные отложения, выступая источником внутриводоемного потока фосфора, служат своеобразным буфером, регулирующим на протяжении длительного процесса эвтрофирования общую фосфорную нагрузку на водоем. Поэтому обмен фосфора на границе вода – донные отложения превратился в один из ключевых вопросов при исследованиях и прогнозе эвтрофирования водоемов. Глубокое исследование этой проблемы проведено М.В.Мартыновой [1984], согласно которой общая схема фосфорного обмена может быть представлена в следующем виде (рис. 4.4)
Рис. 4.4. Схема потоков фосфора на границе
вода-донные отложения ( алл- и авт- соответственно
фосфорсодержащие вещества аллохтонного
и автохтонного происхождения)
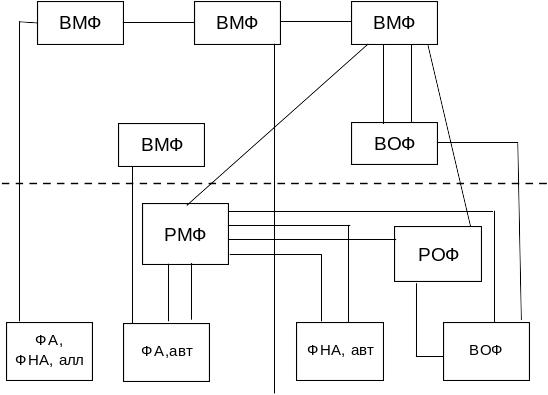
Интенсивность диффузионных потоков из донных отложений определяется трофическим состоянием водоемов и степенью «разбавления» автохтонного детрита отложений минеральными взвесями. При этом значимость потоков фосфора из донных отложений непосредственно связана с величиной внешней нагрузки фосфором на водоем. Эти два процесса имеют очень принципиальное значение при сравнительной оценке процесса эвтрофирования в озерах и водохранилищах.
70. Процесс образования земной коры и атмосферы.
Земная кора, гидросфера и атмосфера образовались в основном в результате высвобождения веществ из верхней мантии молодой Земли. За счет этих процессов сформировалась оболочка из породы толщиной менее 0,0001% объема всей планеты. Состав этой оболочки, образующей континентальную и океаническую кору, эволюционировал во времени прежде всего за счет возгонки элементов из мантии в результате частичного плавления на глубине примерно 100 км. Средний химический состав современной коры (рис. 1) показывает, что кислород содержится в ней в наибольшем количестве, сочетаясь в разных видах с кремнием, алюминием и другими элементами с образованием силикатов.
Возникновение и развитие жизни на Земле.
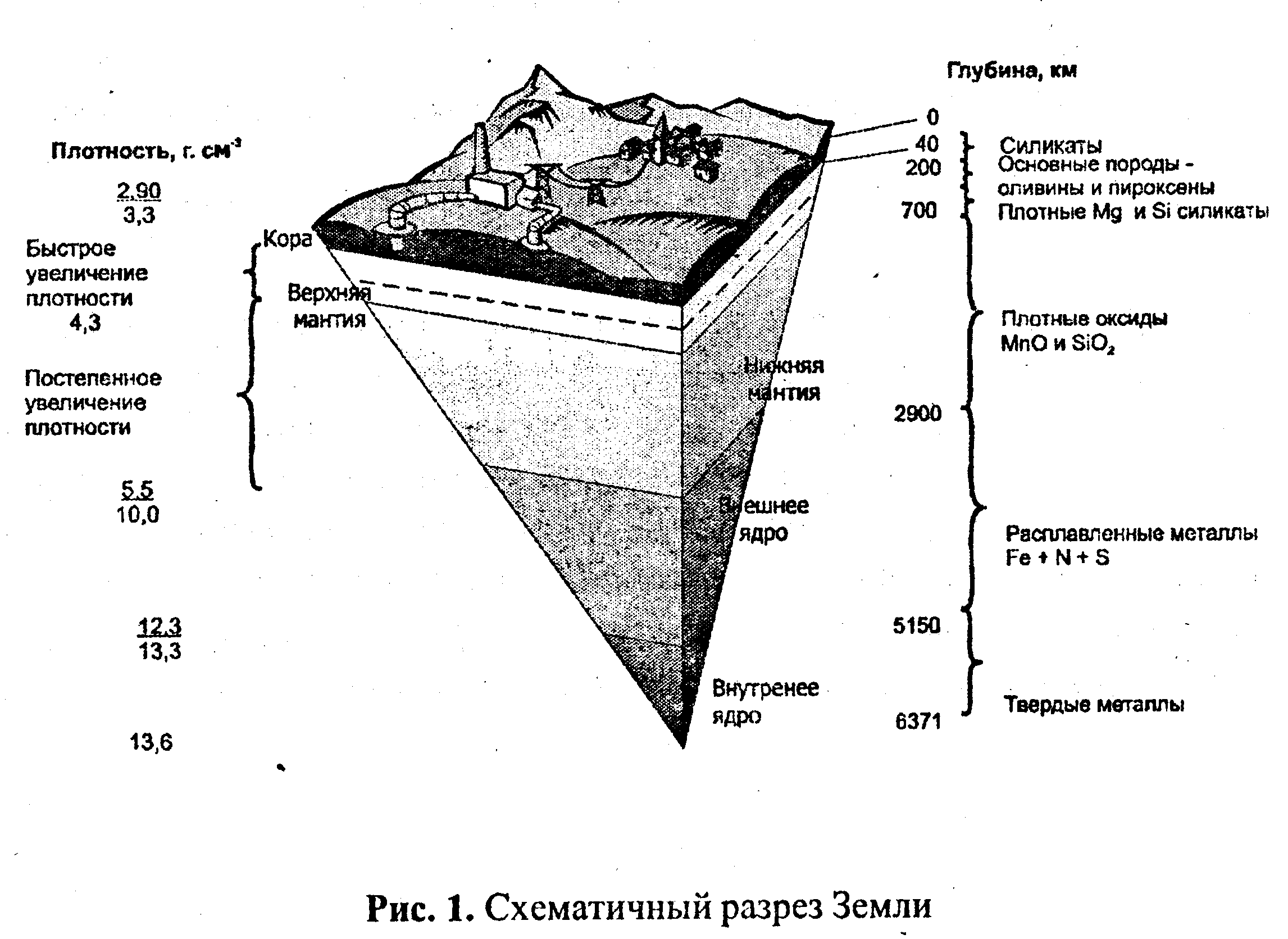
Можно предположить, что летучие элементы выделились (дегазировались) из мантии в результате извержений вулканов, сопровождавших образование коры. Некоторые из этих газов удержались и образовали атмосферу, когда поверхностные температуры стали достаточно низкими, гравитационное притяжение достаточно сильным.
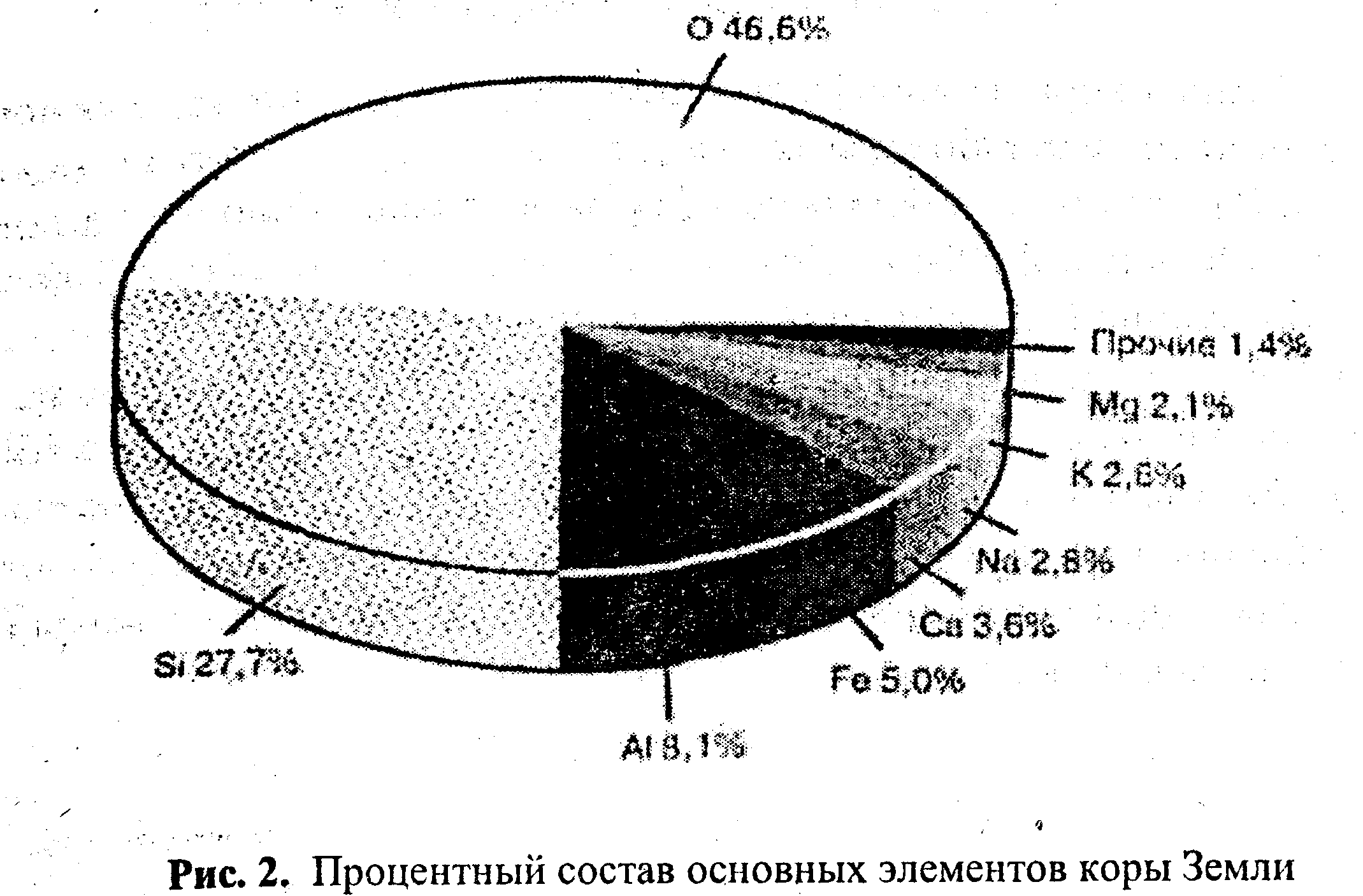
Процентный состав основных элементов коры Земли Эволюция атмосферы и происхождение жизни. Аккреция вещества Земли привела к временному его разогреву и легких молекул первичной атмосферы, прежде всего водорода и гелия, рассеянных в космическом пространстве. Последующее понижение температуры в результате сильного излучения тепла привело к образованию твердой коры. Активный вулканизм мешал этому процессу, но в то же время поставлял большие количества газов, из которых образовалась вторичная атмосфера. В ней, кроме Нг, было много других газов, таких, как СН4, NH3 и Н20 (рис. 3).
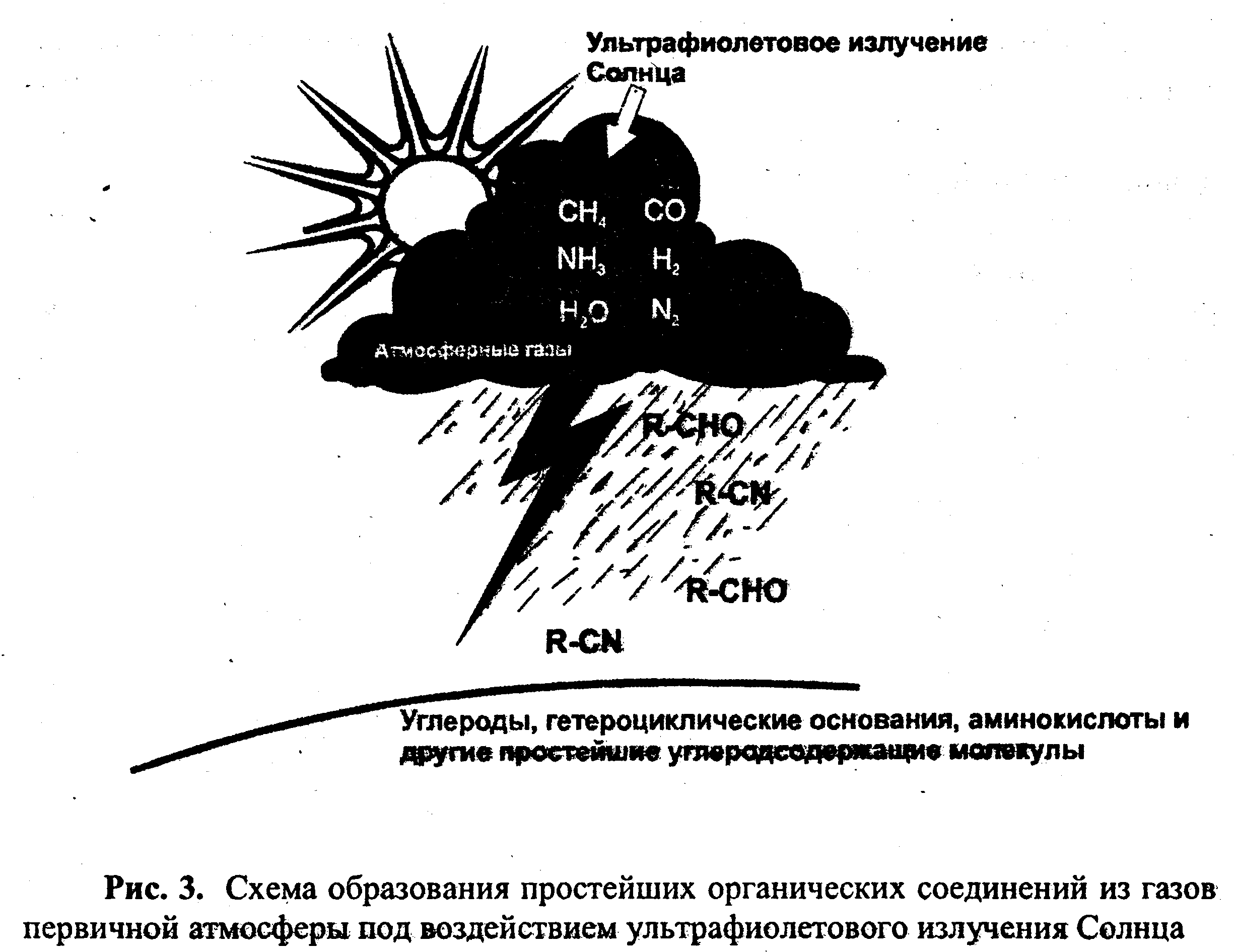
Наряду с водяными парами уже существовал и древний океан, состоящий из жидкой воды. Углекислоты Н2СО3 было мало, так как ее восстанавливали соединения Fe3+, содержавшиеся в земной коре. Примерно 1 млрд. лет атмосфера была восстановительной, имелись возможности для процессов абиогенного образования и накопления многих соединений. На восстановительную вторичную атмосферу воздействовали большие потоки энергии: коротковолновое ультрафиолетовое излучение, ионизирующее излучение Солнца (сейчас экранируется озоновым слоем), электрические разряды (грозы, коронные разряды), местные источники тепла вулканического происхождения. В этих условиях мог идти активный химический синтез, при котором из газов вторичной атмосферы через такие промежуточные продукты, как синильная кислота, этилен, этан, формальдегид и мочевина, образовались сначала мономеры, а затем и полимеры. Ввиду того, что окисления не происходило, водоемы обогащались аминокислотами, пу-риновыми и пиримидиновыми основаниями, сахарами, карбоновыми кислотами, липидами. Образовался «первичный бульон». Происходили процессы осаждения, разделения и адсорбции, а на поверхностях минералов (глина, горячая лава) дальнейшие синтетические процессы (рис. 4). Это подтверждается результатами анализа древних земных химических ископаемых и их сравнением с внеземным органическим веществом (метеориты), а также многочисленными модельными экспериментами, показавшими, что в смеси газов, воспроизводящей атмосферу, при достаточном притоке энергии действительно происходят процессы синтеза органических веществ. Среди продуктов этого синтеза найдены основные биологически важные соединения, в том числе 14 аминокислот, пурины и пнрнмидины, сахара, АМФ, АДФ, АТФ, жирные кислоты и порфирины. По мере возрастающей потери Н2 в космическое -пространство создавалась третичная атмосфера, содержащая большие количества Ni (из NH3), С®2 (из вулканических газов и из СН4) и паров воды.
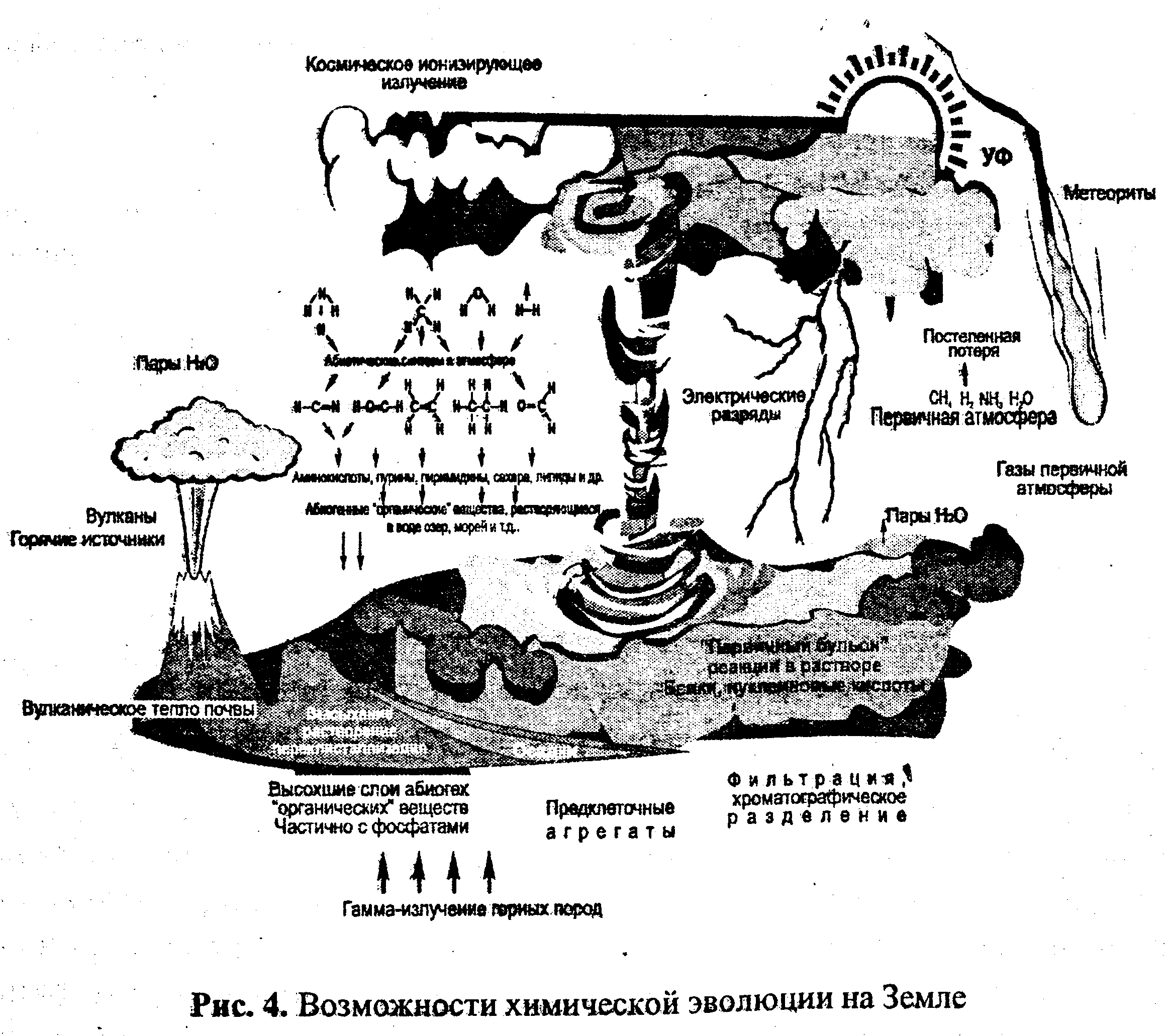
Около 3,5 млрд. лет назад появились хлорофиллоноеные организмы, способные осуществлять фотосинтез, т. е. использовать экзогенный источник энергий (солнечную радиацию) для синтеза из углекислого газа, воды и минеральных элементов всех органических веществ, необходимых для жизни. Эти организмы преобразовывали солнечную энергию в биохимическую. С02(г) + Н20(Ж) -> СН20(тв) + 02(г). (1) «Изобретение» фотосинтеза способствовало повышению содержания кислорода в атмосфере и формированию современной, четвертичной атмосферы. В атмосфере Земли кислород первоначально накапливался путем разложения воды и водяного пара под действием ультрафиолетовых лучей Солнца. Сначала кислород (О2) быстро потреблялся в процессе окисления восстановленных веществ и минералов. Однако наступил момент, когда скорость его поступления (уже преимущественно в процессе фотосинтеза) превысила потребление и 02 начал постепенно накапливаться в атмосфере. Около 500 млн лет назад количество кислорода в атмосфере было много больше, чем сейчас, но впоследствии в результате интенсивной вулканической деятельности снизилось до современного. Биосфера под смертельной угрозой своего собственного отравляющего побочного продукта была вынуждена приспосабливаться к таким изменениям. Она осуществляла это посредством развития новых типов биогеохимического метаболизма, которые поддерживают разнообразие жизни и на современной Земле. Предполагают, что жизнь на Земле началась в океанах около 4,2—3,8 млрд. лет назад. Древнейшие из известных ископаемых — бактерии из пород с возрастом около 3,5 млрд. лет. В породах этого возраста имеются свидетельства достаточно развитого обмена веществ, при котором использовалась солнечная энергия для синтеза органического вещества. Самые ранние из этих реакций, вероятно, были основаны на сере (S), поступающей из вулканических выходов:С02(г) +2H2S-> СН20(тв) + 2S(TB) + Н20{ж). (2) (органическое вещество). Содержание углекислого газа (С02) в четвертичной атмосфере на порядок превышало современный уровень, затем уменьшилось в такой степени, что 500 млн лет назад оно стало заметно ниже современного уровня и достигло его лишь значительно позже. Постепенно возникла атмосфера современного состава. К тому же кислород в стратосфере претерпел фотохимические реакции, приведшие к образованию озона (Оэ), защищающего Землю от ультрафиолетового излучения. Этот экран позволил высшим организмам выйти на сушу. Итак, происхождение атмосферы неразрывно связано с образованием Земли. Эволюция атмосферы происходила (и происходит) под влиянием следующих факторов: • аккреции вещества межпланетного пространстве, • выделения газов при вулканической деятельности; • химического взаимодействия газов атмосферы с компонентами гидросферы и литосферы; • диссоциации молекул газов, составляющих воздух, под влиянием солнечного ультрафиолетового и космического излучения; • биогенных процессов в живом веществе биосферы; • антропогенной деятельности.
71. Изотопы в окружающей среде. Реакции ядерного распада и ядерного синтеза.
Изотопы – это атомы элемента с одним и тем же атомным номером, но
с различными атомными массами. Термин «изотоп» предложил Содди в
1918 г. для обозначения двух или более веществ с разной массой,
занимающих одно и то же место в периодической таблице. Известно 340
естественных изотопов элементов.
A=Z+N,
N=A–Z,
Z=A–N,
где A – массовое число, Z – порядковый номер элемента в периодической
системе, равный заряду ядра, числу протонов и числу орбитальных
электронов атома, N – число нейтронов. У легких изотопов A=2Z. Это
соотношение выдерживается до кальция-40
Радиоактивность – самопроизвольный переход ядер нестабильных атомов в 126
более стабильное состояние. В результате изменений в ядрах атомов
выделяется издучение:
α-лучи (ионы гелия);
β-лучи (электроны);
γ-лучи (электромагнитные волны).
Удаление α-частицы из ядра смещает атомный номер в периодической
таблице на 2 позиции влево. Массовое число элемента при этом уменьшается
на 4 единицы.
При β–распаде массовое число не изменяется. При обычном β-распаде
нейтрон превращается в протон с выделением электрона, а атомный номер
элемента увеличивается на единицу. При электронном захвате протон
переходит в нейтрон в результате перемещения электрона их К-оболочки
атома в ядро. Атомный номер при этом уменьшается на единицу, β-
излучение отсутствует, но выделяются Х-лучи.
γ-лучи испускаются при возвращении ядра из возбужденного состояния
в обычное состояние.
Все три вида излучения являются ионизирующими и способны
наносить повреждения биологическим объектам (лучевая болезнь, мутации,
образование злокачественных опухолей). Наибольшей проникающей
способностью обладает γ-излучение.
Содержание стабильных изотопов часто выражают с помощью
Так, например, δ
13
С составляет для атмосферы –7‰, а для ископаемого
топлива –26‰, δ
34
S для ископаемых топлив лежит от 0 до +5‰, а для ДМС
+20‰. Это позволяет различать источники поступления различных веществ в
окружающую среду. 127
При радиоактивном распаде с изменением атомного номера
первоначальный изотоп называется материнским, новообразованный –
дочерним.
dN / dt = −λN ,
где N – число неизмененных атомов, t – время, λ – постоянная распада
данного радиоактивного изотопа, которую можно выразить как долю
распавшихся атомов на один атом в секунду.
Если интегрировать уравнение распада от t=0 до t и от N0 до N, где N0 –
число атомов при t=0, потенцируем и получаем:
t N N e −λ = 0.
Часто используется период полураспада – время распада половины
первоначального числа атомов. Константа распада λ и период полураспада t½
связаны между собой 1/ 2 1/ 2 t e −λ = или t1/ 2= ln 2 / λ .
Если P – число материнских атомов в минерале, а D – число дочерних
атомов, то t P P D e−λ= ( + ) или = ( −1)tD P eλ. Отсюда tP P D e−λ/( + ) = , e P D P t= ( + )/λ, λt = ln(1+ D / P), t = 1/ λ ln(1+ D / P).
Изотопы в окружающей среде
Наибольшую опасность из радиоактивных элементов представляют те,
у которых период полураспада составляет от нескольких недель и месяцев до
нескольких лет (см. табл. 41), поскольку короткоживущие изотопы
распадаются быстро и не успевают принести существенного вреда, а
долгоживущие – слабо радиоактивны. 128
Таблица 41
Основные радиоактивные изотопы, имеющие значение для экологии (Рамад, 1981)
Радиоизотоп (в скобках – Излучение стабильный изотоп)
Период полураспада
α β γ
Группа А: Радиоизотопы элементов, составляющих основу живого вещества
14
C (
12
C) 5568 лет +
3
H (
1
H) 12,4 года +
32
P (
31
P) 14,5 сут. +++
35
S (
32
S) 87,1 сут. +
45
Ca (
40
Ca) 160 сут. ++
24
Na (
23
Na) 15 ч. +++ +++
42
K (
39
K) 12,4 ч. +++ ++
40
K (
39
K) 1,3 млрд. Лет ++ ++
59
Fe (
56
Fe) 45 сут. ++ +++
54
Mn (
55
Mn) 300 сут. ++ ++
131
I (
127
I) 8 сут. ++ ++
Группа В: обильны в радиоактивных осадках, выбросах при авариях реакторов
90
Sr (
88
Sr) 27,7 года ++
137
Сs (
133
Сs) 32 года ++ +
144
Сe (
140
Сe) 285 сут. ++ +
106
Ru (
101
Ru) 1 год +
91
Y (
89
Y) 61 сут. +++ ++
239
Pu (
244
Pu) 24000 лет ++++ ++
Группа С: Инертные газы
41
Ar (
40
Ar) 2 ч. ++
85
Kr (
84
Kr) 10 лет +
133
Xe (
131
Xe) 5 сут. +++
+ энергия меньше 0,2 МэВ, ++ энергия 0,2-1 МэВ, +++ энергия 1-3 МэВ, ++++ энергия
больше 3 МэВ
Серьезную проблему представляют стронций–90 и цезий–137
благодаря своей способности к накоплению в человеческом организме.
Стронций благодаря своему химическому сходству с кальцием очень легко
проникает в костную ткань позвоночных, а цезий может накапливаться в
мускулах, замещая калий.
Фоновое содержание стронция–90 в почвах составляет 28 г т –1, в почвах крупных городов – 44
г т –1. Содержание цезия–137 в воздухе составляет (пг м –3): 20 (Норвегия), 40 (Гренландия), 60–1500 (ФРГ), 16–1500 (Япония), 70–300 (США, Канада) (Мазур, 1996). В организм человека цезий и стронций попадают с пищей. Средние содержания их в культурных растениях приведено в таблице 42 (один Бк соответствует одному распаду в сек). 129
Таблица 42
Среднее содержание
90
Sr и
137
Cs (Бк кг
–1
сухой массы) в культивируемых растениях
Культура
90
Sr
137
Cs
Пшеница (зерно) 2,849 10,730
Рожь (зерно) 2,701 7,400
Ячмень (зерно) 3,108 6,290
Морковь 0,555 1,887
Капуста 0,469 2,109
Картофель 0,185 1,406
Свекла 0,666 1,702
Яблоки 0,333 1,998
После газа радона-222 калий-40 занимает второе место в создании
природного радиоактивного фона, за ним следуют уран, радий и торий.
Содержание этих радиоактивных элементов в различных породах приведено
в таблицах 43, 44. Поскольку строительные материалы изготавливаются из
природного сырья, практически все они также в разной степени
радиоактивны (см. таблицу 45).
Таблица 43
Распространение
40
K в окружающей среде
Источник Бк кг
–1
Морская вода 12–15
Почвы 37–1100
Известняк 30–40
Гранит 925–1200
Базальт 290–400
Изверженные породы 814–925
Глинистые сланцы 85–850
Песчаники 300–400
Апатиты 44–170
Фосфатиты 230
Фосфатно-калийные удобрения 5900
Азотно-фосфорно-калийные удобрения 1200–5900
Таблица 44
Концентрации радиоактивных изотопов (Бк кг–1) в горных породах
Тип породы
238
U
226
Ra
232
Th
Граниты 59 96–114 81,4
Диориты 31 – 32,5
Базальты 11 18,5 11,1
Дюриты 0,4 – 24,4
Сланцы 44 14,8 44,4
Алюминиевые сланцы – 2220 –
Известняки 26 14,8–25,9 7,0–7,7
Песчаники 18 11,1–25,9 11,1 130
Таблица 45
Радиоактивность строительных материалов
Строительный материал Радиоактивность, Бк кг-3
Дерево 1,1
Природный гипс 29
Песок и гравий 34
Портландцемент 45
Кирпич 126
Гранит 170
Зольная пыль 341
Глинозем 1367
Фосфогипс 574
Кальцийсиликатный шлак 2140
Отходы урановых обогатительных предприятий 4625
Надо отметить, что опасность ионизирующей радиации для живых
существ зачастую преувеличивается. Во-первых, она имеет пороговый
уровень, ниже которого воздействие радиации на организмы не является
вредным. Во-вторых, малые дозы радиации могут быть полезными (так
называемый «эффект хормезиса»).
Так, исследования воздействия малых доз радиации на животных
показали, что продолжительность жизни облученных мышей, крыс, собак
оказалась дольше, они были более здоровыми и приносили более
многочисленное потомство, чем животные, не подвергавшиеся облучению
(Кондратьев, 1999). Сходные данные получены и для человека (Кузин, 1991).
При малых дозах гамма излучения и быстрых нейтронов наблюдалось
усиление роста водорослей, увеличение продолжительности жизни мышей и
морских свинок. Хормезис проявляется в стимулировании восстановления
ДНК, синтезе белков, образовании антистрессорных белков, обезвреживании
свободных радикалов, стимулировании иммунной системы. У
млекопитающих обнаружено усиление защитных реакций по отношению к
опухолевым и инфекционным заболеваниям, в частности, лейкемией, раком и
саркомой (Кондратьев, 1999).
В сельском хозяйстве, например, ионизирующие излучения
используются для повышения всхожести семян, ускорения развития и
повышения урожая растений, лучшей прививаемости черенков, повышения
яйценоскости кур, стимуляции оплодотворяемости и выхода мальков в
рыбоводстве (Кузин, 1981).
При обследовании жертв атомных бомбардировок Хиросимы и
Нагасаки выяснилось, что у людей, подвергшихся облучению на уровне
100 мЗв, смертность от лейкемии была меньше, чем у контрольной группы.
В Норвегии природный радиоактивный фон обеспечивает среднюю дозу
облучения людей за время жизни 365 мЗв, в некоторых местностях – до
1500 мЗв, в Индии и Иране есть районы, где эта доза возрастает до 2000 и
3000 мЗв, соответственно (Кондратьев, 1999). В России пороговым уровнем
считается 70 мЗв (до 1991 г. был принят уровень 50 мЗв).
Многие курорты (например, в горах Швейцарии, Кавказа, Памира,
Колорадо), наряду с благоприятными климатическими факторами, как
правило, включают и фактор повышенного природного радиоактивного
фона. Всемирно известные курорты Браубах, Висбаден, Баден-Баден
(Германия), Бадгастайн (Австрия), Масутами-Спрингс (Япония), Цхалтубо,
Пятигорск, Белокуриха и многие другие возникли вокруг источников с
повышенным содержанием радона.
72. Хозяйственно-бытовые сточные воды. Состав, последствия сброса.
Старейшим видом загрязнения вод являются прямые отходы
человеческой жизнедеятельности. В пересчете на сухое вещество каждый
взрослый человек за год «производит» около 20 кг органического вещества,
5 кг азота и 1 кг фосфора. Первоначально эти отходы напрямую
использовались в качестве удобрений, затем появились первые земляные
уборные. Часть отходов при этом неизбежно попадала в источники питьевой
воды. Именно поэтому большие города уже в древности стали строить
водопроводы из достаточно удаленных от мест скопления людей источников.
С появлением ватерклозетов вторично возникла идея простого решения
проблемы – разведения отходов и удаления их от места сброса. Объемы, а
затем и состав подлежащих очистке сточных вод существенно изменились.
Коммунально-бытовые стоки поступают в настоящее время не только из
жилых зданий, но и из больниц, столовых, прачечных, небольших
промышленных предприятий и т.п. Современные бытовые стоки, кроме
собственно легкоокисляемых органических веществ и биогенных элементов
содержат множество веществ, использующихся в повседневном обиходе:
детергенты и СПАВ, химикалии, лекарственные препараты и т.д.
Поступающие в водотоки и водоемы легкоокисляемые органические
вещества подвергаются там химическому и микробиологическому
окислению. Для измерения содержания органических веществ в воде принято
пользоваться величиной биохимического потребления кислорода за 5 сут.
(БПК5, BOD5 – Biochemical Oxygen Demand). Ее определяют по разнице
содержания в воде кислорода при отборе пробы и после пяти суток
инкубации без доступа кислорода. БПК5, отражая содержание
легкоокисляемой органики в воде, является универсальным показателем,
используя который можно сопоставить степень загрязнения от разных
источников. Так, в таблице 21 загрязнение от предприятий различного
профиля выражено в эквивалентах загрязнения от людей.
Последствия загрязнения бытовыми сточными водами
Легкоокисляемое органическое вещество, в избытке содержащееся в
коммунально-бытовых стоках, становится питательной средой для развития
множества микроорганизмов, в том числе и патогенных. В нормальной почве
содержится большое количество микроорганизмов, способных вызывать
тяжелые инфекционные заболевания. Обычно питьевая вода защищена от
вторжения этих микроорганизмов тем, что содержание в ней доступной пищи
для бактерий (легкоокисляемых органических веществ) невелико и
практически все они используются нормальной водной микрофлорой.
Однако со значительным ростом концентрации органики в воде почвенные
патогенные микроорганизмы находят достаточно источников пищи для себя
и могут стать источником вспышки инфекции. Кроме того, повышение
количества органики в воде стимулирует рост и непатогенной микрофлоры,
служащей, в свою очередь, пищей для более крупных возбудителей
заболеваний – ряда амеб (как это было, например, с амебами, вызвавшими 71
вспышку менингоэнцефалита с летальным исходом среди флоридских
подростков), других паразитов, проводящих в воде значительную часть
своего жизненного цикла. В условиях избытка питания могут развиться и
почвенные грибки, продуцирующие канцерогенные вещества, например,
афлотоксины. Кроме того, множество патогенных бактерий попадает в воду
непосредственно с коммунально-бытовыми сточными водами. Найдя там
условия благоприятные для размножения, они развиваются в массовых
количествах. Водоемы замедленного водообмена (озера и водохранилища)
при неконтролируемом бытовом загрязнении легко превращаются в очаги
инфекций.
Кроме непосредственной опасности развития патогенных организмов в
воде, загрязненной бытовыми стоками существует другое непрямое
неприятное для человека последствие этого вида загрязнений. При
разложении органического вещества (и химическом, и микробиологическом),
как мы уже упоминали выше, потребляется кислород. В случае тяжелого
загрязнения содержание растворенного в воде кислорода падает настолько,
что это сопровождается не только заморами рыбы, но и невозможностью
нормального функционирования микробиологических сообществ.
Происходит деградация водной экосистемы. В проточных водах и в водоемах
картина последствий загрязнения бытовыми стоками выглядят по-разному.
В проточных водах образуются четыре, следующие друг за другом по
течению, зоны. В них совершенно четко выражены градиенты содержания
кислорода (увеличение от места сброса вниз по течению), биогенных
веществ и БПК5 (соответствующее снижение), видового состава
биологических сообществ.
Первая зона – зона полной деградации, где происходит смешивание
сточных и речных вод. Далее располагается зона активного разложения, в
которой микроорганизмы разрушают большую часть попавших органических
веществ. Затем следуют зоны восстановления качества воды и, наконец,
чистой воды. 72
Еще в начале ХХ в. Р. Кольквитц и М. Марссон привели списки
индикаторных организмов для каждой из этих зон, создав так называемую
шкалу сапробности (от «сапрос», гр. – гнилой).
В первой зоне – полисапробной содержится значительное количество
нестойких органических веществ и продуктов их анаэробного распада, много
белковых веществ. Фотосинтез отсутствует, и кислород поступает в воду
только из атмосферы, полностью расходуясь на окисление. Анаэробные
бактерии вырабатывают метан, Desulfovibrio desulphuricans восстанавливает
сульфаты до сероводорода, что способствует образованию черного
сернистого железа. Благодаря этому ил черный, с запахом сероводорода.
Очень много сапрофитной микрофлоры, нитчатых бактерий, серных
бактерий, простейших – инфузорий, бесцветных жгутиковых, олигохет –
тубифицид.
В следующей за ней α-мезосапробной зоне идет аэробный распад
органических веществ. Аммонийные бактерии метаболизируют азотные
соединения с образованием аммиака. Высокое содержание углекислоты,
кислорода все еще мало, но сероводорода и метана уже нет, БПК5 составляет
десятки мг л -1 . Сапрофитные бактерии исчисляются десятками и сотнями
тысяч в 1 мл. Железо присутствует в окисной и закисной формах. Протекают
окислительно-восстановительные процессы. Ил серого цвета. Преобладают
организмы, приспособившиеся к недостатку кислорода и высокому
содержанию углекислоты. Много растительных организмов с миксотрофным
питанием. В массе развиваются нитчатые бактерии, грибы, осциллятории,
хламидомонады, эвглены. Встречаются сидячие инфузории, коловратки,
много жгутиковых. Много тубифицид и личинок хирономид.
В β-мезосапробной зоне практически нет нестойких органических
веществ, они почти полностью минерализовались. Сапрофитов – тысячи
клеток в мл. Содержание кислорода и углекислоты колеблется в зависимости
от времени суток. Ил желтый, идут окислительные процессы, много детрита.
Много организмов с автотрофным питанием, наблюдается цветение воды. 73
Встречаются диатомеи, зеленые, много протококковых водорослей.
Появляется роголистник. Много корненожек, солнечников, инфузорий,
червей, моллюсков, личинок хирономид. Встречаются ракообразные и рыбы.
Олигосапробная зона соответствует зоне чистой воды. Цветения не
бывает, содержание кислорода и углекислоты постоянно. На дне мало
детрита, автотрофных организмов и червей, моллюсков, хирономид. Много
личинок поденок, веснянок, можно встретить стерлядь, гольяна, форель.
В водоемах замедленного водообмена картина зависит от размеров
водоема и режима сброса сточных вод. В больших водоемах (морях, крупных
озерах) вокруг постоянно действующего источника образуются,
концентрически расположенные, поли-, мезо и олигосапробная зоны. Такая
картина может сохраняться неопределенно долгое время, если
самоочистительный потенциал водоема позволяет ему справляться с
поступающей нагрузкой. Если водоем небольшой, то он трансформируется,
по мере поступления загрязнений из олигосапробного в полисапробное
состояние, а со снятием нагрузки может вернуться в олигосапробное
состояние.
73. Причины химического загрязнения и охрана почв. В последние десятилетия человек стал причиной быстрой деградации почв, хотя потери почв имели место на протяжении всей человеческой истории. Во всех странах мира сейчас распахивают около 1,5 млрд. га земель, а общие потери почв за историю человечества составили около 2 млрд. га, то есть потеряно больше, чем теперь распахивается, причем многие почвы перешли в разряд непригодных бросовых земель [6], восстановление которых или невозможно, или слишком дорого стоит. Насчитывают не менее 6 типов антропогенно-технических воздействий, которые могут вызвать разного уровня ухудшение почв. В их числе: 1) водная и ветровая эрозия, 2) засоление, подщелачивание, подкисление, 3) заболачивание, 4) физическая деградация, включая уплотнение и коркообразование, 5) разрушение и отчуждение почвы при строительстве, добыче полезных ископаемых, 6) химическое загрязнение почв [7]. Охрана почв заключается в том, чтобы предотвратить или свести к минимуму все виды разрушения почв и/или почвенного покрова [8]. Ниже мы обсудим только химическое загрязнение почв [9], которое может быть вызвано следующими причинами: 1) атмосферным переносом загрязняющих веществ (тяжелые металлы, кислые дожди, фтор, мышьяк, пестициды), 2) сельскохозяйственным загрязнением (удобрения, пестициды), 3) наземным загрязнением - отвалы крупнотоннажных производств, отвалы топливно-энергетических комплексов, 4) загрязнением нефтью и нефтепродуктами.Тяжелые металлы. Этот вид загрязняющих веществ начали изучать одним из первых. К тяжелым металлам обычно относят элементы, которые имеют атомную массу более 50. Они поступают в почву преимущественно из атмосферы с выбросами промышленных предприятий, а свинец - с выхлопными газами автомобилей. Описаны случаи, когда большие количества тяжелых металлов попадали в почву с оросительными водами, если выше водозабора в реки сбрасывались сточные воды промышленных предприятий. Наиболее типичные тяжелые металлы - свинец, кадмий, ртуть, цинк, молибден, никель, кобальт, олово, титан, медь, ванадий. Из атмосферы в почву тяжелые металлы попадают чаще всего в форме оксидов, где постепенно растворяются, переходя в гидроксиды, карбонаты или в форму обменных катионов (рис. 6). Если почва прочно связывает тяжелые металлы (обычно в богатых гумусом тяжелосуглинистых и глинистых почвах), это предохраняет от загрязнения грунтовые и питьевые воды, растительную продукцию. Но тогда сама почва постепенно становится все более загрязненной и в какой-то момент может произойти разрушение органического вещества почвы с выбросом тяжелых металлов в почвенный раствор. В итоге такая почва окажется непригодной для сельскохозяйственного использования. Общее количество свинца, которое может задержать метровый слой почвы на одном гектаре, достигает 500 - 600 т; такого количества свинца даже при очень сильном загрязнении в обычной обстановке не бывает. Почвы песчаные, малогумусные, устойчивы против загрязнения; это значит, что они слабо связывают тяжелые металлы, легко отдают их растениям или пропускают их через себя с фильтрующимися водами. На таких почвах возрастает опасность загрязнения растений и подземных вод [10] . В этом заключается одно из трудноразрешимых противоречий: легко загрязняющиеся почвы предохраняют окружающую среду, но почвы, устойчивые к загрязнению, не обладают защитными свойствами в отношении живых организмов и природных вод.Если почвы загрязнены тяжелыми металлами и радионуклидами, то очистить их практически невозможно. Пока известен единственный путь: засеять такие почвы быстрорастущими культурами, дающими большую зеленую массу; такие культуры извлекают из почвы токсичные элементы, а затем собранный урожай подлежит уничтожению. Но это довольно длительная и дорогостоящая процедура. Можно снизить подвижность токсичных соединений и поступление их в растения, если повысить рН почв известкованием или добавлять большие дозы органических веществ, например торфа. Неплохой эффект может дать глубокая вспашка, когда верхний загрязненный слой почвы при вспашке опускают на глубину 50 - 70 см, а глубокие слои почвы поднимают на поверхность. Для этого можно воспользоваться специальными многоярусными плугами, но при этом глубокие слои все равно остаются загрязненными. Наконец, на загрязненных тяжелыми металлами (но не радионуклидами) почвах можно выращивать культуры, не используемые в качестве продовольствия или кормов, например цветы. Кислые дожди. Выпадение дождей или других атмосферных осадков с высокой кислотностью - обычный результат выброса в атмосферу продуктов сжигания топлива (угля), а также выбросов металлургических и химических заводов. В составе таких выбросов много диоксида серы и/или оксидов азота; при взаимодействии с водяными парами атмосферы они образуют серную и азотную кислоты. Действие кислых дождей на почвы неоднозначное. В северных, таежных зонах они увеличивают вредную кислотность почв, способствуют повышению содержания в почвах растворимых соединений токсичных элементов - свинца, алюминия. При этом усиливается и разложение почвенных минералов. Реальный путь борьбы с подкислением таежных почв - установка на заводских трубах фильтров, перехватывающих оксиды серы и азота. Для борьбы с подкислением почв можно использовать также известкование. Однако кислотные дожди в ряде случаев могут быть и полезны. В частности, они обогащают почвы азотом и серой, которых на очень больших территориях явно недостаточно для получения высоких урожаев. Если же такие дожди выпадают в районах распространения карбонатных, а тем более щелочных почв, то они снижают щелочность, увеличивая подвижность элементов питания, их доступность растениям. Поэтому полезность или вредность каких-либо выпадений нельзя оценивать по упрощенным однозначным критериям, а необходимо рассматривать конкретно и дифференцированно по типам почв. Промышленные отвалы. Атмосферные выбросы, содержащие оксиды различных токсичных металлов и неметаллов, распространяются на большие расстояния, измеряемые десятками и сотнями километров. Поэтому вызываемые ими загрязнения имеют региональный, а иногда и глобальный характер. В противоположность этому крупнотоннажные отходы различных производств, отвалы гидролизного лигнина, золы тепловых электростанций, отвалы при добыче угля оказывают преимущественно локальное влияние. Такие отвалы занимают немалые площади, выводя из пользования земельные угодья, а многие из них представляют вполне конкретную опасность для окружающей среды. Отвалы угольных шахт содержат немало угля, он горит, загрязняя атмосферу. Отвалы многих горных пород содержат пирит FeS2 , который самопроизвольно на воздухе окисляется до H2SO4 ; в период дождей или снеготаяния последняя легко образует не только сильнокислые территории, но даже озерца серной кислоты в окрестностях горных выработок. Единственный путь нормализации экологической обстановки в таких местах - выравнивание отвалов, их землевание, залужение, лесные посадки. Большой опыт рекультивации таких территорий накоплен учеными Днепропетровского университета под руководством профессора А.И. Травлеева.Многие местные органические отходы, такие, как гидролизный лигнин, птичий помет, свиной навоз, можно превратить или в хорошие компосты, или в так называемый биогумус (вермикомпост). В основе последнего способа лежит быстрая переработка органических отходов некоторыми гибридами красных земляных червей, так называемая вермикультура (от латинского vermis - червь). Черви пропускают через кишечник все растительные остатки, превращая их в черноземоподобную массу, очень плодородную, практически без запаха, в которой содержится много гуминовых кислот. Нефть и нефтепродукты. Нефтяное загрязнение почв относится к числу наиболее опасных, поскольку оно принципиально изменяет свойства почв, а очистка от нефти очень сильно затруднена [10]. Нефть попадает в почву при различных обстоятельствах: при разведке и добыче нефти, при авариях на нефтепроводах, при авариях речных и морских нефтеналивных судов. Различные углеводороды попадают в почву на нефтебазах, бензозаправках и т.п. Последствия для почв, вызванные нефтезагрязнением, можно без преувеличения назвать чрезвычайными. Нефть обволакивает почвенные частицы, почва не смачивается водой, гибнет микрофлора, растения не получают должного питания. Наконец, частицы почвы слипаются, а сама нефть постепенно переходит в иное состояние, ее фракции становятся более окисленными, затвердевают, и при высоких уровнях загрязнения почва напоминает асфальтоподобную массу. Бороться с таким явлением очень трудно. При малых уровнях загрязнения помогает внесение удобрений, стимулирующих развитие микрофлоры и растений. В результате нефть частично минерализуется, некоторые ее фрагменты входят в состав гуминовых веществ и почва восстанавливается. Но при больших дозах и длительных сроках загрязнения в почве происходят необратимые изменения. Тогда наиболее загрязненные слои приходится просто удалять.
74. Радиоактивные отходы атомно-энергетических предприятий, проблемы захоронения. Радиоактивные отходы (РАО) — отходы, содержащие радиоактивные изотопы химических элементов и не имеющие практической ценности. Согласно российскому «Закону об использовании атомной энергии» (от 21 ноября 1995 года № 170-ФЗ) радиоактивные отходы (РАО) — это ядерные материалы и радиоактивные вещества, дальнейшее использование которых не предусматривается. По российскому законодательству, ввоз радиоактивных отходов в страну запрещен.
Источники появления отходов
Радиоактивные отходы образуются в различных формах с весьма разными физическими и химическими характеристиками, такими, как концентрации и периоды полураспада составляющих их радионуклидов. Эти отходы могут образовываться:
в газообразной форме, как, например, вентиляционные выбросы установок, где обрабатываются радиоактивные материалы;
в жидкой форме, начиная от растворов сцинтилляционных счётчиков из исследовательских установок до жидких высокоактивных отходов, образующихся при переработке отработавшего топлива;
в твёрдой форме (загрязнённые расходные материалы, стеклянная посуда из больниц, медицинских исследовательских установок и радиофармацевтических лабораторий, остеклованные отходы от переработки топлива или отработавшего топлива от АЭС, когда оно считается отходами).
Примеры источников появления радиоактивных отходов в человеческой деятельности:
ПИР (природные источники радиации). Существуют вещества, обладающие природной радиоактивностью, известные как природные источники радиации (ПИР). Бо́льшая часть этих веществ содержит долгоживущие нуклиды, такие как калий-40, рубидий-87 (являются бета-излучателями), а также уран-238, торий-232 (испускают альфа-частицы) и их продукты распада.
Работа с такими веществами регламентируются санитарными правилами, выпущенными Санэпиднадзором.[3]
Уголь. Уголь содержит небольшое число радионуклидов, таких как уран или торий, однако содержание этих элементов в угле меньше их средней концентрации в земной коре.
Их концентрация возрастает в зольной пыли, поскольку они практически не горят.
Однако радиоактивность золы также очень мала, она примерно равна радиоактивности чёрного глинистого сланца и меньше, чем у фосфатных пород, но представляет известную опасность, так как некоторое количество зольной пыли остаётся в атмосфере и вдыхается человеком. При этом совокупный объём выбросов достаточно велик и составляет эквивалент 1000 тонн урана в России и 40000 тонн во всём мире.
Нефть и газ. Побочные продукты нефтяной и газовой промышленности часто содержат радий и продукты его распада. Сульфатные отложения в нефтяных скважинах могут быть очень богаты радием; вода, нефть и газ в скважинах часто содержат радон]. При распаде радон образует твёрдые радиоизотопы, образующие осадок внутри трубопроводов. На нефтеперерабатывающих заводах участок производства пропана обычно является одной из самых радиоактивных зон, так как радон и пропан обладают одинаковой температурой кипения.
Обогащение полезных ископаемых. Отходы, полученные при обогащении полезных ископаемых, могут обладать природной радиоактивностью.
Медицинские РАО. В радиоактивных медицинских отходах преобладают источники бета- и гамма-лучей. Эти отходы разделены на два основных класса. В диагностической ядерной медицине используются короткоживущие гамма-излучатели, такие как технеций-99m (99Tcm). Большая часть этих веществ распадается в течение короткого времени, после чего может быть утилизирована как обычный мусор. Примеры других изотопов, используемых в медицине (в круглых скобках указан период полураспада): Иттрий-90, используется при лечении лимфом(2,7 дня); Иод-131, диагностика щитовидной железы, лечение рака щитовидной железы (8 дней);Стронций-89, лечение рака костей, внутривенные инъекции (52 дня); Иридий-192, брахитерапия (74 дня); Кобальт-60, брахитерапия, внешняя лучевая терапия (5,3 года); Цезий-137, брахитерапия, внешняя лучевая терапия (30 лет).
Промышленные РАО. Промышленные РАО могут содержать источники альфа-, бета-, нейтронного или гамма-излучения. Альфа-источинки могут применять в типографии (для снятия статического заряда); гамма-излучатели используются в радиографии; источники нейтронного излучения применяются в различных отраслях, например, при радиометрии нефтяных скважин. Пример применения бета-источников: радиоизотопные термоэлектрические генераторы для автономных маяков и иных установок в труднодоступной для человека местности (например, в горах).
