
- •«Современные сестринские технологии в подготовке пациента к проведению лабораторных методов исследований »
- •Содержание
- •Методическое пояснение
- •Показатели периферической крови
- •Состав и свойства мочи в норме и патологии
- •Состав и свойства каловых масс
- •Раздел № 3 Участие медсестры в подготовке пациента к проведению лабораторных исследований
- •Любое исследование мокроты проводится в стерильную посуду!!!
- •Сбор кала на дисбактериоз
- •Раздел № 4 Особенности проведения лабораторных методов исследования у детей
- •Основные биохимические показатели крови у детей
- •Основные биохимические показатели мочи у детей
- •Удельный вес мочи у детей в зависимости от возраста
- •Особенности сбора мочи на общий анализ у детей раннего возраста
- •Методика сбора мочи по Амбурже
- •Методика сбора мочи по Каковскому - Аддису
- •Методика сбора мочи по Рейзельману
- •Сбор кала на яйца гельминтов
- •Сбор кала на дисбактериоз
- •Нормальная микрофлора кишечника ребёнка
- •Нормативные показатели крови у детей по возрастам
- •Приложения
- •Порядок
- •Направление
- •Заключение Дата_________________________________врач__________________________
- •Направление
- •Постановка пробы по Зимницкому
- •1) С диагностической целью, для уточнения диагноза
- •2) Определяется функциональная способность почек выделять и концентрировать мочу
- •I порция
- •Преаналитические параметры
- •Литература
Свойства самого биологического материала (физико-химические, орга-
нолептические).
Стабильность исследуемого материала, его возможные превращения in vitro определяют необходимость использования специальных контейнеров, консервантов, транспортных сред, соблюдение физического режима доставки материала в лабораторию.
Последовательность взятия материала в случаях множественных иссле-дований.
4. Состояние сопроводительной документации к биоматериалу.
Для рационального распределения последовательности взятия материала медицинская сестра должна иметь общее представление о ходе лабораторного исследования. Умение заполнять направления на исследования и бланки-заказы для лаборатории помогает избежать грубых ошибок в подходах к исследованию.
Учитывая вышеизложенное, опираясь на должностные обязанности и квалификационную характеристику медицинской сестры, следует отметить, что именно взятие (включая подготовку пациента), временное хранение и отправка биоматериала для лабораторных исследований являются частью каждодневной работы сестринского персонала.
В подтверждение актуальности темы было проведено исследование готовности практикующих медицинских сестер к адекватному выполнению этой задачи («Сестринское дело» №3 2007г.). Предлагалось проанализировать готовность сестёр взять любой биологический материал для исследований. Всего были опрошены 104 медицинские сестры, женщины, со стажем практической работы 5—35 лет.
Владение навыками взятия биоматериала
2
1 — владеют в достаточной степени (20%),
2 — владеют в недостаточной степени (50%),
3 — не владют (30%)
70% респондентов отметили, что самостоятельное взятие биоматериала для лабораторий микробиологического профиля вызывает у них особые трудности. Данный факт объясняется большим разнообразием методик взятия материала при различных нозологических формах. Кроме того, направление на микробиологическую диагностику осуществляется значительно реже, чем на общеклинические лабораторные исследования.
В результате самооценки соответствия знаний преаналитического этапа лабораторной диагностики современным требованиям и необходимости усиления подготовки по данному вопросу ответы распределились следующим образом («Сестринское дело» №3 2007г.): 80% респондентов заявили об абсолютной недостаточности своих знаний; 15% отметили необходимость постоянного непрерывного обучения на рабочем месте; лишь 5% констатировали своё владение знаниями и практическими навыками преаналитического этапа исследований без дополнительного обучения.
Респонденты также отмечали отсутствие (5%) в их профессиональной деятельности каких-либо элементов обучения методам взятия и доставки биологического материала в лабораторию.
Последипломное обучение по взятию биоматериала
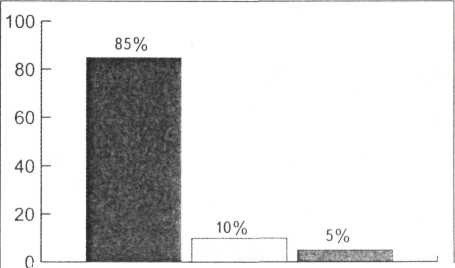
85% — только в
медучилище (колледже),
10%
— постоянно
обучаются на рабочем месте,
5%
—нет последипломного
обучения
Авторы исследования подчёркивают, что приведённые ими данные являются субъективными, но безусловно достаточными для организации и проведения обучения по исследуемому вопросу на последипломном этапе. Но и на базом уровне сестринского образования необходимо усилить подготовку по преаналитическому этапу исследований, начиная с профилирующей дисциплины «Основы сестринского дела».
ОСНОВНЫЕ ПРАВИЛА ВЗЯТИЯ И ТРАНСПОРТИРОВАНИЯ
БИОЛОГИЧЕСКОГО МАТЕРИАЛА:
Биоматериал необходимо брать в объёме, достаточном для получения достоверных результатов.
При взятии и транспортировке материала исключить возможность загрязнения его микрофлорой внешней среды, не имеющей отношения к объекту исследования.
Собранный биологический материал должен быть промаркирован. Обязательно указать в сопроводительном бланке-направлении:
цель исследования (предварительный диагноз);
фамилию, имя, отчество, возраст больного, дату и время взятия пробы;
четкие данные об учреждении, направившем материал;
при необходимости дополнительные данные о пациенте: курение, прием алкоголя, сопутствующие заболевания и их лекарственную терапию и др.
При взятии материала обязательно учитывают пути максимального выведения возбудителя инфекционного заболевания или локализацию биологического субстрата с предельно возможными измененными параметрами.
Любая ёмкость, в которой доставляется исследуемый материал в лабораторию, должна быть закрыта и направление прилагается в отдельном пакете.
Предельно внимательно относиться к срокам хранения материала до отправки его в лабораторию. Предельный срок хранения образцов для микробиологического исследования —1,5-2 ч.
Взятие венозной крови осуществляется после 15-минутного отдыха пациента, пациент во время процедуры сидит. Предусмотрено лежачее положение больных, находящихся в тяжелом состоянии и состоянии средней тяжести.
Перед взятием крови из вены необходимо осмотреть место венепункции: исключить места шрамов, гематом, места введения растворов и пр.
Кровь берется натощак, утром, желательно использование приспособлений типа «вакутейнеров», что способствует соблюдению условий асептики, ускоряет процедуру, улучшает воздействие антикоагулянта.
Использование коммерческих контейнеров с консервантами и транспортными средами увеличивает вероятность достоверного лабораторного ответа. Это достигается благодаря тому, что обеспечивается герметичность, стерильность, физико-химическая сохранность проб. Образование возможно инфицированного аэрозоля при открытии ёмкости с материалом является серьезной проблемой для медицинского персонала лабораторий, поэтому особое значение приобретает доставка биоматериала именно в стандартной посуде. Защитные очки и маски используются для предотвращения капельного заражения.
Строгое соблюдение правил асептики и антисептики при взятии крови является обязательным условием обеспечения безопасности профессиональной деятельности медицинских сестер.
Категорически запрещается помещать в пробирки бланки с направлением, обертывать ими пробирки.
Запрещается переливание крови и других жидких биологических субстратов через край пробирки на любом этапе работы с образцом.
Пробирки маркируются только карандашом по стеклу, запрещается использование каких-либо наклеек.
Записи в любом виде медицинской документации должны производиться только на отдельных, специально отведенных для этих целей столах.
Материал доставляется в лабораторию с учетом правил транспортировки для данного исследования лицами, прошедшими специальный инструктаж. Не допускаются к использованию для доставки материала деревянные штативы, хозяйственные сумки, чемоданы, другой подручный багаж. Пробирки, флаконы и другие емкости, закрытые непромокаемыми завинчивающимися крышками, доставляются в специальных металлических или пластмассовых штативах, помещенных в специальные ящики-контейнеры. Если материал чувствителен к изменениям температуры внешней среды, необходимо помещать образцы в специальные сумки-термостаты или мобильные холодильники.
В некоторых случаях предусматривается длительная консервация материала до его исследования. Так, например, плазма может быть заморожена при температуре —20°С на длительное время. В этом случае морозильная камера специальным образом маркируется, доступ к ней строго ограничивается.
Нарушение правил взятия биологического материала влечет за собой излишние экономические затраты, что не может в косвенной степени не затронуть материальных интересов медицинской сестры любого лечебно-профилактического учреждения. Повторное взятие биоматериала у больных может вызвать отрицательные биоэтические последствия в системе взаимоотношений «медицинский работник — пациент», сформировать у больных негативное отношение к медицинским вмешательствам в целом. Отказ лаборатории от проведения исследования по причине несоблюдения правил взятия и доставки биоматериала является одной из причин серьезных медицинских ошибок.
ЭТИКО-ДЕОНТОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ЗАБОРА БИОМАТЕРИАЛА.
При инструктировании пациента о порядке взятия биологического материала для исследования необходимо стремиться к установлению терапевтического общения, этому способствует:
1. Приветствие пациента. Если медицинский работник видит пациента впервые, необходимо сообщить своё имя и должность и спросить, как обращаться к пациенту.
2. Объяснение цели и правил подготовки к предстоящему исследованию. Необходимо говорить внятно, доходчиво, не торопясь. А также попросить пациента повторить инструктаж (убедиться, что пациент понял). Если пациент затрудняется повторить, наиболее важные моменты записать на листке бумаги. Поощрять вопросы!
3. Получить согласие пациента на предстоящее исследование.
4. Обеспечить конфиденциальность при заборе биоматериала (кал, моча) у пациентов находящихся на постельном режиме (попросить выйти других пациентов, отгородить ширмой), быть предельно тактичным по отношению к пациенту.
Следуя этим несложным советам, медсестра поможет пациенту чувствовать себя в эмоциональном отношении уверенно и комфортно.
ПРАВИЛА ТЕХНИКИ БЕЗОПАСНОСТИ
В экскрементах, носоглоточных выделениях, мокроте, моче и рвотных массах концентрация ВИЧ крайне низка или ВИЧ не обнаруживается, в связи с этим риск инфицирования при контакте с указанным биологическим материалом возможен лишь при наличии примеси крови. Однако соблюдать общие меры предосторожности необходимо в любом случае, так как это позволяет предотвратить передачу других инфекционных агентов.
Меры предосторожности:
1. Избегать непосредственного контакта с биологическими жидкостями. Работать в резиновых перчатках и др. средствах защиты.
2. Не допускать боя лабораторной посуды и травм осколками стекла.
3. Обеззараживать выделения пациентов перед сливом в канализацию.
4. Немедленно убирать случайно пролитый, разбрызганный биоматериал с соблюдением всех мер инфекционной безопасности.
5. Тщательно дезинфицировать лабораторную посуду, судно и мочеприемники, петли для забора кала и др.
6. При попадании биологической жидкости выполнить все меры профилактики.
ФУНКЦИИ МЕДИЦИНСКОЙ СЕСТРЫ
В ПРЕАНАЛИТИЧЕСКОМ ПРОЦЕССЕ ЛАБОРАТОРНОГО ИССЛЕДОВАНИЯ
1. Выбрать врачебные назначения из истории болезни.
2. Выписать направления на лабораторные исследования.
3. Подготовить лабораторную посуду.
4. Обучить пациента технике сбора биологического материала для исследования или произвести забор у тяжелобольных, недееспособных, престарелых пациентов и детей.
5. Организовать доставку биологического материала в лабораторию (амбулаторным пациентам объяснить правила транспортировки материла в лабораторию).
6. Полученные результаты исследований вклеить в историю болезни (амбулаторную карту).
РАЗДЕЛ № 2
НОРМАТИВНЫЕ ПОКАЗАТЕЛИ ОСНОВНЫХ БИОЛОГИЧЕСКИХ
СРЕД ОРГАНИЗМА ЧЕЛОВЕКА И ИХ ИНТЕРПРЕТАЦИЯ.
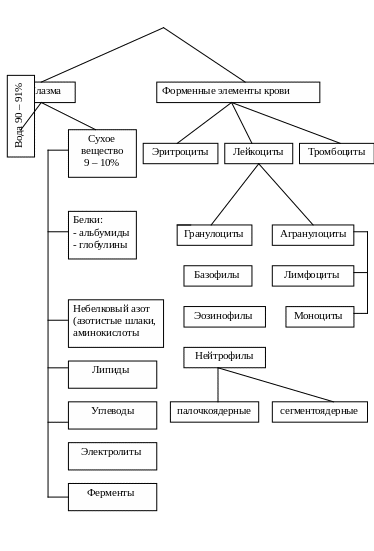
СОСТАВ
КРОВИ
Основные показатели биохимического состава плазмы крови
плазмы
|
Нормативный показатель |
Изменение содержания
Увеличение Уменьшение |
Мочевина Креатинин -мужчины -женщины Жиры Холестерин
Триглицериды а - холестерин Глюкоза Натрий Калий Хлориды Кальций Фосфор Железо -мужчины -женщины Йод белковосвязан-ный Билирубин общий Ферменты -АЛТ -АСТ -ЛДГ -щелочная фосфатаза СРБ |
Белок общий 65-85г/л Белковые фракции: Альбумины – 50-60% Глобулины: а 1 - 2,7-5,1% а 2 - 7,4-10,2% β - 11,7-15,3% γ -15,6-21,4% Фибриноген 2-4 г/л
Протромбин 80-105% 3,3-8,2 ммоль/л
62-124 мкмоль/л 44-97 мкмоль/л Липиды общие 3,5-8г/л 3,0 - 5,2 ммоль/л По Ильку до 6,3 ммоль/л 0,55-2,29 ммоль/л Более 1 ммоль/л 3,5-5,5 ммоль/л 135-150 ммоль/л 3,6-5,5 ммоль/л 95-110 ммоль/л 2,0-2,5 ммоль/л 0,64-1,3 ммоль/л
9, 5 – 30,0 мкмоль/л 8.8 – 27,0 мкмоль/л 40-80 мкг/л
8,0-20,5 мкмоль/л
до 40 ед/л до 40 ед/л до 450 ед/л до 117ед/л реакция отрицательная |
Гиперпротеинемия Гипопротеинемия
Изменение соотношения белковых фракций – диспротеинемия
Гиперфибриноген- Гипофибриноген- емия емия
Гиперазотемия
Гиперлипидемия Гиполипидемия Гиперхолестерин- Гипохолестерин- емия емия
Гипергликемия Гипогликемия Гипернатриемия Гипонатриемия Гиперкалиемия Гипокалиемия
Гиперкальциемия Гипокальциемия
Гипербилирубин- Гипобилирубин- емия емия
|
Показатели периферической крови
Единица измерения |
Норматив содержания |
Изменение содержания Увеличение Уменьшение |
х 10 12 /л
Гемоглобин, г/л
Скорость оседания эритроцитов (СОЭ)
Гематокрит, %
Цветовой показатель Ретикулоциты, %о Лейкоциты, х109 /л Лейкоцитарная формула, % Эозинофилы Базофилы Нейтрофилы - Нейтрофилы юные - Нейтрофилы палочкоядерные - Нейтрофилы сегментоядерные Лимфоциты Моноциты Тромбоциты, х 10 9 /л |
Мужчины 4,0-5,0 Женщины 3,9-4,7 Мужчины 130-160 Женщины 120-140 Мужчины 1-10 мм/ч Женщины 2-15 мм/ч Мужчины 40-48 Женщины 36-42 0,85-1,05 2-12 4,0-8,8
0,5-5 0-1 48-78 не содержатся 1-6
47-72
19-37 3-11 180-320 |
Эритроцитоз Эритропения
Ускорение Замедление
Ретикулоцитоз Лейкоцитоз Лейкопения
Эозинофилия Эозинопения Базофилия Нейтрофилёз Нейтропения
Сдвиг влево
Сдвиг вправо
Лимфоцитоз Лимфопения Моноцитоз Моноцитопения Тромбоцитоз Тромбопения
|
Состав и свойства мочи в норме и патологии
Характери-стика |
Показатель |
Норматив |
Изменения показателя |
Количество мочи
Физические свойства
Химический состав
|
Суточный диурез -дневной -ночной
Цвет
Прозрачность
Реакция
Удельный вес
Вода Мочевина Мочевая кислота Креатинин Белок
|
1-1,5 л 2/3 от суточного 1/3 от суточного
Соломенно-жёлтый
Высокая
РН от 4,5 до 8,0
1010-1025. Колеблется в течение суток от 1002 до 1030
98-99% 2% 0,05%
0,075% Не содержится. Допустимы следы белка- 0,033%о
|
Полиурия-увеличение свыше 2л Олигурия-уменьшение менее 500мл Анурия-отсутствие мочи Никтурия-преобладание ночного диуреза
Слабоокрашенная моча низкой плотности (сахарный диабет) Моча типа «мясных помоев» (гематурия) Моча цвета пива (желтуха)
Помутнение (воспалительный процесс)
Щелочная реакция
Гиперстенурия-увеличение удельного веса Гипостенурия-уменьшение удельного веса Изостенурия-отсутствие колебаний в течение суток
Протеинурия (альбуминурия)- наличие белка в моче
|
Состав мочевого осадка
|
Сахар
Желчные пигменты
Эпителий плоский
Эритроциты
Лейкоциты
Цилиндры
Кристаллы солей |
Не содержится
Не содержатся
Единичный в поле зрения микроскопа
-«-«-«-«-«-«-«
-«-«-«-«-«-«-«
Не содержатся
|
Глюкозурия – наличие сахара в моче
Наличие в осадке большого кол-ва клеток плоского, переходного и почечного эпителия
Гематурия (эритроцитурия) – наличие эритроцитов в моче. Виды: -микрогематурия – обнаруживается под микроскопом. -макрогематурия – обнаруживается по изменению окраски мочи.
Лейкоцитурия – наличие лейкоцитов в моче. Пиурия – наличие гноя в моче.
Цилиндрурия – появление цилиндров в моче.
Кристаллурия – появление кристаллов солей в осадке.
|
Состав и свойства каловых масс
Характеристика
|
Показатель |
Норматив |
Изменения |
Физические свойства
|
Цвет
|
Тёмно-коричневый
|
Чёрно-коричневый (мясная диета) Светло-коричневый (растительная диета) Коричнево-красный (неизменённая кровь) Чёрный, дёгтеобразный (изменённая кровь при кровотечении из верхних отделов пищеварительного тракта) Белый или серовато-белый (прекращение поступления желчи в кишечник, желтуха)
|
Химический состав |
Стеркобилин Кишечные ферменты Минеральные вещества Непереваренные остатки пищи
|
|
|
Микрофлора |
Кишечные бактерии
|
|
|
Раздел № 3 Участие медсестры в подготовке пациента к проведению лабораторных исследований
ВЗЯТИЕ КРОВИ ИЗ ВЕНЫ НА БИОХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ
Цель: определить количество некоторых биохимических показателей крови.
Оснащение: стерильная игла однократного применения, лоток стерильный с тампонами и пинцетом, жгут резиновый, салфетка (подложить под жгут), 70% этиловый спирт, спецодежда (очки или щиток, халат, маска, перчатки), чистые сухие пробирки в штативе, емкость с дез. средствами.
ЭТАПЫ
|
ПРИМЕЧАНИЯ
|
ПОДГОТОВКА К ПРОЦЕДУРЕ
|
|
1. Объяснить пациенту цель и ход ис-следования и получить его согласие. При необходимости дать инструктаж и составить памятку по подготовке па-циента к процедуре.
|
Взятие крови из вены проводится утром, натощак, до приема лекар-ственных средств. Рекомендуется накануне исследования не принимать жирной пищи.
|
2. Подготовить оснащение, пронуме-ровать пробирку и направление.
|
Пробирка и направление каждого пациента имеют одинаковый по-рядковый номер.
|
3. Помочь пациенту занять удобное по-ложение для венепункции лежа или сидя.
|
Зависит от тяжести состояния па-циента
|
4. Надеть защитный щиток или очки. Вымыть гигиеническим способом и осушить руки, надеть перчатки.
|
Соблюдается безопасность сестры на рабочем месте
|
5. Подложить под локоть пациенту клеенчатый валик
|
Для максимального разгибания локтевого сустава
|
6. Наложить резиновый жгут в области средней трети плеча и завязать так, чтобы петля жгута была направлена вниз, а свободные концы вверх (под жгут подложить салфетку или распра-вить рукав рубашки).
|
Жгут не должен при завязывании ущемить кожу руки, а при вене-пункции его концы не должны попасть на обработанное спиртом поле.
|
7. Попросить пациента несколько раз сжать и разжать кулак. Пропальпировать место инъекции. Найти наиболее наполненную, мало-подвижную вену.
|
Лучше пунктировать наполнен-ную и фиксированную вену.
|
8. Обработать перчатки кожным анти-септиком. |
Обеспечение инфекционной безопасности. |
9. Обработать вену в области локтевого сгиба ватными шариками, смоченными 70% спиртом двукратно, меняя их, сначала зону 10х10 см, затем 5х5, снизу вверх. Дать спирту высохнуть.
|
Обязательно соблюдать правила асептики
|
ВЫПОЛНЕНИЕ ПРОЦЕДУРЫ
|
|
1. Обхватить канюлю иглы стерильной марлевой салфеткой, снять колпачок, выполнить венепункцию (марлевую салфетку не убирать), подставить промаркированную пробирку.
|
Кровь на биохимическое иссле-дование берётся самотёком, без шприца или системой VACUET-TE (предупреждение гемолиза эритроцитов). Кровь на ВИЧ, RW берут с помощью шприца или системы VACUETTE!
|
2. Набрать необходимое количество крови (в зависимости от цели исследования, обычно 5-10 мл). Снять жгут.
|
|
3. Поставить пробирку в штатив. |
|
4. Прижать место пункции стериль-ным ватным шариком (салфеткой), смоченным 70% спиртом, извлечь иглу (затем подвергнуть её дезинфе-кции, предварительно промыв канал иглы дезраствором в определённой ёмкости с помощью шприца). |
Ватный шарик на месте пункции сдавливает вену и способствует остановке кровотечения после инъекции. Согласно приказам МЗ РФ, регламентирующим работу ЛПУ. |
5. Попросить пациента плотно при-жать спиртовый шарик к месту инъек-ции (можно зафиксировать шарик бинтом) на 5-7 мин.
|
|
ОКОНЧАНИЕ ПРОЦЕДУРЫ:
|
|
1. Помочь пациенту встать или лечь удобно.
|
Зависит от тяжести состояния пациента
|
2. Закрыть пробирку пробкой, помес-тить в жёсткий контейнер (бикс), уп-лотнив ватой или поролоном, направление в полиэтиленовом пакете. |
Во избежание инфицирования окружающей обстановки. |
3. Подвергнуть дезинфекции исполь-зованное оснащение (ватные шарики, жгут, клеёнчатую подушечку и т.д.) |
Согласно приказам МЗ РФ, регла-ментирующим работу ЛПУ. |
4. Снять перчатки, погрузить в дезраствор. |
Согласно приказам МЗ РФ, регламентирующим работу ЛПУ. |
5. Вымыть и осушить руки. |
Соблюдение личной гигиены м\с. |
6. Доставить контейнер с кровью и направлением в лабораторию.
|
|
ВЗЯТИЕ КРОВИ ИЗ ВЕНЫ НА ВИЧ – ИНФЕКЦИЮ, СИФИЛИС
Цель: обнаружение антител к возбудителю
Оснащение: шприц для однократного применения, лоток стерильный с тампонами и пинцетом, жгут резиновый, салфетка (подложить под жгут), 70% этиловый спирт, спецодежда (очки или щиток, халат, маска, перчатки), чистые сухие пробирки в штативе, емкость с дез. средствами.
ЭТАПЫ
|
ПРИМЕЧАНИЯ
|
ПОДГОТОВКА К ПРОЦЕДУРЕ
|
|
1. Объяснить пациенту цель и ход исследования и получить его согласие. При необходимости дать инструктаж и составить памятку по подготовке пациента к процедуре.
|
Взятие крови из вены проводится утром, натощак, до приема лекар-ственных средств. Рекомендуется накануне исследования не прини-мать жирной пищи.
|
2. Подготовить оснащение, пронумер-овать пробирку и направление.
|
Пробирка и направление каждого пациента имеют одинаковый по-рядковый номер.
|
3. Помочь пациенту занять удобное положение для венепункции лежа или сидя.
|
Зависит от тяжести состояния пациента
|
4. Надеть защитный щиток или очки. Вымыть гигиеническим способом и осушить руки, надеть маску, перчатки.
|
Соблюдается безопасность сестры на рабочем месте
|
5. Подложить под локоть пациенту клеенчатый валик
|
Для максимального разгибания локтевого сустава
|
6. Наложить резиновый жгут в области средней трети плеча и завязать так, чтобы петля жгута была направлена вниз, а свободные концы вверх (под жгут подложить салфетку или распра-вить рукав рубашки).
|
Жгут не должен при завязывании ущемить кожу руки, а при вене-пункции его концы не должны попасть на обработанное спиртом поле.
|
7. Попросить пациента несколько раз сжать и разжать кулак. Пропальпировать место инъекции. Найти наиболее наполненную, мало-подвижную вену.
|
Лучше пунктировать наполненную и фиксированную вену.
|
8. Обработать перчатки кожным антисептиком. |
Обеспечение инфекционной безопасности. |
9. Обработать вену в области локтевого сгиба ватными шариками, смоченными 70% спиртом двукратно, меняя их, сначала зону 10х10 см, затем 5х5, снизу вверх. Дать спирту высохнуть.
|
Обязательно соблюдать правила асептики
|
ВЫПОЛНЕНИЕ ПРОЦЕДУРЫ
|
|
1. Зафиксировать вену большим пальцем левой руки, проколоть кожу, войти в вену на 1/3 длины иглы, параллельно вене. Шприц держим так, чтобы срез иглы был сверху. Прокалываем сначала кожу, а затем стенку вены. |
Можно осуществлять процедуру с помощью шприца или системы VACUETTE!
|
2. Набрать необходимое количество крови (в зависимости от цели исследования, обычно 5 мл). Снять жгут.
|
Техника выполнения манипуляции |
3. Прижать место пункции стерильным ватным шариком (салфеткой), смочен-ным 70% спиртом, извлечь иглу (затем подвергнуть её дезинфекции, предва-рительно промыв канал иглы дезрас-твором в определённой ёмкости с помощью шприца).
|
Ватный шарик на месте пункции сдавливает вену и способствует остановке кровотечения. Если пациент без сознания место пункции фиксируют тугой повязкой. Согласно приказам МЗ РФ, регламентирующим работу ЛПУ. |
4. Выпустить медленно кровь по стенке пробирки, находящейся в штативе.
|
|
5. Закрыть пробирку стерильной крышкой и поставить её в штатив. |
|
6. Попросить пациента плотно при-жать спиртовый шарик к месту инъек-ции (можно зафиксировать шарик бинтом) на 5-7 мин.
|
После остановки кровотечения из вены использованный шарик забрать у пациента и подвергнуть обработке. |
ОКОНЧАНИЕ ПРОЦЕДУРЫ:
|
|
1. Помочь пациенту встать или лечь удобно.
|
Зависит от тяжести состояния пациента
|
2. Поместить пробирку в жёсткий контейнер (бикс), уплотнив ватой или поролоном, направление в полиэтиле-новом пакете. |
Во избежание инфицирования окружающей обстановки. |
3. Подвергнуть дезинфекции исполь-зованное оснащение (ватные шарики, жгут, клеёнчатую подушечку и т.д.) |
Согласно приказам МЗ РФ, регламентирующим работу ЛПУ. |
4. Снять перчатки, погрузить в дезраствор. |
Согласно приказам МЗ РФ, регламентирующим работу ЛПУ. |
5. Вымыть и осушить руки. |
Соблюдение личной гигиены м\с. |
6. Доставить контейнер с кровью и направлением в лабораторию.
|
|
СБОР МОЧИ ДЛЯ ОБЩЕГО КЛИНИЧЕСКОГО АНАЛИЗА.
Цель: определение физико-химических и микроскопических свойств мочи.
Оснащение: чистая сухая стеклянная ёмкость объёмом 50-200 мл; направление на исследование.
Этапы |
Обоснование |
Подготовка к процедуре: |
|
1. Информировать пациента о назначенном ему исследовании. 2. Объяснить методику сбора анализа. в амбулаторных условиях: - для сбора мочи приготовить чистую сухую емкость объемом не более 200мл. - для исследования необходима первая ут-ренняя порция мочи не менее 50мл; - перед сбором мочи провести туалет на-ружных половых органов (в направлении спереди назад); - доставить анализ мочи с направлением в лабораторию; в стационаре: - обеспечить пациента маркированной емкостью; -предупредить пациента о необходимости проведения туалета наружных половых органов (см. «Личная гигиена пациента»);
|
Соблюдение прав пациента на информацию, осознанное учас-тия в процессе. Необходимое условие проведе-ния процедуры. Обеспечение качества и досто-верности результата исследова-ния
|
Выполнение процедуры: |
|
3. Пациент утром, после туалета наружных половых органов: - выделяет первую порцию мочи в унитаз на счёт «1», «2»; - задержать мочеиспускание; - открыть ёмкость; - собрать в неё 50-200 мл мочи (при необхо-димости завершить мочеиспускание в унитаз); - закрыть ёмкость крышкой; - известить м/с о собранном анализе. |
Обеспечение качества и досто-верности результата исследования. |
Окончание процедуры: |
|
4. Оформить направление: - цель исследования; - Ф.И.О. пациента; - отделение; - № палаты; - дата и подпись м/с; - поместить направление в целлофановый пакет. 5. Снять перчатки и подвергнуть их дезинфекции. 6. Вымыть и осушить руки. 7. Поместить ёмкость с анализом в твёрдый контейнер для транспортировки в клиничес-кую лабораторию. 8. Доставить в клиническую лабораторию не позднее 1 ч. после его сбора.
|
Идентификация паспортных данных.
Обеспечение инфекционной безопасности. Исключается возможность опрокидывания ёмкости с анализом.
|
СБОР МОЧИ ПО МЕТОДУ НЕЧИПОРЕНКО.
Цель: определение форменных элементов.
Оснащение: чистая сухая стеклянная ёмкость объёмом 100 мл; направление на исследования, перчатки, емкость с дез. средством.
Этапы |
Обоснование |
ПОДГОТОВКА К ПРОЦЕДУРЕ |
|
1. Информировать пациента о назначенном ему исследовании. 2. Объяснить методику сбора анализа. в амбулаторных условиях: - для сбора мочи приготовить чистую сухую емкость объемом не более 100-200 мл. для исследования необходима средняя порция мочи; |
Соблюдение прав пациента на информацию, осознанное участия в процессе. Необходимое условие проведения процедуры. Обеспечение качества и достоверности результата исследования |
-- перед сбором мочи провести туалет наружных половых органов (в направлении спереди назад); - доставить анализ мочи с направлением в лабораторию; в стационаре: - обеспечить пациента маркированной емкостью; -предупредить пациента о необходимости проведения туалета наружных половых органов (см. «Личная гигиена пациента»); - поставить собранный анализ мочи в контейнер. |
|
Выполнение процедуры: |
|
3. Пациент утром, после туалета наружных половых органов: - выделяет первую порцию мочи в унитаз на счёт «1», «2»; - задержать мочеиспускание; - открыть ёмкость; - собрать в неё 10-15 мл мочи; - завершить мочеиспускание в унитаз; - закрыть ёмкость крышкой; - известить м/с о собранном анализе. |
Обеспечение качества и достоверности результата исследования. |
Окончание процедуры: |
|
4. Оформить направление: - цель исследования; - Ф.И.О. пациента; - отделение; - № палаты; - дата и подпись м/с; - поместить направление в целлофановый пакет. 5. Снять перчатки и подвергнуть их дезинфекции. 6. Вымыть и осушить руки. 7. Поместить ёмкость с анализом в твёрдый контейнер для транспортировки в клиническую лабораторию. 8. Доставить в клиническую лабораторию не позднее 1 ч. после его сбора. |
Идентификация паспортных данных.
Обеспечение инфекционной безопасности. Исключается возможность опрокидывания ёмкости с анализом.
|
СБОР МОЧИ ПО МЕТОДУ ЗИМНИЦКОГО.
Цель: определение выделительной и концентрационной функции почек.
Оснащение: чистая сухая стеклянная ёмкость объёмом 200 мл – 8 штук; направление на исследование.
Этапы |
Обоснование |
Подготовка к процедуре: |
|
1. Информировать пациента о назначенном ему исследовании.
2. Объяснить условия и методику сбора анализа (на фоне обычного питьевого режима и отмены мочегонных препаратов) 3. Обеспечить пациента маркированными ёмкостями. |
Соблюдение прав пациента на информацию, осознанное учас-тия в процессе. Необходимое условие проведе-ния процедуры.
Обеспечение качества и досто-верности результата исследова-ния |
Выполнение процедуры: |
|
4. В 6 часов утра пациент мочится в унитаз. С 6часов до 6 часов утра следующего дня собирает всю мочу в соответствующую ёмкость: - №1 6.00 - 9.00 - №2 9.00 - 12.00 - №3 12.00 - 15.00 - №4 15.00 - 18.00 - №5 18.00 - 21.00 - №6 21.00 - 24.00 - №7 24.00 -3.00 - №8 3.00 - 6.00 Необходимо предупредить пациента, что если мочи в течение 3 часов не окажется, ёмкость должна остаться пустой. Если ёмкости не хватит, необходимо взять еще одну и указать на ней номер той же порции. |
Обеспечение качества и достовер-ности результата исследования.
Для заполнения ночных порций пациента необходимо будить. |
ОКОНЧАНИЕ ПРОЦЕДУРЫ |
|
5. Оформить направления: - цель исследования, № порции; - Ф.И.О. пациента;
- № палаты;- - дата и подпись м/с; - поместить направления в целлофановый пакет. |
Идентификация паспортных данных.
|
6. Снять перчатки и подвергнуть их дезинфекции. 7. Вымыть и осушить руки. 8. Поместить ёмкости с мочой в твёрдый контейнер для транспортировки в клиничес-кую лабораторию. 9. Доставить в клиническую лабораторию не позднее 1 ч. после его сбора.
|
Обеспечение инфекционной безопасности. Исключается возможность опрокидывания ёмкости с анализом.
|
СБОР МОЧИ НА БАКТЕРИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ.
Цель: определение возбудителей заболевания и чувствительности микрофлоры к антибиотикам.
Оснащение: стерильная стеклянная ёмкость, полученная в бактериологической лаборатории, направление на исследование, бумажное полотенце, салфетки, маркер.
Этапы |
Обоснование |
Подготовка к процедуре: |
|
1. Информировать пациента о назначенном ему исследовании. 2. Предупредить пациента о необходимости проведения тщательного туалета наружных половых органов перед взятием мочи на исследование (см. «Личная гигиена пациен-та»). Оформить направление, поместить в целло-фановый пакет и выдать пациенту промар-кированную стерильную емкость для сбора мочи |
Соблюдение прав пациента на информацию, осознанного участия в процессе. Обеспечение качества и досто-верности результата исследова-ния. |
Выполнение процедуры: |
|
3. Обучить технике сбора мочи на исследо-вание: -открыть крышку стерильной ёмкости, не касаясь её внутренней поверхности и краёв баночки; -положить крышку внутренней поверхно-стью вверх на бумажное полотенце; -начать мочеиспускание в унитаз на счёт «1», «2»; |
|
-задержать мочеиспускание; -подставить ёмкость для сбора мочи; -выделить мочу в емкость в количестве не менее 10 мл и задержать мочеиспускание; - завершить мочеиспускание в унитаз. 4. Закрыть ёмкость с выделенной мочой крышкой, не касаясь внутренней поверхнос-ти крышки емкости. 5. Вымыть и осушить руки. |
Обеспечение качества и достоверности результата исследования.
Соблюдение правил личной гигиены. |
Окончание процедуры: |
|
6. Направление в целлофановом пакете вместе с емкостью с мочой поместить в кон-тейнер для транспортировки в бактериоло-гическую лабораторию не позднее 2-х часов Если невозможно доставить анализ в ла-бораторию немедленно, следует хранить при комнатной температуре не более 24 часов. |
Необходимое условие проведения исследования. Идентификация паспортных данных. |
При сборе мочи в период менструального цикла женщине необходимо после туалета наружных половых органов закрыть вход во влагалище ватно-марлевым тампоном (Tampex). Повторить туалет наружных половых органов и провести сбор мочи на исследование по схеме (см. выше).
СБОР МОЧИ НА АМИЛАЗУ
Цель: определение количества диастазы в моче (фермента поджелудочной железы).
Оснащение: чистая сухая стеклянная ёмкость объёмом 100 мл; направление на исследование, емкость с дез. средством..
Этапы |
Обоснование |
Подготовка к процедуре: |
|
1. Информировать пациента о назначенном ему исследовании. 2. Объяснить условие и методику сбора анализа. в амбулаторных условиях: - для сбора мочи приготовить чистую сухую емкость объемом 100мл. - для исследования необходима моча, доставленная на исследование сразу после мочеипускания;
|
Соблюдение прав пациента на информацию, осознанное учас-тия в процессе. Необходимое условие проведе-ния процедуры. Обеспечение качества и досто-верности результата исследова-ния |
- перед сбором мочи провести туалет на-ружных половых органов (в направлении спереди назад); - доставить анализ мочи тёплым, с на-правлением в лабораторию; в стационаре: - обеспечить пациента маркированной емкостью; - предупредить пациента о необходимости проведения туалета наружных половых органов и своевременном информировании м/с о собранном анализе (см. «Личная гигиена пациента»); - поставить собранный анализ мочи в контейнер. |
|
ВЫПОЛНЕНИЕ ПРОЦЕДУРЫ |
|
3. В 8 часов утра после туалета наружных половых органов: - открыть ёмкость; - выделить 10 мл. мочи в ёмкость; - закрыть ёмкость крышкой; - известить м/с о собранном анализе.
|
Обеспечение качества и досто-верности результата исследова-ния.
Для исследования достаточно 10 мл. |
Окончание процедуры: |
|
4. Оформить направление: - цель исследования; - Ф.И.О. пациента; - отделение; - № палаты; - дата и подпись м/с; - поместить направление в целлофановый пакет. 5. Снять перчатки и подвергнуть их дезин-фекции. 6. Вымыть и осушить руки. 7. Поместить ёмкость с анализом в твёрдый контейнер для транспортировки в клини-ческую лабораторию. 8. Доставить в биохимическую лаборато-рию не позднее 1 ч. после его сбора. |
Идентификация паспортных данных.
Обеспечение инфекционной безопасности. Исключается возможность опрокидывания ёмкости с анализом.
|
СБОР МОЧИ НА САХАР ИЗ СУТОЧНОГО КОЛИЧЕСТВА.
Цель: определение сахара в моче с целью диагностики сахарного диабета.
Оснащение: две чистые, стеклянные ёмкости: 3-х литровая, мерная с крышкой и на 200 мл; пластмассовая палочка для перемешивания мочи; на-правление на исследование, перчатки, ёмкость для дезинфекции перчаток.
Этапы |
Обоснование |
|
Подготовка к процедуре: |
||
1. Информировать пациента о назначенном исследовании. 2. Объяснить методику сбора анализа, сообщить, что ему необходимо: - соблюдать обычный водно-пищевой и двигательный режим; - мочу собирать в течение суток. |
Соблюдение права пациента на информацию, осознанное участ-ие в процессе. |
|
В амбулаторных условиях обучить пацие-нта правилам подготовки посуды для сбора и доставки мочи в лабораторию (чистая, стеклянная, сухая 3-х литровая емкость для сбора мочи и 200 мл - для доставки в лабораторию). |
|
|
Выполнение процедуры: |
||
2. Обучить пациента методике сбора анализа: -в 6 часов предложить пациенту выпустить мочу в унитаз (моча, скопившаяся за ночь в мочевом пузыре, не учитывается); -в течение суток (до 6 часов утра следую-щего дня) собирать всю выделяемую мочу в большую ёмкость и хранить её в прохладном месте; -измерить общее количество мочи (суточ-ный диурез); -осторожно перемешать суточное количес-тво мочи в банке; -отлить 50 мл мочи в отдельно приготовленную ёмкость для доставки в лабораторию. В стационаре это делает м/с, предварительно вымыв руки и надев перчатки. |
Ёмкость с мочой, в закрытом виде, подписанную, хранить в санитарной комнате или туалете в прохладном месте.
В условиях стационара это делает мед. сестра.
Обеспечение качества и досто-верности результата исследова-ния.
Соблюдение правил личной ги-гиены и инфекционной безо-пасности м/с.
|
|
Завершение процедуры: |
||
4. Промаркировать емкость, оформить направление, где должны быть указаны: -цель исследования -Ф.И.О. пациента -общее количество мочи за сутки -отделение -№ палаты -дата и подпись м/с. - поместить направление в целлофано-вый пакет. 5. Поместить емкость с мочой в кон-тейнер для транспортировки в лабо-раторию. 6. Снять перчатки и подвергнуть их дезинфекции. 7. Вымыть и осушить руки. 8. Доставить анализ мочи в биохими-ческую лабораторию в твёрдом кон-тейнере не позднее 1 часа с момента сбора. В амбулаторных условиях объяснить пациенту, что в направление необхо-димо указать суточное количество мочи, что пациент должен сделать самостоятельно |
Идентификация паспортных данных.
Согласно приказам МЗ РФ. Обеспечение инфекционной безопас-ности. Соблюдение правил личной гигиены. Обеспечение объективности исследо-вания |
|
СБОР МОКРОТЫ ДЛЯ ОБЩЕГО КЛИНИЧЕСКОГО АНАЛИЗА.
Цель: определение физико-химических свойств и клеточный состав
Оснащение: стерильная широкогорлая стеклянная ёмкость с крышкой, направление на исследование, кипячёная вода 370 С, контейнер для транспортировки.
Этапы |
Обоснование |
Подготовка к процедуре: |
|
1. Информировать пациента о назначенном ему исследовании. 2. Объяснить методику сбора анализа. в амбулаторных условиях: - для сбора мокроты приготовить стериль-ную емкость с крышкой объемом не более 200мл. - сбор проводится натощак, после предварительной чистки зубов и ополаски-вания ротоглотки кипячённой водой - сделать 2-3 глубоких вдоха и откашлять мокроту в подготовленную ёмкость, при-мерно 3-5 мл - доставить анализ мокроты с направлением в лабораторию; в стационаре: - обеспечить пациента маркированной ем-костью; -предупредить пациента о необходимости сбора мокроты натощак, после предвари-тельной чистки зубов и ополаскивании ро-тоглотки кипячённой водой; - поставить собранный анализ мокроты в контейнер. |
Соблюдение прав пациента на информацию, осознанное учас-тие в процессе.
Необходимое условие проведе-ния процедуры. Обеспечение качества и досто-верности результата исследова-ния
Мокрота собирается при кашле, а не при отхаркивании
|
Выполнение процедуры: |
|
3. Пациент утром, натощак должен: - почистить зубы, прополоскать ротоглотку кипячёной водой; - сделать 2-3 глубоких вдоха и откашлять мокроту в подготовленную ёмкость, пример-но 3-5 мл; - закрыть ёмкость крышкой;
|
Обеспечение качества и достоверности результата исследования.
Не допустить попадания слюны в ёмкость с мокротой |
Окончание процедуры: |
|
4. Оформить направление: - цель исследования; - Ф.И.О. пациента; - отделение; - № палаты; - дата и подпись м/с; - поместить направление в целлофановый пакет. 5. Поместить ёмкость с анализом в твёрдый контейнер для транспортировки в клиничес-кую лабораторию. 6. Доставить в клиническую лабораторию не позднее 1 ч. после его сбора.
|
Идентификация паспортных данных.
Исключается возможность опро-кидывания ёмкости с анализом.
|
СБОР МОКРОТЫ НА БАКТЕРИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ
Цель: выявление возбудителя патологического процесса, подбор антибиотика, эффективного при данном возбудителе
Оснащение: стерильная ёмкость (готовит бактериологическая лаборатория); направление на исследование, контейнер для транспортировки
Этапы |
Обоснование |
|
Подготовка к процедуре: |
||
1. Информировать пациента о назначенном ему исследовании. 2. Объяснить методику сбора анализа. в амбулаторных условиях: - для сбора мокроты приготовить стериль-ную емкость (взять в бактериологической лаборатории) объемом не более 200мл. - сбор проводится натощак, после предвари-тельной чистки зубов и ополаскивания ро-тоглотки кипячёной водой - сделать 2-3 глубоких вдоха - открыть крышку стерильной ёмкости, не касаясь внутренней стороны крышки и краёв ёмкости; - откашлять мокроту в подготовленную ём-кость, примерно 3-5 мл - закрыть ёмкость крышкой; - доставить анализ мокроты с направле-нием в бактериологическую лабораторию;
в стационаре: - обеспечить пациента стерильной ёмко-стью; - объяснить правила работы с ней; -предупредить пациента о необходимости сбора мокроты натощак, после предвари-тельной чистки зубов и ополаскивании ро-тоглотки кипячёной водой; - сразу известить м/с о собранном анализе; - поставить собранный анализ мокроты в контейнер. |
Соблюдение прав пациента на информацию, осознанное учас-тие в процессе. Сбор мокроты проводится до начала лечения антибиотиков или антибактериальные препа-раты должны быть отменены за 2- суток до сбора материала Необходимое условие проведе-ния процедуры. Обеспечение качества и досто-верности результата исследова-ния Мокрота собирается при кашле, а не при отхаркивании
|
|
Выполнение процедуры: |
||
3. Пациент утром, натощак должен: - почистить зубы, прополоскать ротоглотку кипячёной водой; - сделать 2-3 глубоких вдоха - открыть крышку стерильной ёмкости - откашлять мокроту в подготовленную ём-кость, примерно 3-5 мл; - закрыть ёмкость крышкой; - известить м/с о собранном анализе |
Обеспечение качества и досто-верности результата исследования.
Не касаться внутренней поверх-ности крышки и краёв ёмкости Не допустить попадания слюны в ёмкость с мокротой |
|
Окончание процедуры: |
||
4. Оформить направление: - цель исследования; - Ф.И.О. пациента; - отделение; - № палаты; - дата и подпись м/с; - поместить направление в целлофано-вый пакет. 5. Поместить ёмкость с анализом в твёрдый контейнер для транспор-тировки в лабораторию. 6. Доставить в бактериологическую лабораторию. |
Идентификация паспортных данных.
Исключается возможность опрокиды-вания ёмкости с анализом.
|
|
СБОР МОКРОТЫ НА МИКОБАКТЕРИИ ТУБЕРКУЛЁЗА
(для микроскопического исследования)
Цель: диагностика туберкулёза
Оснащение: стерильная ёмкость из тёмного стекла с крышкой; направление на исследование, кипячёная вода 370 С, перчатки, емкость с дез. средством.
Этапы |
Обоснование |
Подготовка к процедуре: |
|
1. Информировать пациента о назначенном ему исследовании. 2. Объяснить методику сбора анализа, техни-ку откашливания мокроты |
Соблюдение прав пациента на информацию, осознанное участие в процессе.
|
Выполнение процедуры: |
|
3. Обучить пациента методике сбора мокро-ты: - прополоскать ротоглотку кипячёной водой непосредственно перед сбором мокроты; - при отсутствии кашля сделать 2-3 глубоких вдоха и аккуратно, не испачкав банку снару-жи, откашлять мокроту в подготовленную ёмкость; - закрыть ёмкость крышкой и поставить в специальный контейнер в санитарной ком-нате при достаточно собранном количестве мокроты (15-20 мл) - известить м/с о собранном анализе. |
Обеспечение качества и досто-верности результата исследова-ния.
Мокрота собирается при кашле, а не при отхаркивании
Если мокрота выделена в малом ко-личестве, её накапливают в течение 1-3 суток, сохраняя на средней полке двери холодиль-ника (или в прохладном месте). Также можно собирать ночную мокроту. |
Окончание процедуры: |
|
4. Оформить направление: - цель исследования; - Ф.И.О. пациента; - отделение; - № палаты; - дата и подпись м/с; - поместить направление в целлофановый пакет. 5. Поместить ёмкость с анализом в твёрдый контейнер для транспортировки в лаборато-рию. 6. Снять перчатки, подвергнуть их дезин-фекции; 7. Вымыть и осушить руки; 6. Доставить в клиническую лабораторию; |
Идентификация паспортных данных.
Исключается возможность опро-кидывания ёмкости с анализом. Обеспечение инфекционной безопасности |
Врач может назначить и бактериологическое исследование мокроты на туберкулёз, и этот метод является более чувствительным, чем бактериоскопический (достаточно несколько десятков микобактерий в 1 мл исследуемого материала). Но в некоторых случаях микобактерии могут не дать роста на питательных средах, в то время как при бактериоскопии они выявляются.
Любое исследование мокроты проводится в стерильную посуду!!!
СБОР МОКРОТЫ НА АТИПИЧНЫЕ КЛЕТКИ
Цель: выявление опухолевых клеток
Оснащение: стерильная ёмкость с крышкой; направление на исследование, кипячёная вода 370 С
Этапы |
Обоснование |
Подготовка к процедуре: |
|
1. Информировать пациента о назначенном ему исследовании. 2. Объяснить методику сбора анализа. в амбулаторных условиях: - для сбора мокроты приготовить стериль-ную емкость с крышкой объемом не более 200мл. - сбор проводится натощак, после предва-рительной чистки зубов и ополаскивания ротоглотки кипячёной водой - сделать 2-3 глубоких вдоха и откашлить мокроту в подготовленную ёмкость, примерно 3-5 мл - как можно быстрее доставить анализ мокроты с направлением в лабораторию;
в стационаре: - обеспечить пациента маркированной ем-костью; -предупредить пациента о необходимости сбора мокроты натощак, после предвари-тельной чистки зубов и ополаскивании ро-тоглотки кипячённой водой; - сразу известить м/с о собранном анализе;
|
Соблюдение прав пациента на информацию, осознанное учас-тие в процессе.
Необходимое условие проведе-ния процедуры. Обеспечение качества и досто-верности результата исследова-ния
Мокрота собирается при кашле, а не при отхаркивании Атипичные клетки быстро раз-рушаются
|
Выполнение процедуры: |
|
3. Пациент утром, натощак должен: - почистить зубы, прополоскать ротоглотку кипячёной водой; - сделать 2-3 глубоких вдоха и откашлять мокроту в подготовленную ёмкость, пример-но 3-5 мл; - закрыть ёмкость крышкой; - известить м/с о собранном анализе.
|
Обеспечение качества и досто-верности результата исследова-ния.
Не допустить попадания слюны в ёмкость с мокротой |
Окончание процедуры: |
|
4. Оформить направление: - цель исследования; - Ф.И.О. пациента; - отделение; - № палаты; - дата и подпись м/с; - поместить направление в целлофановый пакет. 5. Поместить ёмкость с анализом в твёрдый контейнер для транспортировки в цитологи-ческую лабораторию. 6. Доставить в цитологическую лабораторию как можно быстрее. |
Идентификация паспортных данных.
Исключается возможность опро-кидывания ёмкости с анализом.
Атипичные клетки быстро раз-рушаются |
СБОР КАЛА НА КОПРОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ
(ОБЩИЙ АНАЛИЗ КАЛА)
Цель: оценить степень усвоения пищи, обнаружить нарушение желчевыделе-ние, выявить скрытое кровотечение, обнаружить воспалительные изме-нения, выявить наличие паразитов;
Оснащение: чистая, сухая ёмкость из светлого стекла; направление на исслед-ование; деревянный шпатель для сбора кала (однократного примене-ния); перчатки; ёмкость с дезраствором для дезинфекции перчаток.
Этапы |
Обоснование |
Подготовка к процедуре: |
|
1. Объяснить пациенту цель исследо-вания, методику сбора анализа: — за 3 дня до исследования необходимо избегать пищевых про-дуктов, содержащих железо: мясо, ры-ба, все виды зелёных овощей; — кал должен быть без примеси мочи и воды, собран желательно утром. Примечание: должны быть отменены лекарственные средства изменяющие вид фекалий и усиливающие периста-льтику кишечника: слабительные, ваго- и симпатотропные средства: эфедрин, прозерин, бария сульфат, препараты висмута, железа и препа-раты, вводимые в ректальных свечах, приготовленных на жировой основе. |
Этот анализ позволяет получить досто-верную информацию о макроскопи-ческом, микроскопическом и хими-ческом составе кала, пищеварительной функции ЖКТ.
Если необходимо изучить степень усвоения пищи, а именно белков, жиров, углеводов, то применяют, по назначению врача, диеты Шмидта и Певзнера, содержащие точно дозиро-ванные определённые наборы продуктов. |
Выполнение процедуры: |
|
2. Вымыть и осушить руки, надеть перчатки. |
Соблюдение правил инфекционной безопасности. |
3. Используя шпатель собрать 5-10 г кала в подготовленную ёмкость, плотно закрыть крышкой. |
Анализ собирается на 3-4-5 день (трёхкратно) со дня начала подготов-ки, при условии ежедневного опорож-нения кишечника. При необходимости собирают всю порцию кала за одну дефекацию. |
Окончание процедуры: |
|
4. Использованный шпатель подвер-гнуть дезинфекции. |
Согласно приказам МЗ СССР и РФ, регламентирующим работу ЛПУ по санитарно-противоэпидемическому режиму. |
5. Прикрепить направление, где должны быть указаны: -цель исследования -Ф.И.О. пациента -отделение -№ палаты -дата и подпись м/с, проводившей забор анализа. |
Обеспечение преемственности в работе. |
6. Снять перчатки и погрузить в дезраствор на время дезинфекционной выдержки. |
Соблюдение правил инфекционной безопасности. |
7. Вымыть и осушить руки. |
Соблюдение правил личной гигиены. |
8. Доставить в твёрдом контейнере в клиническую лабораторию. |
Не позднее чем через 1 час с момента сбора. |
СБОР КАЛА НА ПРОСТЕЙШИЕ И ЯЙЦА ГЛИСТОВ
Цель: обнаружение вегетативных форм простейших, различных видов гельминтов;
Оснащение: чистая, сухая ёмкость из светлого стекла; направление на иссле-дование; деревянный шпатель для сбора кала (однократного приме-нения); перчатки; ёмкость с дезраствором для дезинфекции перча-ток.
Этапы |
Обоснование |
Подготовка к процедуре: |
|
1. Объяснить пациенту цель исследо-вания, методику сбора анализа.
|
Этот анализ позволяет получить ин-формацию о наличии глистной инва-зии |
Выполнение процедуры: |
|
2. Вымыть и осушить руки, надеть перчатки. |
Соблюдение правил инфекционной безопасности. |
3. Используя шпатель собрать 5-10 г кала из разных мест в подготовленную ёмкость, плотно закрыть крышкой. |
После проведённого лечения врач может назначить исследование всей порции кала за одну дефекацию. |
Окончание процедуры: |
|
4. Использованный шпатель подвер-гнуть дезинфекции. |
Согласно приказам МЗ СССР и РФ, регламентирующим работу ЛПУ по санитарно-противоэпидемическому режиму. |
5. Прикрепить направление, где должны быть указаны: -цель исследования -Ф.И.О. пациента -отделение -№ палаты -дата и подпись м/с, проводившей забор анализа. |
Обеспечение преемственности в работе. |
6. Снять перчатки и погрузить в дез-раствор на время дезинфекционной выдержки. |
Соблюдение правил инфекционной безопасности. |
7. Вымыть и осушить руки. |
Соблюдение правил личной гигиены. |
8. Доставить в твёрдом контейнере в клиническую лабораторию. |
Не позднее чем через 15-20 мин. с момента сбора (тёплым). Исследование проводится многократ-но (3-5 раз). |
СБОР КАЛА НА СКРЫТУЮ КРОВЬ
Цель: обнаружение скрытого кровотечения при патологии желудочно-кишечного тракта;
Оснащение: чистая, сухая ёмкость из светлого стекла; направление на иссле-дование; деревянный шпатель для сбора кала (однократного приме-нения); перчатки; ёмкость с дезраствором для дезинфекции перча-ток.
Этапы |
Обоснование |
Подготовка к процедуре: |
|
1. Объяснить пациенту цель исследо-вания, методику сбора анализа: — за 3 дня до исследования необходимо отказаться от пищевых продуктов и лекарственных препара-тов, содержащих железо: мясо, рыба, все виды зелёных овощей; препараты висмута, железа; а также воздержаться от чистки зубов при кровоточивости десен; — кал должен быть без примеси мочи и воды, собран желательно утром (в период менструального цикла жен-щине необходимо закрыть вход во влагалище ватно-марлевым тампоном (Tampex)). |
Этот анализ позволяет получить ин-формацию о наличии крови в кале, ко-торую невозможно обнаружить при макроскопическом исследовании (диагностика кровотечений в ЖКТ). |
Выполнение процедуры: |
|
2. Вымыть и осушить руки, надеть перчатки. |
Соблюдение правил инфекционной безопасности. |
3. Используя шпатель собрать 5-10 г кала из разных, наиболее тёмных мест в подготовленную ёмкость, плотно закрыть крышкой.
|
Обеспечение достоверности исследо-вания. |
Окончание процедуры: |
|
4. Использованный шпатель подвер-гнуть дезинфекции. |
Согласно приказам МЗ СССР и РФ, регламентирующим работу ЛПУ по санитарно-противоэпидемическому режиму. |
5. Прикрепить направление, где должны быть указаны: -цель исследования -Ф.И.О. пациента -отделение -№ палаты -дата и подпись м/с, проводившей забор анализа. |
Обеспечение преемственности в работе. |
6. Снять перчатки и погрузить в дезраствор на время дезинфекционной выдержки. |
Соблюдение правил инфекционной безопасности. |
7. Вымыть и осушить руки. |
Соблюдение правил личной гигиены. |
8. Доставить в твёрдом контейнере в клиническую лабораторию. |
Не позднее чем через 1 час с момента сбора. |
СБОР КАЛА НА БАКТЕРИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ.
Цель: определение микрофлоры и возбудителей кишечной инфекции.
Оснащение: стерильная пробирка с проволочной петлёй и консервантом, перчатки, маска, направление на исследование, ёмкость с дезраствором для дезинфекции перчаток.
Этапы |
Обоснование |
Подготовка к процедуре: |
|
1. Информировать пациента о назна-ченном ему исследовании. |
Соблюдение прав пациента на инфор-мацию, осознанного участия в процес-се. |
2. Медсестре вымыть руки с мылом, надеть маску, перчатки. |
Соблюдение правил инфекционной безопасности. |
3. Написать фамилию пациента на про-бирке и оформить направление. Проверить соответствие паспортных данных на пробирке и направлении. Поместить пробирку в штатив. |
Идентификация паспортных данных. |
Выполнение процедуры: |
|
4.Предложить пациенту лечь на левый бок, колени слегка привести к животу. |
Необходимое условие для введения петли |
5. Осторожно извлечь петлю из про-бирки, не касаясь её наружного края. |
Соблюдение стерильности. |
6. Левой рукой развести ягодицы па-циента (или попросить пациента при-поднять своей рукой правую ягодицу), осторожно ввести петлю в анальное отверстие, продвигая её в прямую кишку вначале по направлению к пуп-ку (1-2 см), затем параллельно позво-ночнику на 4-5 см. |
Анатомо-физиологические особеннос-ти строения ампулы прямой кишки. |
7. Взять мазок легким вращательным движением со стенки прямой кишки, затем осторожно извлечь петлю. |
Обеспечение качества забора иссле-дуемого материала. |
8. Поместить петлю в пробирку, не касаясь краёв и наружной поверхности пробирки. Петля должна быть пол-ностью опущена в консервант. |
Обеспечение достоверности исследования. |
Окончание процедуры: |
|
9. Проверить соответствие паспортных данных пациента в направлении. В направлении должно быть указано: -№ пробирки; - цель исследования; - Ф.И.О. пациента; - отделение, № палаты (или адрес па-циента); - дата, время взятия материала, под-пись м/с; - направление поместить в целлофа-новый пакет. |
Необходимое условие проведения процедуры. |
10. Поместить направление и пробир-ку (вертикально) в штативе в контей-нер для транспортировки в лаборато-рию. |
Во избежание опрокидывания. |
11. Обработать кушетку в соответст-вии с приказом МЗ РФ. |
Соблюдение инфекционной безопас-ности пациента и персонала |
12. Снять перчатки, погрузить в дез-раствор. |
В соответствии приказа МЗ РФ, |
13. Вымыть и осушить руки |
Соблюдение правил личной гигиены. |
14. Доставить материал в бактериоло-гическую лабораторию не позже чем через 1часа. |
Обеспечение достоверности исследо-вания. |
Сбор кала на дисбактериоз
Цель: определение наличия нормальной микрофлоры кишечника
Оснащение: стерильная ёмкость (посуду готовит баклаборатория), направле-ние на исследование; деревянный шпатель для сбора кала (однократного применения); перчатки; ёмкость с дезраствором для дезинфекции перча-ток.
Этапы |
Обоснование |
Подготовка к процедуре: |
|
1. Объяснить пациенту цель исследо-вания, методику сбора анализа: — кал должен быть без примеси мочи и воды, собран желательно утром. Примечание: сбор кала до лечения антибиотиками и биопрепаратами |
Анализ собирается без предваритель-ной подготовки пациента |
Выполнение процедуры: |
|
2. Вымыть и осушить руки, надеть маску, перчатки. |
Соблюдение правил инфекционной безопас--ности. |
3. Используя шпатель собрать 1-2 г ка-ла в подготовленную ёмкость, плотно закрыть крышкой. |
Следить, чтобы стерильная ёмкость для анализа как можно меньше вре-мени сообщалась с окружающей сре-дой |
Окончание процедуры: |
|
4. Использованный шпатель подвер-гнуть дезинфекции. |
Согласно приказам МЗ СССР и РФ, регламентирующим работу ЛПУ по санитарно-противоэпидемическому режиму. |
5. Прикрепить направление, где должны быть указаны: -цель исследования -Ф.И.О. пациента -отделение; -№ палаты -дата и подпись м/с, проводившей забор анализа. |
Обеспечение преемственности в работе. |
6. Снять перчатки и погрузить в дез-раствор на время дезинфекционной выдержки. |
Соблюдение правил инфекционной безопасности. |
7. Вымыть и осушить руки. |
Соблюдение правил личной гигиены. |
8. Доставить в твёрдом контейнере в бактериологическую лабораторию. |
Доставить материал в лабораторию в тёплом виде! |
Раздел № 4 Особенности проведения лабораторных методов исследования у детей
Биохимические показатели крови и мочи у детей зависят от методики проведения исследования в различных лабораториях и могут существенно отличаться.
Основные биохимические показатели крови у детей
Азот остаточный:
3-14 лет 19,0- 29,0 ммоль/л
АЛТ до 40 ед/л
АСТ до 30 ед /л
Белок общий 62-82 г/л
Белковые фракции:
Альбумины 37-52 г/л
Глобулины λ1 - 1,0-4,0 г/л
λ2 - 5,0-10,0 г/л
β - 6,9-12,0 г/л
γ - 6,0-16 г/л
Билирубин:
общий(1мес-14 лет) 11,2 мкмоль/л
связанный 2,57 мкмоль/л
свободный 8,55 мкмоль/л
Глюкоза
Новорожденные 1,9-4,7 ммоль/л
1 мес. и старше 3,33-5,55 ммоль/л
Железо
Новорожденные 5,0-19,3 мкмоль/л
1 год 6,3-14,9 мкмоль/л
14 лет 9,3-33,6 мкмоль/л
Железосвязывающая способность
сыворотки
Новорожденные 17,9-62,6 мкмоль/л
1 год 53,7-71,6 мкмоль/л
14 лет 53,7-62,6 мкмоль/л
Калий
0-1мес 3,4-6,2 ммоль/л
2 мес-6 лет 3,4-5,76 ммоль/л
7-14 лет 3,4-5,12 ммоль/л
Кальций общий
Новорожденные 2,25-2,45 ммоль/л
14 лет 2,5-2,87 ммоль/л
Натрий
Новорожденные 135-155 ммоль/л
1 год 133-142 ммоль/л
14 лет 137-147 ммоль/л
Фосфор
Новорожденные 1,13-2,78 ммоль/л
14 лет 1,4-2,15 ммоль/л
Хлор 96-107 ммоль/л
РН крови 7,35-7,45
Креатинин 0,035-0,11 ммоль/л
Мочевая кислота 0,17-0,41 ммоль/л
Мочевина 2,1-7 ммоль/л
Холестерин
Новорожденные 1,3-3,1 ммоль/л
7-12 лет 3,1-6,5 ммоль/л
Основные биохимические показатели мочи у детей
Азот общий
Новорожденные 30 ммоль/сут
1 год 200 ммоль/сут
14 лет 700 ммоль/сут
Амилаза (диастаза) 16-64 ЕД
Глюкоза до 15 мг
Креатинин
Новорожденные 0,08 ммоль/сут
1 год 0,7 ммоль/сут
14 лет 6,0 ммоль/сут
Мочевая кислота
Новорожденные 0,2 ммоль/сут
1 год 1,2 ммоль/сут
14 лет 3,5 ммоль/сут
Мочевина
1 год 80 ммоль/сут
14 лет 300 ммоль/сут
Удельный вес мочи у детей в зависимости от возраста
Новорожденные 1018-1020
6-10 месяцев 1003-1005
2-5 лет 1009-1016
Старше 5 лет 1011-1025
Особенности сбора мочи на общий анализ у детей раннего возраста
У девочек раннего возраста моча собирается при помощи подкладного резинового круга. Для этого на постель положить клеёнку, слегка надуть резиновый круг и обернуть его пеленками. Поставить на клеёнку тарелку или чистый сухой лоток и положить на неё обёрнутый пеленками резиновый круг (края пелёнок не должны попадать в тарелку). Девочку подмыть, просушить промежность полотенцем и уложить на резиновый круг, под спину и голову подложить небольшую подушку.
Для ускорения процесса мочеиспускания можно открыть кран с водой или попоить ребёнка. После мочеиспускания девочку снять с круга, осушить половые органы, а мочу перелить аккуратно из тарелки в чистую сухую баночку. Материал доставляют в клиническую лабораторию.
У мальчиков моча собирается в пробирку, прикреплённую при помощи лейкопластыря к паховой области. При этом ноги закрываются пелёнкой для профилактики травматизации.
Методика сбора мочи по Амбурже
Утром ребёнка необходимо подмыть. В 6-00 ребёнок мочится в унитаз, а затем его просят не мочиться в течение трёх часов. В 9-00 всю мочу собирают в чистую сухую посуду. Отправляют в клиническую лабораторию и определяют количество эритроцитов и лейкоцитов.
Методика сбора мочи по Каковскому - Аддису
Мочу собирают за 10 часов. Для этого ребёнка просят помочиться в
22-00 и после этого не мочиться. Если ребенок не выдерживает 10 часов, то всю выделенную мочу собирают в одну сухую чистую емкость. Утром в 8-00 собирают остатки мочи.
Мочу тщательно перемешивают и отливают в сухую чистую емкость 0,2 л. и отправляют в клиническую лабораторию для определения эритроцитов, лейкоцитов и цилиндров.
Методика сбора мочи по Рейзельману
Это разновидность сбора мочи по Зимницкому. Используется у детей раннего возраста, когда ребёнок плохо контролирует мочеиспускание. Моча собирается в течение суток. Ребёнок мочится тогда, когда он захочет, каждая порция собирается в отдельную чистую, сухую ёмкость.
Отправляется в клиническую лабораторию, где определяют дневной, ночной, суточный диурез, удельный вес каждой порции. По этому анализу судят о функциональном состоянии почек.
Сбор кала на яйца гельминтов
Используется в детской практике для диагностики гельминтозов. Ребёнок высаживается на горшок для акта дефекации, чистым шпателем берут материал из трёх разных мест (не менее 5 грамм) и помещают в чистую сухую баночку. Отправляют в клиническую лабораторию для исследования.
Сбор кала на дисбактериоз
Используется в детской практике для исследования микрофлоры кишечника. Ребёнок высаживается на горшок, который должен быть предварительно вымыт с мылом, ополоснут кипятком и высушен. После акта дефекации стерильным инструментом взять кал из разных мест и поместить в стерильную, сухую емкость.
Нельзя брать материал на исследование в тех местах, где есть кровь. Материал отправляют в бактериологическую лабораторию в течение 2-х часов, сопроводив направлением.
Нормальная микрофлора кишечника ребёнка
Облигатная флора
Кишечная палочка
(с типичными свойствами) 105 - 109
Бифидобактерии 108 – 1011
Лактобактерии 106 – 1010
Бактероиды 109 – 1011
Стрептококки 103 – 105
Факультативная флора
Из общего количества
кишечной палочки:
- лактозонегативная не более 10%
- гемолитическая не более 2%
Протей не более 103
Клебсиелла не более 103
Прочие УПЭ не более 103
Стафилококк не более 103
Синегнойная палочка не более 103
Дрожжеподобные грибы не более 103
Плесневые грибы не должно быть
Патогенные энтеробактерии не должно быть
Клостридии не более 105
Нормативные показатели крови у детей по возрастам
Показатели |
1 день |
7 дней |
14 дней |
1 мес |
2 мес |
3 мес |
6 мес |
9 мес |
1-2 года |
2-6 лет |
6-12 лет |
Старше 12 лет |
Гемоглобин, г/л |
220-230 |
165-200 |
160-180 |
130-165 |
110-140 |
110-135 |
115-130 |
110-121 |
110-120 |
110-130 |
120-140 |
120-155 |
Эритроциты, 1012 /л |
5,7 |
5,1 |
5,0 |
4,7 |
4,4 |
4,2 |
4,6 |
4,6 |
4,7 |
4,7 |
4,8 |
4,8-5,2 |
Гематокрит |
56-58 |
53-56 |
50-53 |
42-46 |
39-42 |
36-39 |
34-36 |
34-39 |
34-35 |
35-36 |
36-38 |
36-38 |
Ретикулоциты, % |
20-30 |
5-10 |
4-10 |
5-10 |
4-13 |
4-12 |
3-10 |
4-12 |
3-11 |
3-10 |
3-10 |
3-10 |
Тромбоциты, 10 9/л |
200-430 |
210-440 |
200-400 |
210-360 |
200-400 |
180-400 |
180-400 |
180-400 |
180-400 |
180-400 |
180-400 |
180-400 |
Лейкоциты, 109 /л |
10-22 |
8-15 |
7-15 |
7-13 |
7-11,5 |
7-11 |
6-11 |
5-12 |
4-12 |
4-10 |
4-8 |
4-8 |
Палочкоядерные, % |
17-25 |
3-10 |
2,5-10 |
2,5-4 |
3,5-4,5 |
3,5-4,5 |
3,5-4 |
3,5-4 |
3,5-4 |
3,5-5 |
2,5-5 |
2,5-5 |
Сегментоядерные, % |
34-45 |
14-29,5 |
18-25 |
15-22 |
21,5-23,5 |
21,5-23,5 |
15-23,5 |
22-25 |
25-45 |
40-50 |
35-45 |
30-40 |
Лимфоциты, % |
15-25 |
35-49 |
40-60 |
45-70 |
50-60 |
50-60 |
50-55 |
45-60 |
45-55 |
36-50 |
35-45 |
30-45 |
Моноциты, % |
4-9 |
5-15 |
5-14 |
4-12 |
4-11 |
4-10 |
4-10 |
4-10 |
4-10 |
5-9 |
4-8 |
3-8 |
Эозинофилы, % |
1-5 |
1-5 |
2-6 |
2-6 |
1-5 |
1-5 |
1-5 |
1-5 |
1-5 |
1-6 |
1-5 |
1-5 |
Базофилы, % |
0-1 |
0-1 |
0-1 |
0-1 |
0-1 |
0-1 |
0-1 |
0-1 |
0-1 |
0-1 |
0-1 |
0-1 |
СОЭ, мм/час |
1-2 |
1-4 |
2-6 |
3-7 |
4-8 |
4-10 |
4-10 |
4-10 |
4-10 |
2-11 |
2-11 |
12-15 |
Приложения
Приложение № 1
УПРАВЛЕНИЕ ЗДРАВООХРАНЕНИЯ
АДМИНИСТРАЦИИ ГОРОДА ЧЕЛЯБИНСКА
ПРИКАЗ
« 27 » января 2006 г. № 12
«Об организации лабораторного обследования
на ВИЧ-инфекцию населения г.Челябинска»
На основании приказа Министерства здравоохранения Челябинской области от 17.01.06 г. № 1 «Об организации лабораторного обследования на ВИЧ-инфекцию населения Челябинской области в рамках реализации Национального проекта в сфере здравоохранения», в целях упорядочения организации скринингового исследования ВИЧ-инфекции методом иммуно-ферментного анализа в г.Челябинске
ПРИКАЗЫВАЮ:
1. Утвердить:
1) список скрининговых лабораторий г. Челябинска, осуществляющих диагностику ВИЧ-инфекции и прикрепленных к ним лечебно-профилактических учреждений (приложение 1);
порядок проведения лабораторного обследования на выявление заражения ВИЧ-инфекцией (приложение 2).
2. Главным врачам лечебно-профилактических учреждений города:
1) принять меры к полному и своевременному обследованию контингентов на ВИЧ-инфекцию в соответствии с Федеральным Законом от 30 марта 1995 года № 38 «О предупреждении распространения в Российской Федерации заболевания, вызываемого вирусом иммунодефицита человека (ВИЧ)» и приказом Министерства здравоохранения Российской Федерации от 30.10.95 г. № 295;
2) при проведении скринингового исследования на ВИЧ-инфекцию использовать коды контингентов, обследуемых на наличие антител к ВИЧ-инфекции, утвержденные приложением № 1 приказа Министерства здравоохранения Челябинской области от I2.01.2006 г. (приложение);
3) при взятии проб крови для исследования на ВИЧ-инфекцию использовать вакуум-системы разового пользования;
обеспечить бланками индивидуальных направлений по форме согласно приложению 3,4 к настоящему приказу;
назначить ответственных за организацию отбора контингента, подлежащего обследованию на ВИЧ-инфекцию, обеспечение установленного порядка забора крови, оформлением документации и транспортировки сыворотки крови. Список ответственных представить в соответствующие скрининговые лаборатории с указанием должности и телефона.
Главному врачу МУЗ «Диагностический центр инфекционных заболеваний» Кузьменко Г.И. и главному врачу ГКБ № 6 Шестопалову С.С. обеспечить получение санитарно-эпидемиологического заключения и лицензии Территориального Управления Федеральной службы Роспотребнадзора по Челябинской области на осуществление деятельности, связанной с использованием возбудителей инфекционных заболеваний Ш – IV групп патогенности.
Главному врачу МУЗ «Диагностический центр инфекционных заболеваний» Кузьменко Г.И. организовать своевременную доставку ИФА-положительных образцов крови на верификацию в референс-лабораторию ГКБ №6.
Контроль за исполнением настоящего приказа возложить на заместителя начальника управления здравоохранения Голошевскую А.И.
Заместитель Главы города,
начальник Управления здравоохранения В.Р.Тесленко
Порядок
проведения лабораторного исследования на выявление заражения вирусом
иммунодефицита человека
Лабораторное исследование на выявление заражения ВИЧ проводится в 2 последовательных этапа: скрининговое (отборочное) и верификационное (подтверждающее) исследование.
Скрининговое исследование - лабораторное тестирование сывороток крови методом иммуно-ферментного анализа с целью выявления серопозитивных сывороток.
Верификационное исследование - подтверждение специфичности положительного результата, полученного при скрининге.
Скрининг проводится в лабораториях диагностики ВИЧ-инфекции в соответствии с утвержденным списком скрининговых лабораторий и прикрепленных к ним ЛПУ.
Материалом для скрининга является сыворотка крови человека.
Способ получения материала для скрининга:
Взятие крови для исследования на ВИЧ производится в процедурном кабинете из локтевой вены (у новорожденного - из пуповины).
Существует 2 способа взятия венозной крови: шприцем и вакуумными системами.
1.Использование шприца. В большинстве случаев использование шприца с иглой следует избегать из-за недостаточной безопасности для медицинского персонала и невозможности исключения гемолиза крови при переносе ее под давлением в пробирку.
2.Использование вакуум-содержащих систем. Для взятия проб крови наиболее предпочтительно использовать вакуум-содержащие системы. Этот способ имеет ряд преимуществ, основным из которых является взятие крови непосредственно в закрытую пробирку, предотвращающую любой контакт с кровью пациента.
Количество взятой крови не менее 7 мл. Пробирка предварительно маркируется (фамилия, инициалы).
Заполняется индивидуальное направление по прилагаемой форме.
В лаборатории (специальном пункте) после образования фибринового сгустка последний отделяется от стенок пробирки стеклянной палочкой, строго индивидуальной для каждой пробы, затем пробирка центрифугируется при 1,5 тыс.об./мин. 5 минут, и сыворотка отделяется осторожно пипеткой с разовым наконечником в сухой чистый флакон. Флакон предварительно маркируется: обязательно указывается фамилия и порядковый номер. Количество сыворотки должно быть не менее 2,5 мл. Флакон с сывороткой закрывается резиновой пробкой. Не использовать лейкопластырь!
В лаборатории (пункте) оформляется списочное направление по форме 264/у. Зачеркивать, вносить в направления изменения, поправки категорически запрещается!
Предназначенная для исследования сыворотка может храниться до отправки в скрининговую лабораторию в холодильнике медицинского учреждения при температуре не выше +4С не более 48 часов!
Доставка образцов сывороток осуществляется в емкостях (контейнеры, биксы и пр.) с закрывающимися крышками из материалов, который не портится при дезинфекции. Направления помещают в полиэтиленовые пакеты и доставляют в лабораторию вместе с образцами сывороток.
Скрининговая лаборатория в обмен выдает чистые флаконы. Заключения помещаются в полиэтиленовые флаконы. Штативы, контейнеры, биксы возвращаются только после предварительной дезинфекции.
В скрининговой лаборатории исследуется сыворотка:
-не содержащая примеси эритроцитов, бактериальных проростов, хилеза, гемолиза
-соответствующая качеству и количеству доставленного материала
-с правильно оформленной сопровождающей документацией.
При наличии любого из указанных признаков сыворотка уничтожается и назначается повторный забор крови, о чем делается запись в регистрационном журнале лаборатории данного медицинского учреждения.
Скрининговая лаборатория имеет право не проводить исследование в случае несоответствия качества и количества доставленного материала указанным выше требованиям, при несоблюдении правил доставки сыворотки, неправильном оформлении сопроводительной документации. В этом случае делается запись в лабораторном журнале дефектуры и составляется «Акт дефектуры» за подписью врача лаборанта, который отправляется руководителю медицинского учреждения, направившего материал для исследования.
При получении отрицательного результата ИФА сыворотка считается отрицательной. Ответ проставляется в направлениях и выдается медицинскому учреждению не позднее, чем через сутки после выполнения анализа.
Сыворотку обследуемых, заказанную на повторное исследование, оформляют на отдельном направлении с пометкой «повторно».
Результаты исследований выдаются только сотрудникам ЛПУ и не сообщаются по телефону.
Дубликаты результатов исследований выдаются в исключительных случаях по предварительной договоренности.
При получении положительного результата анализ проводится еще 2 раза с той же сывороткой, желательно в тест-системе другого типа. При получении 2-х отрицательных результатов сыворотка считается отрицательной.
При поучении еще хотя бы одного положительного результата сыворотка направляется на верификацию в референс-лабораторию ГКБ №6 г. Челябинска и сопровождается двумя экземплярами направлений по форме 264/у.
Название ЛПУ_______________________________________________________
В лабораторию диагностики СПИДа
Направление
Отделение__________________________________________________________
ФИО (полностью)____________________________________________________
Адрес______________________________________________________________
Год рождения________________________Код_____________________________
Дианоз_____________________________________________________________
Дата взятия крови_________________Подпись ____________________________
Заключение Дата_________________________________врач__________________________
Название ЛПУ_______________________________________________________
Направление
на исследование образцов крови на СПИД в лабораторию ИФА
№ п/п |
Регистр № |
Фамилия, имя, отчество полностью |
пол |
Год рождения |
Домашний адрес |
Код контингента |
Дата забора крови |
Результат исследования |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Дата______________________Подпись______________________________
ПРИМЕЧАНИЕ: регистрационный № заполняется в лаборатории
Коды контингентов, обследуемых на наличие антител к ВИЧ - инфекции
100 |
Граждане Российской Федерации |
119 |
Обследование в плановом порядке, в том числе: |
108 |
Доноры (крови, биологических жидкостей, органов и тканей). |
115 |
Медперсонал, работающий с больными СПИД или инфицированным материалом, медработники, при выполнении ими служебных обязанностей |
126 |
Обследованные добровольно, из них: |
102 |
Наркоманы (в/венное введение наркотиков) |
103 |
Гомо и бисексуалисты |
104 |
Больные ЗППП |
112 |
Лица, находящиеся в местах лишения свободы (из группы риска) |
113 |
Обследованные по клиническим показаниям |
109 |
Беременные |
118 |
Прочие (указать контингент) |
120 |
Обследованные при эпидемиологическом расследовании, из них: |
121 |
Гетеросексуальные партнеры инфицированных ВИЧ |
122 |
Гомосексуальные партнеры инфицированных ВИЧ |
123 |
Партнеры по в/в введению наркотиков |
124 |
Дети, родившиеся от ВИЧ-инфицированных матерей |
125 |
Матери детей, инфицированных ВИЧ |
127 |
В том числе, обследованные анонимно |
200 |
Иностранные граждане |
Приложение № 2
Алгоритм подготовки к исследованию мочи
Вид исследования |
Цель |
Действия медсестры. |
Посуда |
Кол-во (в мл) |
Лаборатория |
Общий анализ мочи. |
Определение функционального состояния мочевыделительной системы.
|
|
Сухая чистая стеклянная посуда 250 мл с крышкой.
|
50-150 |
Клиническая. |
Анализ мочи по Нечипоренко. |
Количественное определение содержания форменных элементов в моче (лейкоцитов, эритроцитов), цилиндров. |
|
Сухая чистая стеклянная посуда 100 мл. с крышкой. |
10-15 |
Клиническая. |
Анализ мочи на сахар из суточного количества. |
Подтверждение диагноза сахарного диабета |
|
Чистая сухая градуированная 3-х литровая банка с этикет-кой, сухая чис-тая стеклянная посуда 200 мл. с крышкой |
50 из суточного кол-ва мочи |
Биохимическая |
Анализ мочи для бактериологи-ческого исследования. |
Определение характера и интенсивности бактериурии, определение степени микробной обсемененности почек |
|
Стерильная посуда с крыш-кой.
|
Не менее 10 |
Бактериологи-ческая |
Анализ мочи по Зимницкому. |
Определение выделительной и концентрационной способности почек |
Внимательно читайте этикетки! Если мочи в течение 3 часов не окажется, флакон оставите пустым. Если флакона не хватит, возьмите еще один флакон и укажите на нем номер той же порции. Флаконы будут находиться в санитарной комнате".
|
8 чистых стеклянных сухих флаконов, емкостью 250 мл, снабженных этикетками. Обязательно указывается номер порции и время сбора мочи: №1.6.00-9.00 №2. 9.00-12.00 №3. 12.00-15.00 №4. 15.00-18.00 №5. 18.00-21.00 №6. 21.00-24.00 №7. 24.00-3.00 №8. 3.00-6.00 |
Вся выделенная моча за сутки |
Клиническая. |
Анализ мочи на амилазу. |
Определение функционального состояния поджелудочной железы. |
|
Сухая чистая стеклянная посуда 100 мл с крышкой.
|
10 мл |
биохимическая |
Приложение № 3
Алгоритм подготовки к исследованию мокроты
Вид исследования |
Цель |
Действия медсестры. |
Посуда |
Кол-во (в мл) |
Лаборатория |
Общий клинический анализ мокроты. |
Диагностика заболеваний органов дыхания. |
ПРИМЕЧАНИЕ. Если у пациента имеется кровоточивость десен, зубы чистить не следует. Тщательно прополоскать рот раствором фурацилина, содой, чистой водой. Хранить банку с мокротой допускается в специальном холодильнике не более 2-х часов.
|
Стерильная ёмкость с крышкой или чашка Петри. |
3-5 мл. |
Клиническая |
Анализ мокроты на бактериоло-гическое исследование и чувствитель-ность к антибиотикам. |
Диагностика заболеваний органов дыхания. |
ПРИМЕЧАНИЕ. Стерильность посуды сохраняется в течение 3-х суток. Антибактериальные препараты должны быть отменены за 2 суток до сбора материала. Мокроту до исследования в лаборатории можно сохранить на средней полке дверцы специального холодильника не более 2-х часов.
|
Стерильная посуда (банка) с крышкой или чашка Петри.
|
5 мл. |
Бактериологическая |
Анализ мокроты на микобактерии туберкулёза. |
Диагностика туберкулёза. |
ПРИМЕЧАНИЕ. Если пациент выделяет мокроту в малом количестве, ее накапливают в течение 1-3-х суток, сохраняя на средней полке двери холодильника.
Если врач назначает посев мокроты на БК (бациллы Коха) следует собрать мокроту в стерильную посуду и доставить в баклабораторию.
|
Стерильная посуда с крышкой или чашка Петри |
15-20 мл. |
Клиническая
Бактериологическая |
Анализ мокроты на атипичные клетки. |
Диагностика опухолей органов дыхания. |
ПРИМЕЧАНИЕ. В лабораторию мокрота доставляется сразу же, свежевы-деленной, так как атипичные (опухолевые) клетки быстро разрушаются.
|
Стерильная посуда с крышкой или чашка Петри. |
3-5 мл |
Цитологическая |
Приложение № 4
Алгоритм подготовки к исследованию кала
Вид исследования |
Цель |
Действия медсестры. |
Посуда |
Кол-во (в мл) |
Лаборатория |
Копрологичес-кое исследование. |
Определение переваривающей способности различных отделов пищеварительного тракта. |
ПРИМЕЧАНИЕ. Без специального назначения врача пациент придерживается своей обычной диеты, но запрещаются все продуктовые передачи.
|
Чистый сухой стеклянный флакон из-под пенициллина с пробкой и полоской лейкопластыря (для закрепления пробки флакона). Деревянная лучинка с заостренным концом или шпатель. |
5-10 гр.
|
Клиническая
|
Кал на яйца гельминтов и простейшие |
Подтверждение глистной инвазии, выявление вегетативных форм простейших |
ПРИМЕЧАНИЕ. Исследование повторяют не менее 3-х раз.
|
____»____ |
5-10г |
Клиническая
|
Кал на скрытую кровь. |
Выявление скрытого кровотечения из органов желудочно-кишечного тракта.
|
ПРИМЕЧАНИЕ. В период менструации закрыть влагалище салфеткой (тампоном). |
____»____ |
5-10 г |
Клиническая
|
Кал для бактериологического исследования.
|
Анализ кишечной микрофлоры, выявле-ние больных или бактерио-носителей дизентерией, сальмо-неллезом, брюшным тифом.
|
ПРИМЕЧАНИЕ. В амбулаторных условиях кал на бак. исследование берут непосредственно из прямой кишки с помощью стерильной петли. (см.. алгоритм) Кал следует брать до начала антибактериальной терапии или через 8-10 часов после ее отмены.
|
Стерильная пробирка с проволочной петлёй/ тампоном, содержащая консервант.
|
|
Бактериологическая. |
Постановка пробы по Зимницкому
Цель
1) С диагностической целью, для уточнения диагноза
2) Определяется функциональная способность почек выделять и концентрировать мочу

Выписать направление
Подготовить посуду
для сбора мочи
Подготовка больного
Действие мед.
сестры
Больной
В клиническую
лабораторию Ф.И.О. больного, анализ №,
порция, время, дата, отделение
8 баночек с указанием
временем сбора мочи
Обычный водный и
пищевой режим согласно диете. Объяснить
больному важность этой процедуры.
Дневной диурез
Ночной диурез
(будить)
Ход проведенной
работы
6ч.
6
– 9ч.
9-12ч.
15-18ч.
12-15ч.
24-3ч.
18-21ч.
21-24ч.
3-6ч.
Собрать всю мочу
VIII
VII
VI
V
II
III
IV
Мочиться в унитаз



I порция



Хранить мочу в
темном прохладном месте
У больного полиурия
Какая-либо порция
мочи больше посуды
Оставшуюся выливают
в чистую посуду
Пишут этикетку –
дополнительно к порции №
Олигурия
Если в
некоторых промежутках времени нет мочи
– пустую посуду так же отправить в
лабораторию (нет мочи)
Памятка
по подготовке и сбору мочи на анализ по методу Нечипоренко
амбулаторного пациента
Утром тщательно подмойтесь кипячёной водой и соберите немного мочи (10-15 мл.) из "средней порции" в сухую стеклянную баночку.
Для того чтобы собрать мочу из "средней порции" необходимо:
начать мочеиспускание в унитаз;
задержать мочеиспускание;
выделить мочу в баночку;
задержать мочеиспускание, отставить баночку;
завершить мочеиспускание в унитаз.
Вымойте руки.
Закройте баночку крышкой.
Доставьте анализ мочи в клиническую лабораторию поликлиники №2 в течении 1 часа с момента сбора мочи (лаборатория работает с 8.00-9.00).
Направление не приклеивайте к баночке; поместите в полиэтиленовый пакет и оставьте вместе с баночкой с мочой в лаборатории.
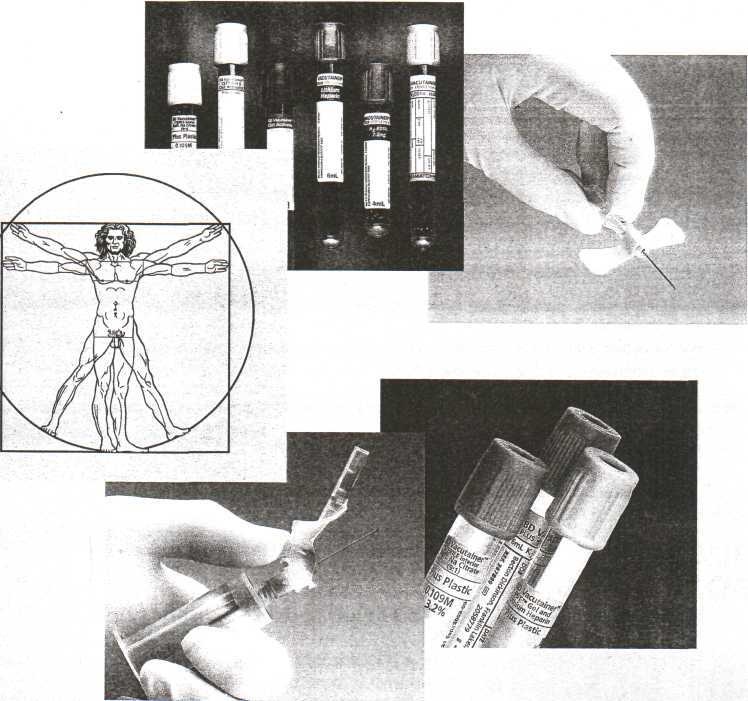
![]()
Системы забора венозной крови BD Vacutainer®
Современные технологии на службе здоровья человека
Система BD Vacutainer
®

Одноразовый держатель
Стерильная пробирка для крови
BD Vacutainer® с дозированным объемом
вакуума и реактивами-наполнителями
Закрытая вакуумная система BD Vacutainer® обеспечивает
Безопасность медицинского персонала на преаналитическом этапе за счет исключения контакта с кровью пациента;
Быстроту и удобство отбора проб за счет простоты конструкции системы и точной дозировки вакуума в пробирке;
Возможность забора крови в несколько пробирок с помощью одной венепункции;
Снижение болевых ощущений у пациентов за счет особого дизайна сверхострых игл;
Высокое качество образцов и снижение ошибок на преаналитическом этапе за счет специально разработанной конструкции пробирок и точного соотношения забираемой крови и реагентов;
Совместимость с широким спектром современных аналитических приборов.
Пробирки для забора крови BD Vacutainer®
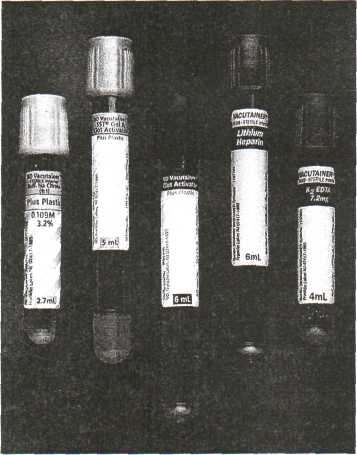
С обычной пробкой
16x100 мм (>8 мл) 10,25x64 мм (1,8-3 мл) 16x75 мм (4-8 мл)
С крышкой BD Hemogard™
13x75 мм (1,8-5мл) 13x100 мм (4,2-7 мл) 16x100 мм (>8 мл)
Пробирки BD Vacutainer® производятся из стекла, a BD Vacutainer® Plus из прозрачного безлатексного поли-этилентерефталата (ПЭТ), который легче и практически не бьется, в отличие от стекла.
Пробирки BD Vacutainer® защищены безлатексными крышками BD Hemogard™, имеющими цветовые коды в соответствии с типом содержащихся в них химических реагентов. Коды отвечают международным стандартам NCCLS и ISO 6710.
Пробирки BD Vacutainer® снабжены этикетками, содержащими информацию о реактиве, объеме отбираемой пробы, номере партии и т. д. Этикетки также отвечают международным стандартам NCCLS и ISO 6710.
Иглы BD Vacutainer
®
Безопасная игла BD Vacutainer® Eclipse™ обладает дополнительным защитным колпачком, что значительно снижает риск случайной травмы от укола иглы и передачи инфекции. Колпачок приводится в действие одной рукой и не требует переучивания персонала. Эти иглы выпускаются калибром 21 и 22 G.
Комплекты BD Vacutainer Safety-Lok™ специально разработаны для забора крови из труднодоступных вен. Комплекты включают иглы калибром 21, 23 и 25 G, а также безлатексные катетеры разной длины. Иглы снабжены встроенным защитным колпачком и имеют большие «крылышки» для удобства фиксации при введении в вену.
Компания BD также производит одноразовые педиатрические иглы BD Vacutainer® Neosyte™ с выступами в виде крылышек. Кроме того, в ассортименте имеются различные адаптеры для отбора проб крови из внутривенных катетеров в пробирки BD Vacutainer® у одного пациента.
Держатели BD Vacutainer
®
Компания BD призводит адаптер для отбора нескольких проб крови из артерий, а также устройство для бесконтактного и безыгольного переноса крови из шприца в вакуумную пробирку или бутылку для гемокультур. Оба приспособления представляют собой люэровский адаптер с присоединеным к нему держателем BD Vacutainer®.
Аксессуары BD Vacutainer®

Одноразовые безлатексные жгуты BD Vacutainer" Stretch™ и многоразовые жгуты BD Vacutainer® Pronto™;
Контейнеры для утилизации использованных игл на 0,7 л, 1 л, 3 л и 13 л;
Насадки для приготовления мазков крови из закрытой пробирки.
Процедура взятия крови с помощью вакуумной системы BD Vacutainer®
Фиксируя
держатель левой рукой, вставить пробирку
BD
Vacutainer®
в
держатель и движением правой руки,
напоминающим проталкивание поршня
в шприце, ввести пробирку в держатель
до прокалывания пробки. Если пункция
вены была проведена правильно, кровь
начнет поступать
в пробирку сразу же после ее установки
в держатель до полного заполнения
дозированного объема вакуума. Если
был наложен жгут, его необходимо
снять сразу же после начала поступления
крови в пробирку.
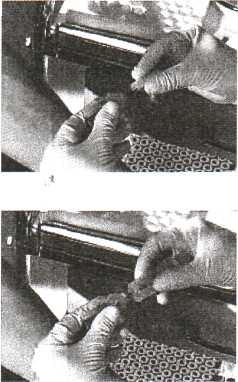
Держа иглу рукой за цветную часть, снять белый защитный колпачок, закрывающий второй конец иглы в резиновом клапане.
Провести пункцию
вены из руки, опущенной вниз, как это
обычно делается с помощью шприца.
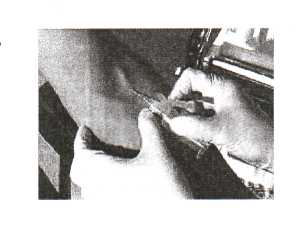
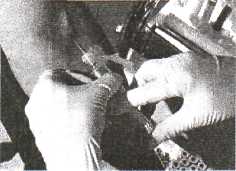

После прекращения тока крови в пробирку ее необходимо извлечь из держателя. Пробирку легче извлекать, если большой палец правой руки упирается в выступ держателя, как это показано на рисунке.
Если нужно набрать несколько пробирок для разных анализов, пробирку BD Vacutainer® можно легко заменить на следующую. Резиновый клапан на игле препятствует вытеканию крови. Сразу после взятия крови в пробирку BD Vacutainer® с добавками ее следует несколько раз перевернуть, не встряхивая, для лучшего перемешивания крови с реактивом.
После взятия проб иглу, не вынимая ее из держателя, следует сбросить в контейнер для использованных острых предметов.
Часто задаваемые вопросы

Ознакомиться с системой можно за очень короткое время. Компания BD готова предоставить для этого все необходимые тренинговые материалы и обеспечить консультации специалистов. Использование системы нужно начинать с «хороших» вен, и уже после взятия нескольких проб вы сможете оценить преимущества работы с ней.
Причиной возникновения гемолиза в пробирке может стать слишком долгое сдавливание вены жгутом. Его необходимо снять сразу же после начала поступления крови в пробирку, и не позднее, чем через 1 минуту после наложения. Пробирку следует вынимать из держателя только после прекращения тока крови, при этом она должны заполняться на ±10% от указанного на этикетке объема наполнения. Пробу в пробирке следует перемешивать, не встряхивая.
3. Применима ли система забора крови BD Vacutainer® для труднодоступных вен?
Для трудных случаев забора крови компания BD разработала специальные комплекты BD Vacutainer"1 Safety-
Lok™ с тонкими иглами и катетерами разной длины. Эти комплекты могут применяться, например, на тыльной стороне руки, и особенно удобны в работе с пожилыми людьми, новорожденными и маленькими детьми.
Выньте пробирку из держателя, оставив иглу в вене. Когда вена вновь наполнится, снова вставьте ту же пробирку в держатель и продолжите процедуру взятия крови.
5. Как определить, что игла находится в вене?
Если игла находится в вене, кровь начинает поступать в пробирку, как только вы вставляете ее в держатель и насаживаете на иглу. Если тока крови нет, действуйте так же, как если бы вы работали со шприцем. Пока конец иглы находится под кожей, вакуум в пробирке сохранится. При правильном попадании иглы в вену кровь сразу же начнет поступать в пробирку.
Описание пробирок BD Vacutainer
Цветовой код |
Химические наполнители |
Область применения |
Число перемешиваний |
красный |
Пластмассовые пробирки покрыты изнутри слоем кремнезема для ускорения свертывания крови. Стеклянные пробирки выпускаются без наполнителя |
Исследования сыворотки в клинической химии, серологии, иммунологии |
Пластмассовые пробирки: 5-6 раз |
оранжевый |
Пластмассовые пробирки со слоем кремнезема и добавкой тромбина 1,4 NIH для ускорения свертывания крови |
Экспресс-диагностика сыворотки в клинической химии, серологии, иммунологии |
8 раз |
желтый |
Активатор свертывания (кремнезем) и разделительный гель, образующий барьер между сывороткой и свернувшейся кровью после центрифугирования |
Исследования сыворотки в клинической химии, серологии, иммунологии |
5-6 раз |
зеленый |
Литий гепарин Натрий гепарин |
Исследования плазмы в клинической химии, иммунологии |
8-10 раз |
светло-зеленый |
Активатор свертывания и разделительный гель |
Клиническая химия, иммунология |
5-6 раз |
голубой |
0,105-0,109 М цитрат натрия (3,2%) 0,129 М цитрат натрия (3,8%) |
Исследования коагуляции: протромбин, тромбопластин, фибриноген, факторы светрывания |
3-4 раза |
CTAD (тринатрий цитрат, теофиллин, аденозин, дипиридамол) |
Контроль гепарина, Факторы тромбоцитов: PF4, B-TG |
|
|
сиреневый |
КгЭДТА(1,8мг/мл) К3ЭДТА(1,8мг/мл) |
Гематологические исследования цельной крови |
8-10 раз |
черный |
0,105 М цитрат натрия 0.129М цитрат натрия |
Измерение скорости оседания эритроцитов |
8-10 раз |
серый |
Фторид натрия/ Оксалат калия Литий-йодоацетат/ литий-гепарин |
Исследования глюкозы |
8-10 раз |
синий |
Без наполнителя Натрий-гепарин К.ЭДТА |
Исследование следовых элементов, токсических веществ |
8-10 раз |
обычная пробка розовый |
КзЭДТА и апротинин |
Исследование нестабильных гормонов, таких как остеокальцин, кальцитонин, АКТГ |
8-10 раз |
пестрый сине-черный и пестрый красно-зеленый |
Натрий-гепарин, разделительный гель и раствор фикола для создания градиента плотности 0,1М цитрата натрия, разделительный гель и раствор фикола |
Выделение и исследование одноядерных клеток в иммунологии и молекулярной диагностике |
8-10 раз |
белый |
КДЦТА и разделительный гель |
Молекулярно-биологические исследования плазмы: ПЦР, вирусная нагрузка |
8-10 раз |
розовый |
Пластмассовые пробирки с К2ЭДТА Пластмассовые пробирки с активатором свертывания крови (кремнезем). Стеклянные пробирки без наполнителей |
Пробирки для переврестной пробы используются для пациентов, нуждающихся в переливании крови |
Пластмассовые пробирки с КгЭДТА -8-10 раз Пластмассовые пробирки с кремнеземом - 5-6 раз |
светло-желтый |
Кислый цитрат декстрозы (ACD) |
Исследования морфологии клеток крови, цитохимические тесты, HLA-типирование, ДНК-анализ |
8-10 раз |
Инструкции по центрифугированию |
Дополнительные рекомендации |
Объем стеклянных пробирок, мл |
Объем пластиковых пробирок, мл |
Цветовой код |
1300д в течение 10 минут при Г воздуха 25' С |
Рекомендуемое минимальное время свертывания 60 минут |
2 7 3 10 5 |
2 6 4 10 |
красный |
1300д в течение 10 минут при t° воздуха 25' С |
Рекомендуемое минимальное время свертывания 5 минут |
3 7 |
4,8 6 |
оранжевый |
Стеклянные пробирки BD J.ST™: 1000-1300д в течение 10 минут при f воздуха 25° С. Пластмассовые пробирки BD SST™ II Advance. 1300-2000g в течение 10 минут при t воздуха 25° С |
Рекомендуемое минимальное время свертывания 30 минут |
2,5 6 4 10 5 |
3,5 5 8,5 |
желтый |
Немедленное центрифугирование при 1300д в течение 10 минут при Г воздуха 25° С |
|
2 7 5 10 |
2 4 6 |
зеленый |
Стеклянные пробирки BD PST™: 1000-1300g в течение 10 минут при Г воздуха 25' С Пластмассовые пробирки BD PST™ II Advance: 1300-2000g в течение 10 минут при t воздуха 25° С |
|
4 6 |
3 4,5 8 |
светло-зеленый |
Стеклянные пробирки: 1500д в течение 15 минут при Г воздуха 25°С. Пластмассовые пробирки: 2000-2500д в течение 10-15 минут при Г воздуха 25°С |
Пробирки должны заполняться полностью,чтобы выполнялось соотношение реагент/кровь, равное 1:9 |
1,8 2,7 4,5 |
1,8 2,7 |
голубой |
2,7 4,5 3,2 |
|
|||
|
Пробирки следует заполнять полностью для предотвращения сморщивания эритроцитов, и, следовательно, занижения среднего размера клеток и гематокрита |
2 7 3 10 4,5 |
2 6 3 10 4 |
сиреневый |
|
Нет необходимости открывания пробирки для отбора крови пипеткой или ее переноса |
1,6 2,4 1,8 5,2 |
|
черный |
13ООд в течение 10 минут при t воздуха 25' С |
Выдерживание пробы в пробирке с фторидом натрия/ оксалатом калия гарантирует стабильный уровень глюкозы до 24 часов при комнатной t° |
2 3 5 |
2 4 |
серый |
1300д в течение 10 минут при t воздуха 25° С |
|
7 |
6 |
синий |
|
|
5 10 |
|
обычная пробка розовый |
1500-1800д в течение 15-20 минут при Г воздуха 25° С |
Пробирки СРТ™ позволяют стандартизировать весь процесс: взятие крови, отделение, транспортировку и хранение периферийных моноядерных кровяных клеток |
4 8 |
|
пестрые сине-черный и красно-зеленый |
1100д в течение 10 минут при Г воздуха 25° С |
|
|
3 5 8,5 |
белый |
13ООд в течение 10 минут при Г воздуха 25° С |
Пробирки имеют специальную этикетку для записи большего количества информации |
7 |
4 6 |
розовый |
13ООд в течение 10 минут при f воздуха 25° С |
Пробирки позволяют сохранять анализируемый образец до 7 дней практически без изменений при Г 2-4° С |
6 8,5 |
|
светло- желтый |
Преаналитические параметры
От 46 до 68% всех лабораторных ошибок возникают на преаналитическом этапе, а 12,5% пре-аналитических лабораторных погрешностей могут привести к ошибочному медицинскому заключению2. Чтобы обеспечить максимальную точность результатов и снизить количество повторных проб, важно соблюдать процедуру забора крови и такие преаналитические параметры, как порядок отбора крови в пробирки, время наложения жгута, перемешивание, заполнение пробирок, их хранение и транспортировка, время свертывания, скорость центрифугирования и др.
Порядок забора крови в пробирки BD Vacutainer®
![]()
Сыворотка, Коагул, СОЭ Сыворотка, Сыворотка, Гепарин;
стекл. пластм. гель плазма,
гель
ЭДГА
Перекрест. Фторид, Следовые проба оксалат элементы
Хранение и утилизация систем BD Vacutainer®
Все пробирки следует хранить при температуре 4-25" С, если на этикетке упаковки не указана другая температура. Большие перепады температур могут снизить эффективность пробирок и спровоцировать неверные результаты анализов. Пробирки следует хранить вдали от солнечного света и источников тепла.
Согласно действующим инструкциям, системы забора крови BD Vacutainer9 утилизируются аналогично одноразовым шприцам, а именно:
использованные иглы утилизируются в специальных контейнерах для игл;
держатели автоклавируются при 121' С и давлении 1,2 атм, они также могут утилизироваться в специальных контейнерах для острых предметов либо сжигаться;
герметично закрытые пробирки автоклавируются при 12V С и давлении 1,2 атм либо сжигаются.
Литература
1. Правила забора и доставки биоматериала для лабораторных исследований. Под ред. Е.В. Никушкина, М.И. Крючкова, В.В. Макаровского — М.: МЦ Управления делами Президента РФ, Центр, ЦКБ УД Президента РФ,
1997. С. 47.
2. Кудрявцева Л.В., Конарева Т.Н., Горбатенко Е.В. Правила взятия и доставки биоматериала для лабораторных исследований в НПФ «Литех» (методические рекомендации для врачей-клиницицистов). — М.: НПФ «Литех»,
2001. С. 49.
3. Клиническая лабораторная аналитика. Под редакцией В.В. Меньшикова. — М.: Агат-Мед, 2003. Т. IV. С. 813.
4. Бемусова А.К., Сербина Л.А. Практические навыки и умения медсестры инфекционного профиля. — Ростов-на-Дону: Феникс, 2003. С. 127.
5. Клиническая лабораторная диагностика. Сост. В.Н. Ослопов, А.Р.Садыкова, Р.А. Абдулхаков. 3-е изд. — М.: Медпрессинформ, 2005. С. 64.
В.В. Меньшиков, Т.И. Лукичева, О.Г. Кадашева. Лабораторное обеспечение первичной медицинской помощи. Научно-практический симпозиум «Объем, организация и экономика лабораторного обеспечения медицинской помощи в условиях модернизации здравоохранения». — М., 2006. С. 64.
B.C. Шидловский. Охрана труда в организациях системы здравоохранения РФ (практическое пособие). — М.: ООО Актив-пресс, 2006. С.130—136.
Приказ Управления здравоохранения Администрации города Челябинска "Об организации лабораторного обследования на ВИЧ-инфекцию населения г. Челябинска" от 27 января 2006 года № 12.


 Компонент
Компонент Белки
Белки

 Показатель.
Показатель.
 Эритроциты,
Эритроциты,