
- •1. Реакции катионов первой аналитической группы
- •2. Реакции катионов второй аналитической группы
- •3. Реакции катионов третьей аналитической группы
- •4. Анализ смеси катионов II - III групп
- •4. Реакции катионов четвёртой аналитической группы
- •5. Реакции катионов пятой аналитической группы
- •6. Реакции катионов шестой аналитической группы
5. Реакции катионов пятой аналитической группы
5.1. Д е й с т в и е г р у п п о в о г о р е а г е н т а
Гидроксиды катионов пятой группы не обладают амфотерностью и не образуют растворимых аммиачных комплексов. Они количественно осаждаются избытком гидроксидов КОН или NaOH, которые и являются групповым реагентом. Для проверки действия группового реагента возьмите четыре пробирки и внесите в каждую по 5 капель раствора соответствующей соли катионов Fe2+, Fe3+, Mn2+, Mg2+, добавьте по 5 капель раствора гидроксида калия КОН, перемешайте стеклянной палочкой, отметьте образование и цвет осадков и напишите уравнения химических реакций. Проверьте осадок на растворимость в избытке щёлочи и 25%-ного раствора аммиака.
5.2. Р е а к ц и и к а т и о н а Fe2+
1) Гексацианоферрат(III) калия K3Fe(CN)6 даёт с катионом Fe2+ синий осадок турнбулевой сини:
Fe2+ + Fe(CN)63- Fe3+ +Fe(CN)64-
4Fe3+ +3Fe(CN)64- Fe4Fe(CN)63

Осадок не растворяется в кислотах. Реакцию лучше проводить при рН 3. Другие катионы 5-й группы проведению реакции не мешают.
2) Диметилглиоксим (реактив Чугаева) образует с катионом Fe2+ комплексную соль карминово-красного цвета :
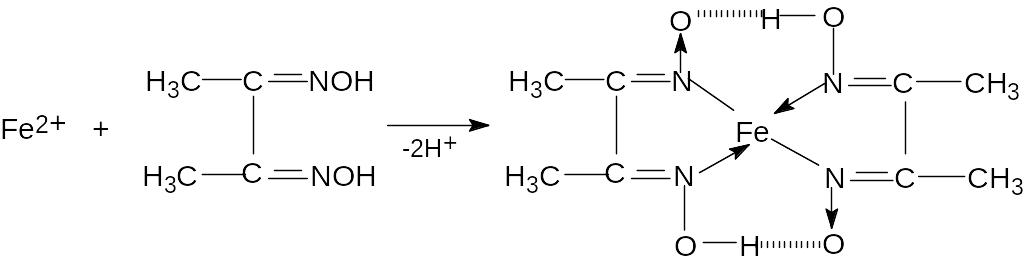

Для проведения эксперимента на предметное стекло поместите каплю анализируемого раствора, добавьте каплю реактива и каплю гидроксида аммония (реакция проводится в аммиачной среде при рН9). В присутствии катиона Fe2+ раствор окрашивается в карминово-красный цвет. Обнаружению иона Fe2+ мешают катионы Mn2+, Ni2+.
5.3. Р е а к ц и и к а т и о н а Fe3+
1) Гексацианоферрат (II) калия K4Fe(CN)6 образует с катионом Fe3+ тёмно-синий осадок берлинской лазури Fe4Fe(CN)63, состав которой по данным рентгено-структурного анализа идентичен турнбулевой сини. Реакцию лучше вести в слабокислых растворах. Для этого возьмите в пробирку 2-3 капли раствора соли железа Fe3+, добавьте 3-4 капли дистиллированной воды, 1-2 капли 2 н раствора соляной кислоты и 2 капли раствора K4Fe(CN)6. Образуется синий осадок или окрашивание. Другие катионы не мешают проведению реакции.

2) Роданид аммония NH4SCN образует с катионом Fe3+ роданид железа кроваво-красного цвета. Состав образующегося комплекса непостоянен и в зависимости от концентрации ионов Fe3+ и SCN- может колебаться от [Fe(SCN)]2+ до [Fe(SCN)6]3-.
Fe3+ + 3SCN- [Fe(SCN)3]

Наличие ионов Fe2+ не мешает проведению реакции. Налейте в пробирку 2-3 капли раствора соли Fe3+, прибавьте 4 капли воды и 2 капли насыщенного раствора роданида аммония или калия. Обратите внимание на окраску раствора.
5.4. Р е а к ц и и к а т и о н а Mg2+
1) Гидрофосфат натрия Na2HPO4 даёт с катионом Mg2+ в присутствии гидроксида и хлорида аммония белый кристаллический осадок фосфата магния-аммония:
Mg2+ + HPO42- + NH4OH MgNH4PO4 + Н2О
Для выполнения реакции возьмите 3-4 капли раствора соли магния и смешайте с 4-6 каплями 2 н раствора соляной кислоты и 3-5 каплями раствора гидрофосфата натрия Na2HPO4. После этого прибавьте к раствору по одной капле 2 н раствора аммиака, перемешивая раствор после каждой капли. Вначале аммиак нейтрализует прибавленную кислоту, причём образуется хлорид аммония NH4Cl, препятствующий образованию гидроксида магния Mg(OH)2. После окончания реакции выпадает характерный белый кристаллический осадок - фосфат магния-аммония MgNH4PO4. Следует иметь в виду, что избыток катионов NH4+ мешает выпадению осадка MgNH4PO4. Катионы всех аналитических групп, кроме первой, могут мешать проведению реакции.
