
Министерство образования и науки Украины
Таврический национальный университет
им. В.И. Вернадского
кафедра экологии и рационального природопользования
![]()
![]()
В.В. Оберемок Методические рекомендации к применению пцр-метода
для студентов 5 курса дневной формы обучения
специальности 8. 070402
«биология»
образовательно-квалификационного уровня «магистр»
профессионального направления подготовки
0704 «Биология»
и
для студентов 3 курса дневной формы обучения
специальности 6.070300
«биохимия»
образовательно-квалификационного уровня «бакалавр»
профессионального направления подготовки
0703 «Химия»
Симферополь 2008
Рекомендовано к печати научно-методическим
советом ТНУ от 02.11.2006
протокол № 2
СОДЕРЖАНИЕ
Теоретическая часть (лекции)
Лекция 1. Смысл полимеразной цепной реакции (ПЦР).......4
Лекция 2. Оборудование для ПЦР-метода..............................7
Лекция 3. Организация ПЦР-лаборатории и
правила поведения в ней….......................................................9
Лекция 4. Типичные ошибки при использовании
ПЦР-метода..............................................................................11
Лекция 5. Применение ПЦР-метода для разных видов
научно-исследовательской работы.........................................12
Лекция 6. Подбор праймеров………………………………..15
Лекция 7. «Золотая середина» концентраций веществ в
ПЦР-смеси…………………………………………...…...…..16
Практическая часть (лабораторные занятия)
Занятие 1. Выделение ДНК ....................................................18
Занятие 2. Амплификация ДНК..............................................21
Занятие 3. Детекция продуктов
амплификации ДНК (электрофорез)......................................24
Задачи и вопросы.....................................................................27
Краткий словарь терминов и
дополнительные сведения.......................................................29
Список рекомендуемой и цитируемой литературы………..34
Список рекомендуемых веб-сайтов…………………….…. 34
Лекция 1. Смысл полимеразной цепной реакции (ПЦР)
ПЦР – полимеразная цепная реакция, в ходе которой амплифицируются определенные участки ДНК. ПЦР была изобретена американским ученым Кэри Мюллисом в 1983 году. Широкие возможности, сравнительная дешевизна и простота ПЦР позволили использовать этот метод генетического анализа в разных областях научных исследований. В основе ПЦР лежит естественный для клеток процесс репликации (рис. 1). Отличие ПЦР от репликации состоит в том, что ПЦР происходит in vitro и воспроизводит репликацию частично.
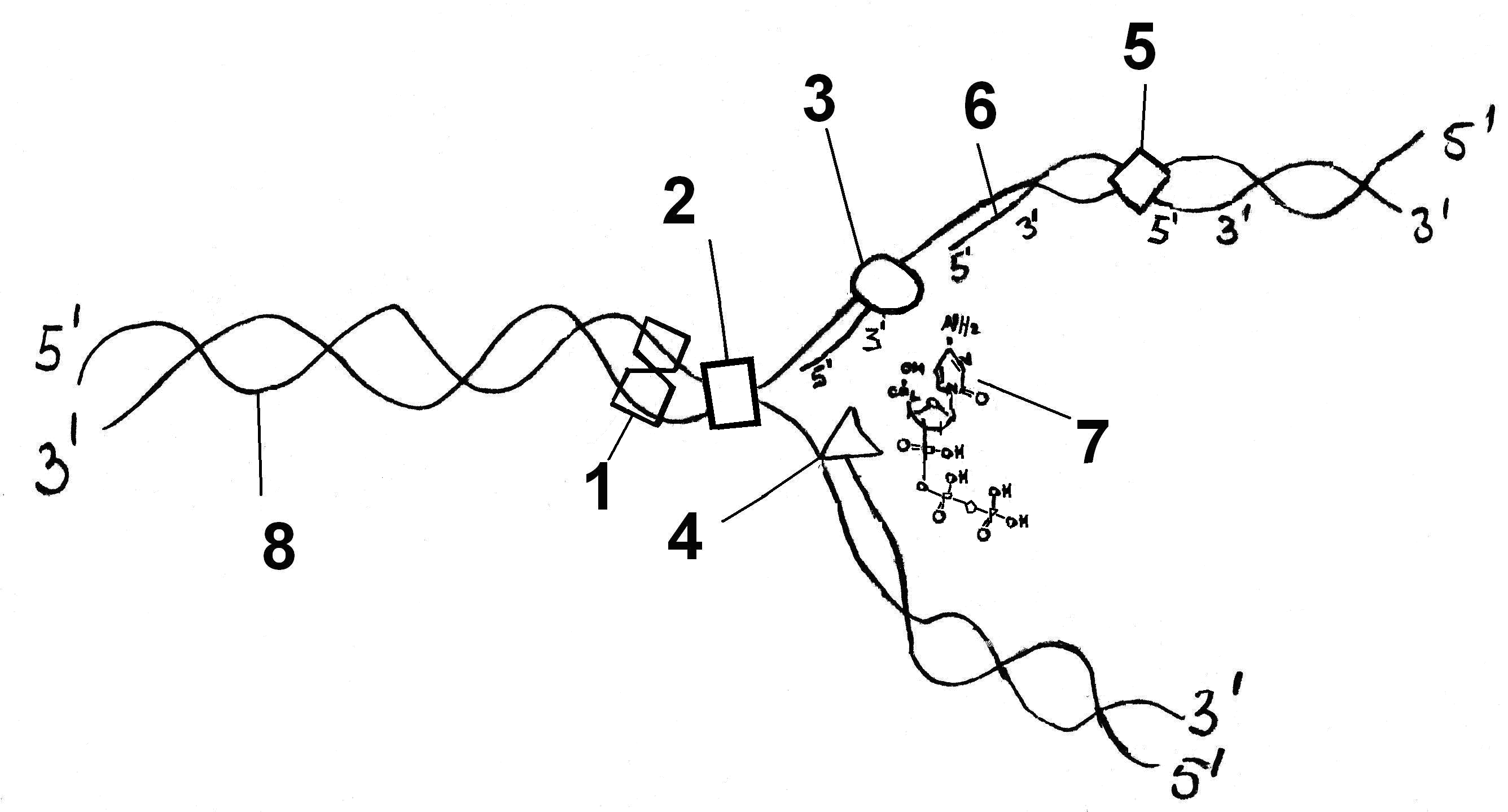
1- геликаза
2- топоизомераза
3- ДНК-полимераза
4- ДНК-полимераза
5- лигаза
6- фрагмент Оказаки (затравка)
7- нуклеотидтрифосфаты
8- ДНК
Рис. 1. Репликация ДНК
Основные компоненты реакции:
dNTP (нуклеотидтрифосфаты), Taq-полимераза, праймеры, Mg2+, ПЦР-буфер, деионизованная вода, исследуемая ДНК. Полимеразная цепная реакция делится на циклы. Каждый цикл состоит из нескольких стадий: денатурация, отжиг праймеров, наращивание (комплементарное достраивание) цепи. Для каждой стадии характерны своя температура и временной интервал. Количество ампликонов разной длины, образующихся в конце ПЦР, теоретически можно рассчитать, если знать места отжига праймеров. Классическим примером является отжиг одного праймера по одному разу на каждой из цепей ДНК. Необходимо, чтобы при этом 3'-концы праймеров были впереди по отношению друг к другу (рис.1). Два двухцепочечных фрагмента (ампликона), которые появляются в конце 3 цикла в этом примере, дадут через n циклов следующее количество копий: F = 2∙2n, где F-количество двухцепочечных фрагментов ДНК, а n - количество циклов.

Рис. 2. Амплификация ДНК (окончание на следующей странице)

P – праймер, ffffffff – наращиваемая цепь
Рис. 2. Амплификация ДНК
Лекция 2. Оборудование для ПЦР-метода
Для проведения ПЦР используется следующее оборудование и химические вещества.
Этап выделения ДНК: ультрацентрифуга, вортекс (центрифуга), термостат, ступка и пестик, дозатор с переменным объемом, наконечники для дозатора, пробирки, набор реактивов для выделения ДНК, исследуемый материал (фото 1).

Фото 1. Оборудование и вещества, используемые
для проведения этапа выделения ДНК
2. Этап амплификации ДНК: программируемый амплификатор, вортекс, дозатор с переменным объемом, наконечники для дозатора, пробирки, набор реактивов для амплификации ДНК, исследуемая ДНК (фото 2).
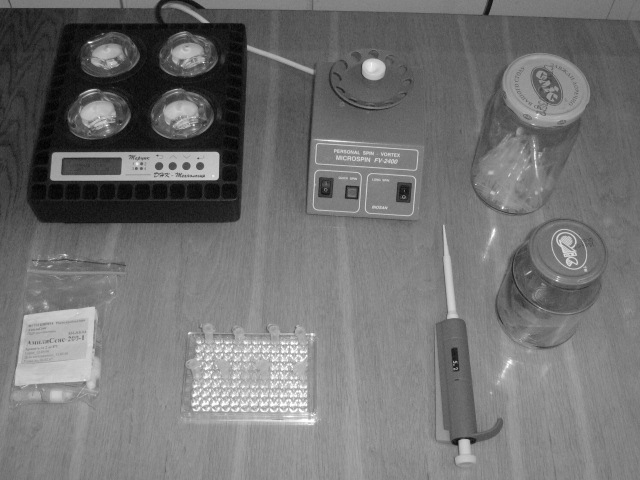
Фото 2. Оборудование и вещества, используемые
для проведения этапа амплификации ДНК
Этап детекции продуктов ПЦР: источник электрического питания, камера для электрофореза, дозатор с переменным объемом, наконечники для дозатора, агароза, трис-боратный буфер, раствор бромистого этидия, маркер молекулярных весов фрагментов ДНК, продукты амплификации ДНК (фото 3).

Фото 3. Оборудование и вещества, используемые
для проведения этапа детекции продуктов амплификации
Лекция 3. Организация ПЦР-лаборатории и правила поведения в ней
Организация ПЦР-лаборатории предусматривает наличие 3-х изолированных друг от друга комнат:
1-ая комната – для выделения ДНК;
2-ая комната – для амплификации ДНК;
3-я комната – для детекции продуктов амплификации ДНК (электрофореза).
При этом рекомендуют комнату для электрофореза удалить как можно дальше от первых двух. Комнаты для выделения и амплификации ДНК должны быть оснащены ПЦР-боксами. Простейший бокс должен обязательно содержать ультрафиолетовую лампу, быть прозрачным и удобным для работы (рис. 3).
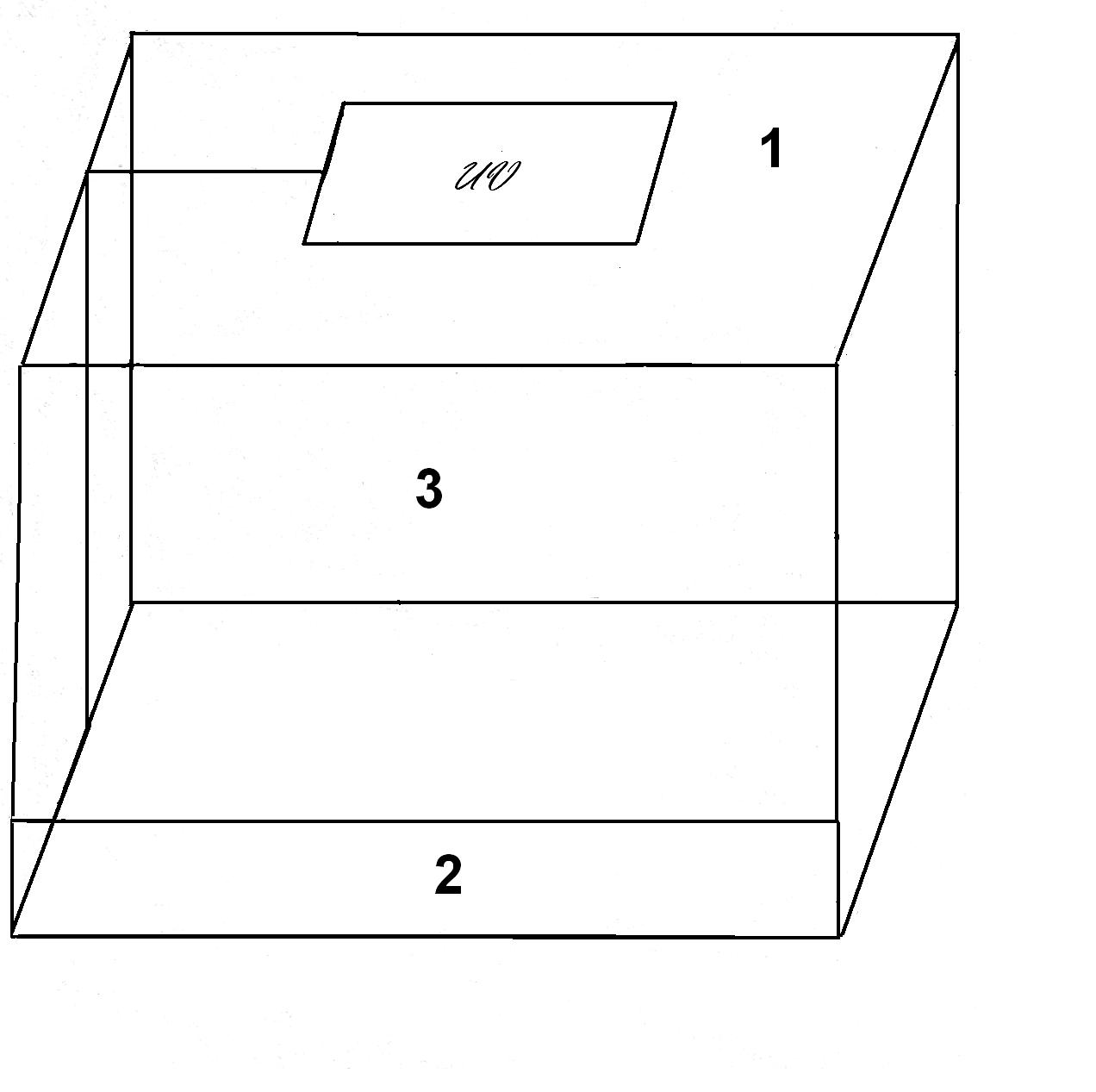
1 – ультрафиолетовая лампа
2 – отверстие для рук
3 – стеклянный (пластиковый) прозрачный корпус
Рис. 3. ПЦР-бокс
Обычно для создания ПЦР-бокса используется прозрачный пластик или стекло. Перед тем, как начать работу, нужно протереть внутреннюю поверхность бокса 70% этиловым спиртом. После этого включить ультрафиолетовую лампу на 30-60 минут. Ультрафиолетовые лучи обладают высокой энергией и опасны для глаз, поэтому необходимо во время стерилизации бокса ультрафиолетом покинуть помещение. Далее вымыть руки с мылом, надеть халат и приступить к работе.
В крайних случаях первую и вторую комнаты совмещают, используя при этом один ПЦР-бокс. Комнаты и оборудование для ПЦР должны содержаться в чистоте.
В ПЦР-методе используется раствор бромистого этидия. Это сильный канцероген, способный проникать через кожу. При работе с бромистым этидием нужно использовать перчатки (лучше всего из нитрильной резины) и как можно меньше прикасаться к нему. В случае попадания бромистого этидия на кожу или в глаза промыть пораженный участок водопроводной водой в течение 15 минут. В случае попадания бромистого этидия внутрь организма немедленно обратиться к доктору. Бромистый этидий используется на стадии детекции продуктов амплификации.
Все меры предосторожности и нормы поведения в лаборатории, описанные выше, направлены на то, чтобы сохранить здоровье исследователя и упредить загрязнение проб различными веществами.
В ПЦР-лаборатории строго запрещается:
