
- •Физическая термодинамика Лекция 10 Физика макросистем
- •Термодинамические состояния и термодинамические процессы
- •Работа, совершаемая макросистемой
- •Первое начало термодинамики
- •Адиабатически изолированная термодинамическая система
- •Лекция 11
- •Уравнение состояния идеального газа
- •Основное уравнение молекулярно-кинетической теории
- •Экспериментальное подтверждение молекулярно-кинетической теории
- •Лекция 12 Теплоёмкость идеального газа
- •Адиабатический процесс
- •Политропический процесс
- •Работа газа при политропических процессах
- •Внутренняя энергия газа Ван-дер-Ваальса
- •Лекция 13 Тепловые и холодильные машины
- •Второе начало термодинамики
- •Термодинамический цикл Карно
- •Неравенство Клаузиуса
- •Термодинамическая энтропия
- •Свойства энтропии
- •Основное уравнение термодинамики
- •Вычисление энтропии
- •4. В изотермическом процессе
- •Термодинамическая диаграмма
- •Лекция 14 Статистическое описание равновесных состояний
- •Барометрическая формула
- •Равновесные флуктуации
- •Статистическое обоснование второго начала термодинамики
- •Энтропия и вероятность
- •Лекция 15 Явления переноса Термодинамические потоки
- •Описание явлений переноса в газах
- •Эффузия в разреженном газе
- •Физический вакуум
- •Броуновское движение
- •Лекция 16 Агрегатные состояния вещества
- •Условия равновесия фаз
- •Явления на границе раздела газа, жидкости и твёрдого тела
- •Диаграммы состояния
Экспериментальное подтверждение молекулярно-кинетической теории
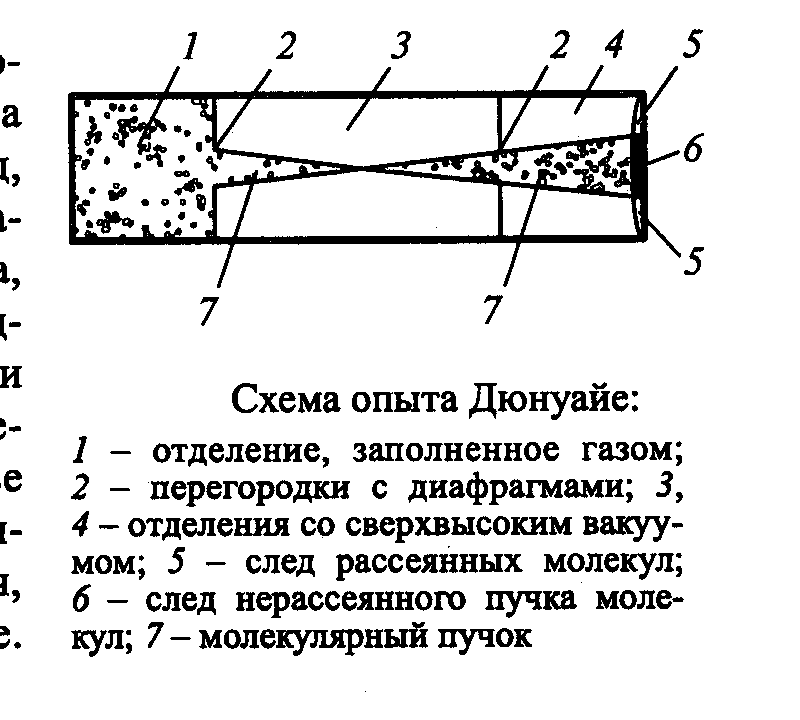
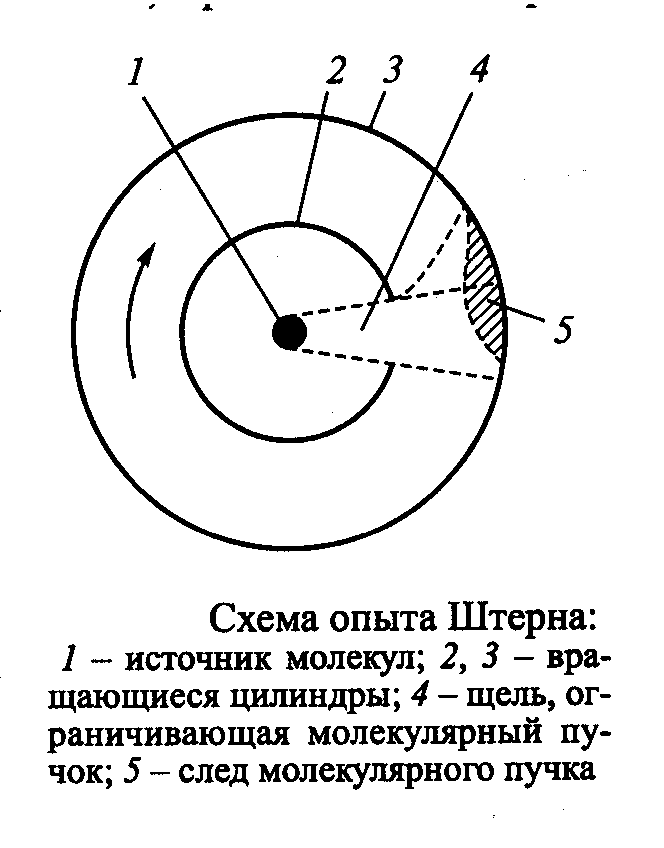
Лекция 12 Теплоёмкость идеального газа
Теплоёмкостью макросистемы (тела или некоторого количества газа) называют количество тепла, которое нужно сообщить макросистеме, чтобы повысить её температуру на один кельвин:
![]() .
.
Молярной теплоёмкостью называют количество тепла, которое необходимо сообщить одному молю вещества, чтобы повысить его температуру на один кельвин:
![]() ,
,
![]() Дж/моль.К.
Дж/моль.К.
В справочных таблицах обычно указывают удельную теплоёмкость с, Дж/кг.К
с = С/М , где
М – молярная масса.
Теплоёмкость также
как и
![]() зависит от процесса и является функцией
процесса.
зависит от процесса и является функцией
процесса.
Для анализа различных процессов в газах удобно пользоваться молярной теплоёмкостью. Особое значение имеют молярные теплоёмкости для двух процессов: при постоянном объёме СV и при постоянном давлении Ср .
При постоянном объёме dV = 0. Следовательно δА = р.dV = 0 и имеем
![]() .
.
Так как теплоёмкость в широком интервале температур практически не меняется, то получаем
![]() .
.
Ранее было показано,
что
![]() ,
поэтому можно считать, что для идеального
газа
,
поэтому можно считать, что для идеального
газа
![]()
Молярная теплоёмкость произвольного процессa
![]() .
.
Если процесс изобарический (p = const), то из уравнения состояния следует, что р(dV/dT) = ν.R , и соответствующая молярная теплоёмкость
![]() (соотношение
Майера).
(соотношение
Майера).
Важной характеристикой
газов является отношение
![]() ,
которое обозначают буквой γ
и называют
постоянной
адиабаты.
,
которое обозначают буквой γ
и называют
постоянной
адиабаты.
![]() .
.
Для изменения
внутренней энергии ν молей идеального
газа получаем:
![]()
![]() .
.
Адиабатический процесс
Адиабатическим называют процесс, который проходит без теплообмена с окружающей средой. Для идеального газа получаем:
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
После интегрирования получаем уравнение адиабаты в переменных р , V или уравнение Пуассона:
![]()
В переменных Т, V для уравнения адиабаты получаем (используя p.V = ν.R.T):
![]() .
.
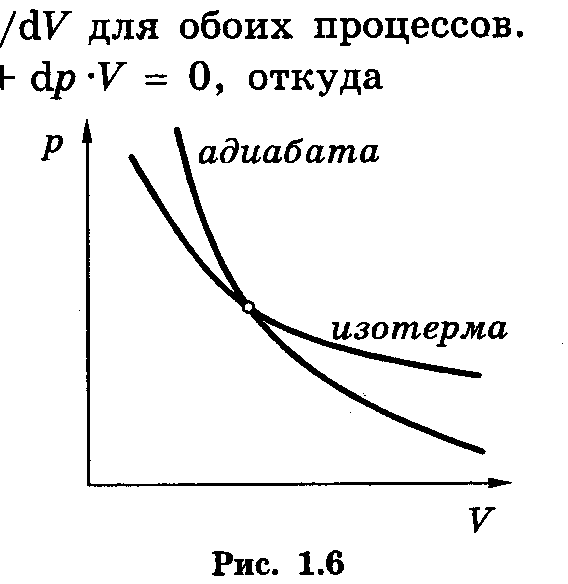
Адиабата в координатах р , V идёт круче изотермы (рV = const)
Политропический процесс
Политропическими называют процессы, уравнение которых в переменных р , V имеет вид
![]() ,
где
,
где
п – произвольное число, как положительное, так и отрицательное, а также равное нулю.
Например,
политропическими являются изохорический
(V
= const,
п![]() ),
изобарический (р
= const,
п
= 0), изотермический (рV
= const,
п
= 1) и адиабатический (п
= γ) процессы.
),
изобарический (р
= const,
п
= 0), изотермический (рV
= const,
п
= 1) и адиабатический (п
= γ) процессы.
Теплоёмкость всех политропических процессов остаётся постоянной:
![]() .
.
Для получения выражения для Сп воспользуемся уравнением политропы в переменных Т, V:
![]() .
.
Продифференцируем это уравнение:
![]() или
или
![]() .
.
Подставляя это
выражение в формулу для теплоёмкости
![]() ,
получаем:
,
получаем:
![]() .
.
.
Используя формулу
![]() ,
получаем ещё одно выражение:
,
получаем ещё одно выражение:
![]() .
.
Видно, что если п = γ, то Сп = 0 как и должно быть из определения адиабатического процесса. При п = 1 получаем Сп , как и должно быть при изотермическом процессе.
