
- •Физическая термодинамика Лекция 10 Физика макросистем
- •Термодинамические состояния и термодинамические процессы
- •Работа, совершаемая макросистемой
- •Первое начало термодинамики
- •Адиабатически изолированная термодинамическая система
- •Лекция 11
- •Уравнение состояния идеального газа
- •Основное уравнение молекулярно-кинетической теории
- •Экспериментальное подтверждение молекулярно-кинетической теории
- •Лекция 12 Теплоёмкость идеального газа
- •Адиабатический процесс
- •Политропический процесс
- •Работа газа при политропических процессах
- •Внутренняя энергия газа Ван-дер-Ваальса
- •Лекция 13 Тепловые и холодильные машины
- •Второе начало термодинамики
- •Термодинамический цикл Карно
- •Неравенство Клаузиуса
- •Термодинамическая энтропия
- •Свойства энтропии
- •Основное уравнение термодинамики
- •Вычисление энтропии
- •4. В изотермическом процессе
- •Термодинамическая диаграмма
- •Лекция 14 Статистическое описание равновесных состояний
- •Барометрическая формула
- •Равновесные флуктуации
- •Статистическое обоснование второго начала термодинамики
- •Энтропия и вероятность
- •Лекция 15 Явления переноса Термодинамические потоки
- •Описание явлений переноса в газах
- •Эффузия в разреженном газе
- •Физический вакуум
- •Броуновское движение
- •Лекция 16 Агрегатные состояния вещества
- •Условия равновесия фаз
- •Явления на границе раздела газа, жидкости и твёрдого тела
- •Диаграммы состояния
Лекция 11
Состояние термодинамического равновесия описывается набором параметров макросистемы, которые однозначно ему соответствуют.
Параметрами состояния макросистемы называют параметры, значения которых не зависят от того, каким образом система пришла в данное состояние. Для газа параметрами состояния являются давление, объём, температура, количество вещества, концентрация и др.
Зависимость между параметрами состояния макросистемы выражается уравнением состояния. Для газа уравнение состояния имеет форму
f (p, V, T, ν) = 0
Уравнение состояния идеального газа
Идеальным называют газ, уравнение состояния которого имеет вид
![]() ,
где
,
где
ν =![]() – количество
вещества,
измеряемое числом молей;
– количество
вещества,
измеряемое числом молей;
Моль – это количество вещества, содержащее число молекул, равное постоянной Авогадро NA = 6,022.1023 моль-1.
М – Молярная масса – масса одного моля, определяемая с помощью периодической системы элементов Менделеева.
R = 8,314 Дж/(моль.К) – универсальная газовая постоянная.
Это уравнение, называемое уравнением Клапейрона, является обобщением многочисленных экспериментальных данных, полученных для разных газов при температурах и давлениях близких к так называемым нормальным условиям (Т ~ 300 К, р ~ 100 кПа).
При нормальных условиях наиболее близкими по своим свойствам к идеальному газу являются водород и гелий.
Уравнение состояния идеального газа можно преобразовать следующим образом:
![]() ,
где
,
где
![]() – концентрация
газа
(полное число молекул в единице объёма);
– концентрация
газа
(полное число молекул в единице объёма);
![]() = 1,38 .
10
–23 Дж/моль
– постоянная
Больцмана
.
= 1,38 .
10
–23 Дж/моль
– постоянная
Больцмана
.
В уравнении состояния идеального газа температуру Т называют абсолютной или термодинамической температурой, измеряемой в кельвинах ( К – одна из основных единиц измерения в СИ, наряду с кг, м, с, моль).
По международному соглашению температурную шкалу строят по одной реперной точке, так называемой тройной точке воды – Ттр = 273,16 К. При таком значении Ттр интервал между точками плавления льда и кипения воды практически равен 100 кельвин.
В технике и быту часто пользуются шкалой Цельсия. Очень удобно, что 1 К = 1оС. Температура t по шкале Цельсия связана с температурой по шкале Кельвина равенством
t = T – 273,15.
Температуру Т = 0 называют абсолютным нулём.
При постоянном объёме V и количестве вещества ν температура Т пропорциональна давлению р идеального газа. Это означает, что если измерение температуры проводить с помощью газового термометра постоянного объёма, рабочим телом в котором является идеальный газ (идеально-газовый термометр), то такой термометр будет иметь линейную шкалу температур.
Г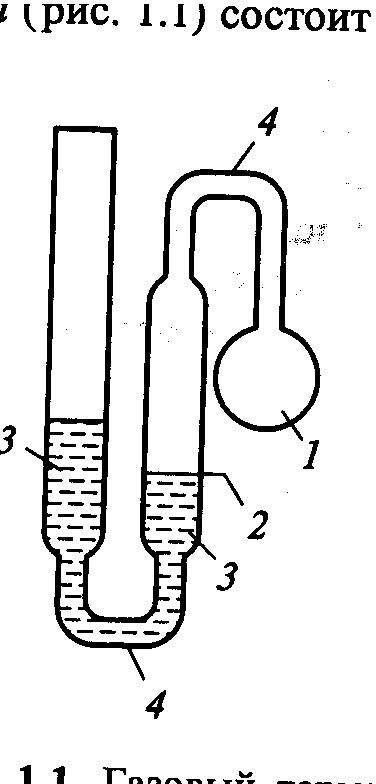 азовый
термометр постоянного объёма
состоит из термометрического тела –
порции газа, заключённой в сосуд (1),
который с помощью трубки (4) соединён с
манометром (3). Измеряемая физическая
величина (термометрический признак),
обеспечивающая определение температуры,
- давление газа при некотором фиксированном
объёме. Постоянство объёма достигается
тем, что вертикальным перемещением
левой трубки манометра уровень в его
правой трубке доводят до опорной метки
(2) и измеряют разность высот уровней
жидкости в манометре. Точность измерения
температуры таким термометром при учёте
различных поправок может достигать
0,001 К.
азовый
термометр постоянного объёма
состоит из термометрического тела –
порции газа, заключённой в сосуд (1),
который с помощью трубки (4) соединён с
манометром (3). Измеряемая физическая
величина (термометрический признак),
обеспечивающая определение температуры,
- давление газа при некотором фиксированном
объёме. Постоянство объёма достигается
тем, что вертикальным перемещением
левой трубки манометра уровень в его
правой трубке доводят до опорной метки
(2) и измеряют разность высот уровней
жидкости в манометре. Точность измерения
температуры таким термометром при учёте
различных поправок может достигать
0,001 К.
Газовые термометры используют для градуировки других видов термометров (жидкостных, металлических, полупроводниковых, пирометрических, термопарных и т.д.).
