
- •Альтернативный путь
- •[Править]Лектиновый (маннозный) путь активации системы комплемента
- •Биологические функции
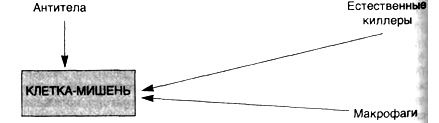
- •Рецепторы естественных киллеров
- •Механизм действия
- •30.Суперантигены
- •31 Антигены организма человека
- •История изучения
- •Строение антител
- •[Править]Классификация по тяжелым цепям
- •[Править]Функции антител
- •История открытия
- •]Классификация
- •Механизм действия
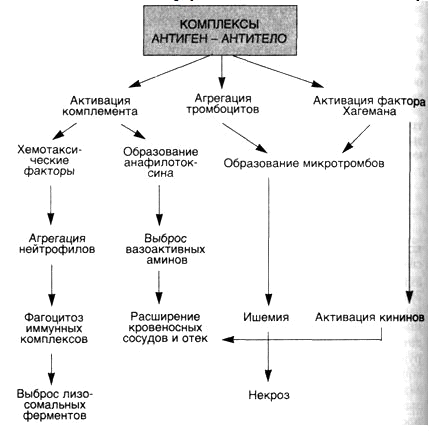
- •Возможные причины
- •[Править]Механизм развития
- •[Править]Эволюция
[Править]Эволюция
Большинство аутоиммунных заболеваний являются хроническими. В их развитии есть периоды обострений и ремиссий. Как правило, хронические аутоиммунные заболевания приводят к серьёзным нарушениям функции внутренних органов и инвалидизации больного. Аутоиммунные реакции, сопровождающие различные заболевания или прием медикаментов, напротив, кратковременны и исчезают вместе с заболеванием, вызывающим их развитие.
Моноциты. Основой всей моноцитарно—фагоцитарной системы (МФС) является популяция иммуно компетентных клеток — моноциты. В периферической крови человека в нормальных условиях содержится обычно 0,2—0,8 • 109этих клеток в 1 л. После недолгого пребывания в крови моноциты мигрируют в ткани, где формируют МФС. Моноциты присутствуют повсюду — в соединительной ткани, вокруг базальных мембран мелких кровеносных сосудов, высокое содержание их обнаруживается в легких (альвеолярные макрофаги) и печени (клетки Купфера). Макрофаги выстилают синусоиды селезенки и медуллярные синусы лимфатических узлов. Моноциты, как правило, мигрируют в ткани диффузно, хаотично. В случае появления клеток, несущих чужеродную информацию, возникает хемотаксический сигнал, направляющий и ускоряющий движение моноцитов из кровотока и окружающих тканей.
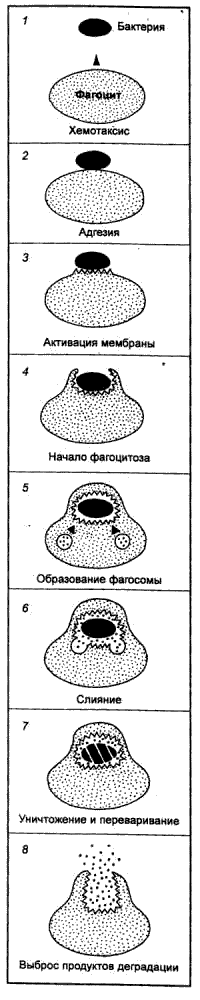
Механизм фагоцитоза однотипен и включает 8 последовательных фаз (рис. 8.6): 1) хемотаксис (направленное движение фагоцита к объекту), 2) адгезия (прикрепление к объекту), 3) активация мембраны (актин—миозиновой системы фагоцита), 4) начало собственно фагоцитоза, связанное с образованием вокруг поглощаемой частицы псевдоподий, 5) образование фагосомы (поглощаемая частица оказывается заключенной в вакуоль благодаря надвиганию на нее плазматической мембраны фагоцита подобно застежке—молнии, 6) слияние фагосомы с лизосомами, 7) уничтожение и переваривание, 8) выброс продуктов деградации из клетки.
Фагоцитозу часто предшествует процесс опсонизации (от греч. opsoniazo — снабжать пищей, питать) объекта (клетки, несущей чужеродную информацию). Инициатором этого процесса является образование на поверхности клетки комплекса антиген—антитело. Опсонизация обеспечивается присутствием небольшого количества в организме молекул антител («нормальные антитела»). Антитела, локализующиеся на поверхности чужеродной клетки, стимулируют активацию и присоединение к ним белков системы комплемента. Образовавшийся комплекс действует как активатор остальных стадий фагоцитоза, стимулирует прямо или через посредство других клеток образование веществ, усиливающих эффект опсонизации чужеродной клетки.
Хемотаксис. Чужеродные клетки (опсонизированные или неопсонизированные) посылают в окружающую среду хемотаксические сигналы, в направлении которых фагоцит начинает двигаться. В качестве хемотаксических факторов рассматривается целый ряд веществ, в том числе продукты метаболизма микроорганизмов. Считается, что на ранних этапах эволюции каждый из этих факторов действовал самостоятельно. У высших организмов, в том числе у человека, все они действуют в комплексе, последовательно включаясь и усиливая друг друга. Пусковым фактором является комплекс антиген—антитело, определяющий высокую специфичность суммарного хемотаксического сигнала. На этот сигнал приходят первые фагоцитирующие элементы, которые, активируя другие иммунокомпетентные клетки, стимулируют их к выработке медиаторов, усиливающих хемотаксис. Далее хемотаксический потенциал усиливается за счет новообразованных антител, усиления образования комплексов антиген—антитело, а также ряда факторов, образующихся при разрушении макрофагами сосудов и тканей в воспалительном очаге. Этот хемотаксический сигнал второго порядка (развитого очага воспаления) обеспечивает поддержание в нем активной работы за счет поступления новых порций иммунокомпетентных клеток. Достигнув очага воспаления, макрофаг останавливается под влиянием фактора торможения миграции лейкоцитов, вырабатываемого Т—лимфоцитами—хелперами. Исчезновение в очаге воспаления чужеродных антигенов, начало процессов регенерации ведет к резкому уменьшению хемотаксического стимула и появлению продуктов, представляющих собой отрицательный хемотаксический сигнал. В результате этого новые фагоциты перестают мигрировать в воспалительный очаг, а оставшиеся жизнеспособные рассеиваются по всей ткани.
Адгезия. Акт адгезии включает две фазы: распознавание чужеродного (специфический процесс) и прикрепление, или собственно адгезию (неспецифический процесс). Адгезия фагоцитирующей клетки к объекту фагоцитоза происходит крайне медленно в том случае, если отсутствует предварительное специфическое распознавание чужеродных клеток. У высших организмов адгезия практически всегда идет с включением специфического компонента. Для активации этого процесса необходимо небольшое количество иммуноглобулинов, которые постоянно присутствуют в организме как нормальные антитела.
Захват (собственно фагоцитоз). Важная роль в осуществлении этого этапа фагоцитоза принадлежит специфическим компонентам иммунной реакции. Известно, что захват неопсонизированных частиц идет медленно, причем часть из них вообще не фагоцитируется. Наиболее сильными опсонинами являются иммуноглобулины. Специфичность в осуществлении фагоцитоза появляется в ходе эволюции как надстройка, физиологически связанная с уже имеющейся иммунной системой. В процессе фагоцитоза плазматическая мембрана макрофага при помощи образованных ею выступающих складок захватывает объект фагоцитоза и обволакивает его. Образующаяся при этом небольшая вакуоль называется фагосомой. В дальнейшем фагосома отрывается от поверхности мембраны и перемещается в цитоплазму.
Киллинг (убийство). В фагосоме захваченная чужеродная клетка гибнет. Для осуществления киллинга макрофаг продуцирует и секретирует в фагосому реакционноспособные производные кислорода.
Переваривание. Последний этап фагоцитоза — переваривание захваченного и убитого материала. Для этого с фагосомой, содержащей объект фагоцитоза, объединяются лизосомы, которые содержат более 25 различных ферментов, в число которых входит большое количество гидролитических энзимов. В фагосоме происходит активация всех этих ферментов, так называемый метаболический взрыв, в результате которого фагоцитированный объект переваривается. Часть молекул антигена при этом разрушается не полностью, их антигенная активность может существенно возрастать. Далее фагосома с остаточным антигеном выбрасывается на поверхность клетки, высвобождая иммуногенный антиген, что имеет важное значение для индукции лимфоцитами специфического иммунного ответа.
Нейтрофилы. Главный барьер против микробных инфекций представляют нейтрофилы — популяция лейкоцитов, иначе называемая микрофагами, или микрофагоцитами. Они имеют много общего с другими форменными элементами крови гемопоэтического стволового предшественника. В крови человека нейтрофилы доминируют среди остальных лейкоцитов. Они представляют собой неделящиеся короткоживущие клетки с сегментированным (более зрелые сегментоядерные нейтрофилы) и несегментированным (менее зрелые палочкоядерные нейтрофилы) ядром и набором гранул, различающихся по морфологии, гистогенезу, биохимическому составу, плотности и скорости функциональной мобилизации. Примерно 70% нейтрофилов не циркулируют в крови, а прикреплены к эндотелию сосудов. Главный резервуар пристеночных нейтрофилов — микрососуды легких: число депонированных здесь клеток в несколько раз превосходит количество циркулирующих нейтрофилов.
Срок пребывания нейтрофилов в кровотоке составляет около 6,5 ч. Далее нейтрофилы, проникая через эндотелий сосудов, попадают в ткани, где и заканчивают свое существование в течение 3—5 сут, осуществляя свои эффекторные функции, очень похожие на те, которые присущи макрофагам. Значительная часть нейтрофилов приходит к эпителию слизистых оболочек и, проникая через него, заканчивает свой жизненный цикл в слизистом надэпителиальном слое (срок жизни таких нейтрофилов исчисляется часами).
У нейтрофилов известны три типа гранул: первичные азурофильные гранулы, содержащие миелопероксидазу, небольшое количество лизоцима и набор катионных белков; вторичные «специфические» гранулы, содержащие лактоферрин, лизоцим и белок, связывающий витамин B12; третичные гранулы (мельчайшие гранулы, или С—частицы), содержащие кислые гидролазы, а также практически всю желатиназную активность нейтрофила. Дегрануляция нейтрофилов может быть истинной, когда гранулы целиком выталкиваются из клетки (экзоцитоз), но чаще из гранул выделяются только растворимые компоненты и имеет место вторичное запустевание гранул (так называемая секреторная дегрануляция). Обширные запасы гликогена, который может быть использован при гликолизе, позволяют нейтрофилам существовать в анаэробных условиях.
Основной функцией нейтрофилов является уничтожение чужеродных клеток или веществ биополимерной природы путем фагоцитоза. Эту функцию нейтрофилы осуществляют только после выхода их из сосудистого пула. Процесс фагоцитоза, осуществляемого нейтрофилами, состоит из тех же самых этапов, которые выше описаны для макрофагов. В отличие от макрофагов, нейтрофилы могут фагоцитировать чужеродную клетку или частицу только один раз, после чего они гибнут.
Хемотаксис нейтрофилов обусловлен в основном продуктами жизнедеятельности бактерий или денатурированными белками разрушенных клеток собственного организма, т. е. в определенной степени эта стадия фагоцитоза является специфичной. Суммарный хемотаксический эффект усиливается многочисленными факторами разнообразной природы, активирующимися в начале разрушения чужеродного. Сам нейтрофил, будучи активированным в начале фагоцитоза, также выделяет ряд хемотаксических факторов. Благодаря каскадному усилению хемотаксического сигнала к месту разрушения объекта фагоцитоза привлекается большое количество нейтрофилов.
Уничтожение чужеродных клеток фагоцитами (макрофагами и нейтрофилами). Антигенная стимуляция резко меняет метаболический профиль фагоцитирующих клеток. К наиболее выраженным сдвигам относится резкое увеличение потребления глюкозы в реакциях гексозомонофосфатного шунта (ГМФШ), генерирующего НАДФ • Н для восстановления молекулярного кислорода на мембранах цитохрома b—245. Если в покоящемся нейтрофиле подобным образом утилизируются лишь 1—2% глюкозы, то стимулированный нейтрофил способен окислить до 30% глюкозы. Одновременно возрастает потребление кислорода и образование оксидантов с мощным энергетическим потенциалом. Этот процесс
называют респираторным взрывом.
В результате респираторного взрыва образуются мощные бактерицидные агенты: супероксидный анион (О2—), перекись водорода H202), синглетный кислород (1O2), гидроксильные радикалы (ОН—). Сочетание перекиси водорода, миелопероксидазы и ионов галогенов создает мощную систему галогенирования, приводящую к появлению крайне агрессивных вторичных метаболитов: гипохлорной кислоты (НОСl), хлорамина, продуктов перекисного окисления липидов (ПОЛ). Ключевым считается супероксидный анион, с которого берет начало каскад активных форм кислорода и сопряженных с ним феноменов. Избыток энергии реализуется путем выделения тепла, повышенной химической активностью (отсюда высокая биопидность), либо эмиссией квантов света (хемилюминесценция).
Кислороднезависимые механизмы. При дисмутации супероксидного аниона потребляются ионы водорода и слегка повышается рН, это создает оптимальные условия для функционирования семейства катионных белков. Эти белки, имеющие высокую изоэлектрическую точку, разрушают бактериальную стенку за счет протеиназного эффекта и за счет непосредственного присоединения к поверхности микроорганизма. Низкие значения рН, устанавливающиеся после слияния фагосомы с лизосомами, лизоцим и лактоферрин представляют собой Кислороднезависимые бактерицидные и бактериостатические факторы, которые могут действовать в анаэробных условиях. Убитые микроорганизмы расщепляются гидролитическими ферментами, и продукты деградации высвобождаются из фагоцитарной клетки.
Разные формы реактивности фагоцитов обеспечиваются и проявляются нередко независимо друг от друга. При хроническом грануломатозе макрофаги и нейтрофилы в связи с дефектом цитохромов b—245 не способны образовывать активные метаболиты кислорода. Это сопровождается тем, что бактерии фагоцитируются, но не уничтожаются в клетках. Кроме того, известно, что многие микроорганизмы содержат в большом количестве каталазу и могут легко инактивировать продуцируемую фагоцитами перекись водорода. Фагоциты, дефектные по глюкозо—6—фосфатдегидрогеназе, не способны продуцировать активные метаболиты кислорода и защищать организм от бактериальных инфекций. При синдроме «ленивых лейкоцитов» нарушена реакция нейтрофилов на хемотаксические сигналы.
Центральные и периферические органы иммунной системы
Центральными органами иммунной системы называют органы, где происходит формирование и созревание иммуноцитов. К ним относят костный мозг, вилочковую железу (тимус) и сумку Фабрициуса. Периферические органы иммунной системы содержат зрелые лимфоциты. Здесь после антигенного воздействия происходит их дальнейшая пролиферация и дифференцировка, продуцируются антитела и эффекторньш лимфоциты. К периферическим органам относятсяселезенка, лимфатические узлы, скопления лимфоидной ткани под слизистыми поверхностями желудочно-кишечного, дыхательного, мочеполового трактов(групповые лимфатические фолликулы, тонзиллы, пейеровы бляшки).
Тимус, или вилочковая железа, - лимфоэпителиальный орган. Он состоит из долек, каждая из которых содержит корковый и мозговой слой. Клетки-предшественники тимоцитов формируются в костном мозге и через кровь попадают в кору тимуса. Основным элементом коры являются фолликулы Кларка, в которых вокруг приводящего кровеносного сосуда концентрируются эпителиальные и дендритные клетки, макрофаги и лимфоциты. Клетки и их гуморальные продукты (цитокины, гормоны) стимулируют деление незрелых лимфоцитов, поступивших в кору. В процессе деления они созревают. На их поверхности появляются новые структуры, а некоторые стадиоспецифические структуры утрачиваются. Структуры, определяющие особенности клеток иммунной системы, обладают антигенными свойствами. Они получили название «Cluster of differentiation» (показатель дифференцировки) и обозначение CD. Лимфоциты, созревающие в тимусе, - Т-лимфоциты обладают характерными для них молекулами CD2, определяющими их адгезивные свойства и молекулами CD3, являюиимися рецепторами для антигенов. В тимусе Т-лимфоциты дифференцируются на две субпопуляции, содержащие антигены CD4 либо CD8. Лимфоциты CD4 обладают свойствами клеток-помощников - млперов (Тх), лимфоциты CD8 - цитотоксическими свойствами, а также супрессорным эффектом, заключающимся в их способности повалять активность других клеток иммунной системы.
За одни сутки в тимусе образуется 300-500 млн. лимфоцитов. При тгом на клетках формируются рецепторы как к чужеродным, так и к собственным антигенам. В ходе созревания Т-лимфоциты проходят позитивную селекцию - отбор клеток, обладающих рецепторами для молекул главного комплекса тканевой совместимости (МНС), обеспечивающих возможность последующих контактов Т-лимфоцитов с клетками, представляющими им чужеродный антиген. В корковом слое тимуса происходит и негативная селекция: клетки с рецепторами для собственных антигенов, вступающие в контакт с ними погибают. В результате в мозговой слой тимуса поступает 3-5% клеток сформировавшихся в корковом слое. Это лимфоциты с рецепторами к чужеродным антигенам способны впоследствии после контакта с соответствующим антигеном реализовать специфическую иммунную реакцию. В мозговом слое дифференцировка лимфоцитов завершается формированием CD4+- и С08+-лимфоцитов. Созревание клеток в тимусе длится 4-6 сут., после чего лимфоциты поступают в кровь, лимфу, ткани, во вторичные органы иммунной системы.
Эпителиальные клетки тимуса образуют пептидные гормоны и гормоноподобные пептиды: тимулин, альфа и бета-тимозин, тимопоетин, способствующие созреванию и дифференцировке Т-лимфоцитов в тимусе и вне него. Выделение этих гормонов и создание их синтетических аналогов производится для создания лекарственных средств, регулирующих иммунологические функции. Тимус начинает функционировать у шестинедельного эмбриона человека, к рождению его масса достигает 10-15 г, к началу полового созревания - 30-40 г. Далее происходит постепенная инволюция тимуса с утратой до 3% активной ткани ежегодно. Инволюция тимуса сопровождается снижением продукции Т-лимфоцитов. Их уровень в организме поддерживается за счет долгоживущих клеток, внетимусного созревания части клеток под действием цитокинов. Предполагают, что последствия инволюции тимуса входят в число причин старческой патологии и определяют продолжительность жизни человека.
Костный мозг, общая масса которого у человека достигает 3 кг, выполняет несколько иммунологических функций. Как уже упоминалось, костный мозг служит местом происхождения всех клеток иммунной системы. Здесь же происходит созревание и дифференцировка В-лимфоцитов. Костный мозг функционирует и как вторичный орган иммунной системы. Макрофаги костного мозга обладают фагоцитарной активностью, а В-лимфоциты дифференцируются в плазматические клетки, которые продуцируют антитела. Направления дифференцировки стволовых клеток костного мозга определяются клетками стромы костного мозга, макрофагальными клетками, лимфоцитами и образуемыми ими цитокинами. Клетки костного мозга продуцируют гормоноподобный пептидный фактор, способствующий активации В-лимфоцитов.
Лимфатические узлы- скопления лимфоидной ткани, расположенные по ходу лимфатических и кровеносных сосудов. У человека имеется 500-1000 лимфатических узлов, а также более мелкие скопления лимфоидной ткани под слизистыми поверхностями и в коже. Лимфатические узлы обеспечивают неспецифическую резистентность организма, выполняя функции барьеров и фильтров, удаляющих из лимфы и крови чужеродные частицы. Вместе с тем лимфатические узлы служат местом формирования антител и клеток, осуществляющих клеточные иммунные реакции.Поверхность лимфатического узла покрыта соединительнотканной капсулой, от которой внутрь узла отходят трабекулы — балки, также образованные соединительной тканью. Они представляют собой опорные структуры. Строма, структурная основа лимфатического узла, образована ретикулярной соединительной тканью, отростчатые клетки которой и, образованные ими ретикулярные волокна, формируют трехмерную сеть. В состав стромы входят также фагоцитирующие клетки — макрофаги, представленные в лимфатических узлах несколькими разновидностями.
На разрезе органа выделяются две основные зоны. Ближе к капсуле — корковое вещество, в котором различают поверхностную часть и зону глубокой коры (паракортикальную зону). Внутренняя часть лимфатического узла получила название мозговое вещество.
Внутреннее пространство органа содержит скопления лимфоидной ткани. В области поверхностной коры, ближе к капсуле располагаются лимфатические узелки (фолликулы). На окрашенных препаратах они имеют более светлую центральную часть — герминативный центр, в котором происходит антигензависимая пролиферация и дифференцировка B-лимфоцитов (бурсазависимая зона). Поверхностная, более тёмная на препаратах часть узелка — лимфоидная корона содержит большое количество мелких, плотно расположенных лимфоцитов.
В зоне глубокой коры (паракортикальной зоне) лимфоциты располагаются плотно, довольно равномерно. В этой области преобладают T-лимфоциты, которые проходят здесь антигензависимую пролиферацию и дифференцировку (тимусзависимая зона).
В мозговом веществе скопления лимфоидной ткани представлены мозговыми тяжами (мякотными шнурами), в которые мигрируют B-лимфоциты из поверхностной коры. B-лимфоциты дифференцируются окончательно в плазматические клетки, продуцирующие иммуноглобулины — антитела.
Лимфа притекает к лимфатическим узлам по приносящим лимфатическим сосудам, подходящим к узлу с выпуклой стороны, и оттекает по выносящему лимфатическому сосуду, отходящему с вогнутой стороны узла в области ворот. Внутри узла лимфа медленно протекает (просачивается) по внутренним пространствам, которые называются лимфатическими синусами. Синусы располагаются между капсулой, трабекулами и скоплениями лимфоидной ткани. Как и сосуды, синусы имеют собственную выстилку, образованную литоральными (береговыми) клетками. Их отростки направлены внутрь синуса, где они контактируют с отростками ретикулярных клеток. Таким образом, в отличие от сосудов синусы не имеют свободной полости, она перегорожена трехмерной сетью, образованной ретикулярными и литоральными клетками, благодаря этому лимфа медленно просачивается по синусам. Это способствует её очищению от инородных частиц благодаря макрофагам, которые располагаются по краю лимфоидных скоплений. Протекая по синусам мозгового вещества лимфа обогащается антителами, которые продуцируются плазматическими клетками мозговых тяжей.
Притекающая лимфа приносит в лимфатический узел чужеродные антигены, что приводит к развитию в лимфатических узлах реакций иммунного ответа. В зависимости от характера антигенов эти реакции развиваются преимущественно в бурса- или тимусзависимых зонах, что приводит к увеличению размеров лимфоидных скоплений этих зон.
Лимфоузел является барьером для распространения как инфекции, так и раковых клеток. В нём образуются лимфоциты — защитные клетки, которые активно участвуют в уничтожении чужеродных веществ и клеток.
Лимфоидная ткань.
Общими для всех этих участков являются расположение лимфоцитов в рыхлой волокнистой соединительной ткани оболочек, покрытых эпителием, образование антител, относящихся к IgA. В образовании IgA участвуют стимулированные антигенами В-лимфоциты и их потомки плазматические клетки. А также эпителиоциты оболочек, вырабатывающие секреторный компонент IgAs. Сборка молекулы иммуноглобулина происходит в слизи на поверхности эпителиоцитов, где они обеспечивают местную антибактериальную и противовирусную защиту. Располагающиеся в узелках Т-лимфоциты осуществляют реакции клеточного иммунитета и регулируют деятельность В-лимфоцитов.
MALT. Ткань представлена либо в виде диффузной инфильтрации, либо в форме узелковых скоплений,лишенных замкнутого соед.ткан футляра. В тонк.кишечнике такие узелки получ название пейеровых бляшек(лимфоцыты В,Т.)50% Вкл-к имеют поверхностный IgA. Остальная часть IgM,G. Продуцирующие антитела плазмоциты и Т кл-ки спос проник в слиз обол-ку кишки. Кроме того в слизистой находятся фагоцитирующие клетки,котор поглощают патогены,на поверхности просвета кишечника.
ассоциированная с кожей лимфоидную ткань. Антигены, попадающие через кожу, презентируются эпидермальными клетками Лангерганса, представляющими собой АПК. Они взаимодействуют с лимфоцитами прямо в коже и/или в дренирующих кожу лимфатических узлах, куда могут мигрировать. Эта часть иммунной системы играет исключительную роль при контактном дерматите, туберкулиноподобных реакциях, многих гранулёматозных поражениях, экземе и атопическом дерматите, буллёзной пузырчатке, псориазе и других иммунопатологических кожных болезнях. В-лимфоциты кожи также способны вырабатывать IgA, который здесь поступает в секрет потовых и сальных желёз.
Кожа, эпителиальные и паренхиматозные органы содержат многочисленные лимфатические капилляры, собирающие тканевую жидкость, именуемую лимфой. Лимфа поступает далее в лимфатические сосуды, по ходу которых последовательно располагается множество лимфатических узлов, строма которых служит фильтром, удаляющим из лимфы практически все чужеродные частицы, в том числе и вирусы, и до 2% растворимых антигенных молекул. В лимфоузлах иммунного организма задерживаются практически все водорастворимые антигены.
Лимфатический узел покрыт соединительнотканной капсулой, от которой внутрь узла отходят трабекулы, разделяющие его на доли, в которых содержится корковое и мозговое вещество, а между ними лежит паракортикальный слой. Основной структурой коркового вещества являются скопления лимфоидных фолликулов, содержащих лимфоциты, преимущественно В-группы, дендритные клетки и макрофаги. Лимфоидные фолликулы могут быть первичными и вторичными. Первичные фолликулы преобладают в покоющемся лимфоузле, содержащиеся в них клетки малоактивны, митозы встречаются редко. В случаях формирования реакции на антиген первичные фолликулы превращаются во вторичные фолликулы, называемые также зародышевыми центрами.
В-лимфоциты, находившиеся в первичном фолликуле, в ответ на поступивший в узел антиген активируются с помощью Т-клеток, начинают быстро делиться и дифференцироваться в антителообразующие клетки - зрелые лимфоциты и плазматические клетки, а также клетки иммунологической памяти, обеспечивающие быстрый ответ на новое поступление антигена. Часть антителообразующих лимфоузлов перемещается в мозговой слой лимфоузла, в другие лимфоузлы, где продолжают продуцировать антитела. Пространство между фолликулами коркового слоя и паракортикальные зоны мозгового слоя алолнены преимущественно Т-лимфоцитами, из которых при иммунной реакции формируются цитотоксические и другие эффекторные лимфоциты, осуществляющие клеточные реакции иммунной защиты. В мозговом слое лимфатического узла содержится большое количество макрофагов, осуществляющих фагоцитоз поступающих в лим-фоузел микроорганизмов и других чужеродных частиц.
Функции периферических органов иммунной системы выполняют также лимфоидные структуры глоточного кольца, кишечника, мочеполовых органов, кожи, бронхов и легких. Структуры, обеспечивающие защиту слизистых, получили название - лимфоидная ткань, ассоциированная со слизистыми - MALT (Mucosa-associated lymphoid tissue). В состав MALT входят GALT, BALT - лимфоидные ткани, «ссоциированные с кишечником, с бронхолегочной системой. К ним примыкают лимфоидные структуры кожи-SALT (Skin associated lymphoid tissue). Клеточные структуры этих лимфоидных образований, а также лимфоциты, находящиеся в тканях, имеют то же происхождение, что и структуры других периферических органов иммунной системы.
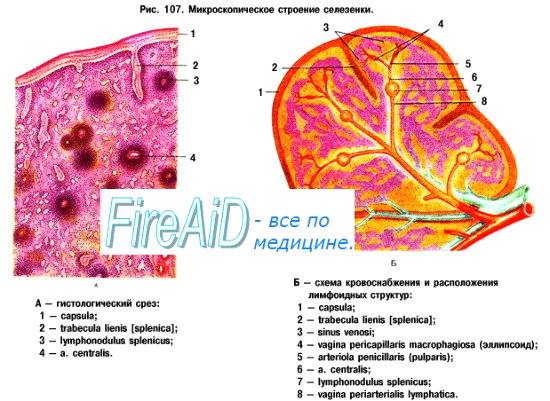
Селезёнка — самый крупный лимфоидный орган, имеющий овальную уплощённую форму, похожий на железу и расположенный в левой верхней части брюшной полости, позади желудка. Она соприкасается с диафрагмой, поджелудочной железой, толстой кишкой и левой почкой.
Наружная поверхность селезёнки покрыта капсулой из плотной соединительной ткани, к наружной поверхности которой прирастает серозная оболочка (брюшина). От капсулы внутрь селезёнки отходят трабекулы (балки), образованные плотной соединительной тканью. В капсуле и трабекулах также присутствуют гладкие мышечные клетки, количество которых увеличено у животных. При сокращении мышечных элементов капсулы и трабекул депонированная в селезёнке кровь выбрасывается в общий кровоток. Трабекулы образуют внутренний каркас органа. В крупных трабекулах проходят артерии и вены. Внутреннее содержимое селезёнки получило название пульпы (мякоти). В пульпе селезёнки различают две основные зоны: красную и белую пульпу.
Белая пульпа(мальпигиевы тельца) представляет собой скопление лимфоцитов вокруг артериального канала. Красная пульпа есть место локализации эритроцитов, макрофагов, мегакариоцитов, гранулоцитов,перемещающихся сюда из белой пульпы лимфоцитов.
Наибольший интерес представляет собой бп и пограничн.обл кп и бп. Здесь локализуются т,в лимф-ты. Т кл-ки распол вокр артериол, образуя периартериальные муфты. В кл-ки вход в состав зародышевых центров, котор распол в пограничной зоне. В кр.п лимф-ты не образуют морфологич оформленных скоплений. Лимф-ми кп явл-ся Ткл-ки, покидающие селезенку через венозные синусы.
На ранних стадиях развития плода селезёнка служит одним из органов кроветворения
К девятому месяцу внутриутробного развития образование как эритроцитов, так и лейкоцитовгранулоцитарного ряда берёт на себя костный мозг, а селезёнка, начиная с этого периода, производит лимфоциты и моноциты.
иммунная система состоит из многих компонентов, но главные среди них - это все же лейкоциты , согласованно действующие в борьбе с бактериями и другими чужеродными агентами. Кроме того, они участвуют в воспалительной HYPERLINK "http://medbiol.ru/medbiol/immunology/imm-gal/000db7aa.htm"реакции при повреждениях тканей . Все эти клетки циркулируют в крови, хотя свои функции они выполняют, в основном, вне сосудов. Индивидуальные лимфоциты представляют собой клетки, специализированные в том смысле, что они способны отвечать лишь на ограниченную группу структурно сходных антигенов . Эта способность, существующая еще до первого контакта иммунной системы с данным антигеном, выражается у лимфоцита в наличии мембранных рецепторов, специфических для детерминант этого антигена .
Нейтрофилы- при окраске по Рамоновскому окрашиваются как кислыми так и основными красителями.Зрелые нейтрофилы имеют сегментированное ядро . В норме явл-ся основным видом лейкоцитов, циркулирующих в крови. способны к активному амёбоидному движению, к экстравазации (эмиграции за пределы кровеносных сосудов), и к хемотаксису (преимущественному движению в направлении мест воспаления или повреждения тканей).
Нейтрофилы способны к фагоцитозу, (являются микрофагами), то есть способны поглощать лишь относительно небольшие чужеродные частицы или клетки. После фагоцитирования чужеродных частиц нейтрофилы обычно погибают, высвобождая большое количество биологически активных веществ, усиливающих воспаление и хемотаксис иммунных клеток в очаг. Нейтрофилы содержат большое количество миелопероксидазы, фермента, который способен окислять сильный антибактериальный агента. Миелопероксидаза как гем-содержащий белок имеет зеленоватый цвет, что определяет зеленоватый оттенок самих нейтрофилов, цвет гноя и некоторых других выделений, богатых нейтрофилами. Погибшие нейтрофилы вместе с клеточным детритом из разрушенных воспалением тканей и гноеродными микроорганизмами, послужившими причиной воспаления, формируют массу, известную как гной.
Нейтрофилы играют очень важную роль в защите организма от бактериальных и грибковых инфекций, и сравнительно меньшую — в защите от вирусных инфекций. В противоопухолевой или антигельминтной защите нейтрофилы практически не играют роли.
Нейтрофильный ответ (инфильтрация очага воспаления нейтрофилами, повышение числа нейтрофилов в крови, сдвиг лейкоцитарной формулы влево с увеличением процента «юных» форм, указывающий на усиление продукции нейтрофилов костным мозгом) — самый первый ответ на бактериальные и многие другие инфекции.
Эозинофилы-подвид гранулоцитарных лейкоцитов крови. При окраске по Рамоновскому окрашиваются кислым эозином.Эозинофилы способны к активному амебоидному движению, к экстравазации (проникновению за пределы стенок кровеносных сосудов) и к хемотаксису (преимущественному движению в направлении очага воспаления или повреждения ткани). Эозинофилы, как и нейтрофилы, способны к фагоцитозу, причём являются микрофагами, то есть способны, в отличие от макрофагов, поглощать лишь относительно мелкие чужеродные частицы или клетки. Эозинофилы способны поглощать и связывать гистамин и ряд других медиаторов аллергии и воспаления. Они также обладают способностью при необходимости высвобождать эти вещества, подобно базофилам. То есть эозинофилы способны играть как про-аллергическую, так и защитную анти-аллергическую роль. Процентное содержание эозинофилов в крови увеличивается при аллергических состояниях. Эозинофилы менее многочисленны, чем нейтрофилы. Большая часть эозинофилов недолго остаётся в крови и, попадая в ткани, длительное время находится там. Эозинофилы также обладают цитотоксической активностью в отношении многих видов паразитов, в частности гельминтов, и играют важную роль в защите организма хозяина от паразитарных инвазий.
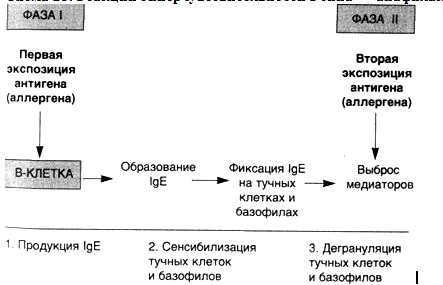
Базофилы. -подвид гранулоцитарных лейкоцитов крови. При окраске по Рамоновскому окрашиваются основными красителями.Базофилы — очень крупные гранулоциты: они крупнее и нейтрофилов, и эозинофилов. Гранулы базофилов содержат большое количество гистамина, серотонина, лейкотриенов, простагландинов и других медиаторов аллергии и воспаления. Базофилы принимают активное участие в развитии аллергических реакций немедленного типа. Попадая в ткани, базофилы превращаются в тучные клетки, содержащие большое количество гистамина — биологически активного вещества, которое стимулирует развитие аллергии. Благодаря базофилам яды насекомых или животных сразу блокируются в тканях и не распространяются по всему телу. Также базофилы регулируют свертываемость крови при помощи гепарина. Базофилы являются прямыми родственниками и аналогами тканевых лаброцитов, или тучных клеток. Подобно тканевым лаброцитам, базофилы несут на поверхности IgE-иммуноглобулин и способны к дегрануляции (высвобождению содержимого гранул во внешнюю среду) или аутолизу (растворению, лизису клетки) при контакте с антигеном-аллергеном. При дегрануляции или лизисе базофила высвобождается большое количество гистамина, серотонина, лейкотриенов, простагландинов и других биологически активных веществ. Это и обусловливает наблюдаемые проявления аллергии и воспаления при воздействии аллергенов. Базофилы способны к экстравазации (эмиграции за пределы кровеносных сосудов), причём могут жить вне кровеносного русла, становясь резидентными тканевыми лаброцитами (тучными клетками). Базофилы обладают способностью к хемотаксису и фагоцитозу, но, по-видимому, не играют какой-либо существенной роли в иммунном ответе организма ввиду их малочисленности. Кроме того, по всей видимости, фагоцитоз не является для базофилов ни основной, ни естественной (осуществляемой в естественных физиологических условиях) активностью.
T-лимфоциты— лимфоциты, развивающиеся у млекопитающих в тимусе из предшественников — претимоцитов, поступающих в него из красного костного мозга. В тимусе T-лимфоциты дифференцируются, приобретая Т-клеточные рецепторы (TCR) и поверхностные маркеры. Играют важную роль в приобретённом иммунном ответе. Обеспечивают распознавание и уничтожение клеток, несущих чужеродные антигены, усиливают действие моноцитов, NK-клеток, а также принимают участие в переключении изотиповHYPERLINK "http://ru.wikipedia.org/wiki/Иммуноглобулин"иммуноглобулинов (в начале иммунного ответа B-клетки синтезируют IgM, позже переключаются на продукцию IgG,IgE, IgA).
Существует несколько видов Т-лимфоцитов:
Т-киллеры
Т-хелперы
Т-регуляторы
Т-амплифайеры
Т-контрсупрессоры
Т-клетки памяти
Т-киллеры,— вид лимфоцитов, осуществляющий лизис повреждённых клеток собственного организма. Мишени Т-киллеров — это клетки, поражённые внутриклеточными паразитами (к которым относятся вирусы и некоторые виды бактерий), опухолевые клетки. T-киллеры специфически распознают определённый антиген и убивают только клетки с этим антигеном.T-лимфоциты могут узнать чужеродный антиген только в том случае, если он экспрессирован на поверхности клетки В процессе распознавания поверхностного антигена цитотоксический T-лимфоцит вступает в контакт с клеткой-мишенью и в случае обнаружения чужеродного антигена уничтожает ее до начала репликации. Кроме того, он продуцирует гамма-интерферон, который ограничивает проникновение вируса в соседние клетки. Цитотоксические T-лимфоциты развиваются в тимусе.В ходе селекции бо́льшая часть клонов предшественников T-лимфоцитов погибает посредством индуцированного апоптоза.
Сформированные Т-киллеры циркулируют по кровеносной и лимфатической системам, периодически возвращаясь (хоминг лимфоцитов) в лимфоидные органы (селезёнку, лимфатические узлы и др.). При получении сигнала активации от Т-хелперов определённый клон Т-киллеров начинает пролиферацию (размножение).
Т-хелперы (от англ. helper — помощник) — Т-лимфоциты, главной функцией которых является усиление адаптивного иммунного ответа. Активируют Т-киллеры, В-лимфоциты, моноциты, NK-клетки, презентируя им фрагменты чужеродного антигена при прямом контакте, а также гуморально, выделяя цитокины. Основным фенотипическим признаком Т-хелперов служит наличие на поверхности клетки молекулы CD4. Т-хелперы распознают антигены при взаимодействии их Т-клеточного рецептора (TCR) с антигеном, связанным с молекулами главного комплекса гистосовместимости 2 класса (MHC-II).
Регуляторные Т-лимфоциты, Т-регуляторные клетки, Т-супрессоры (англ. regulatory T cells, suppressor T cells, Treg) — центральные регуляторы иммунного ответа. Основная их функция — контролировать силу и продолжительность иммунного ответа через регуляцию функции Т-эффекторных клеток (Т-хелперов и Т-цитотоксических клеток).
Т-клетки памяти — хранят информацию о ранее действовавших антигенах и формируют вторичный иммунный ответ, осуществляющийся в более короткие сроки, чем первичный иммунный ответ, так как минует основные стадии этого процесса.
Т-клеточный рецепторы (англ. TCR) — поверхностные белковые комплексы Т-лимфоцитов, ответственные за распознавание процессированныхантигенов, связанных с молекулами главного комплекса гистосовместимости (англ. MHC) на поверхности антиген-представляющих клеток. TCR состоит из двух субъединиц, заякоренных в клеточной мембране и ассоциирован с многосубъединичным комплексом CD3. Взаимодействие TCR с MHC и связанным с ним антигеном ведет к активации Т-лимфоцитов и является ключевой точкой в запуске иммунного ответа. TCR представляет собой гетеродимерный белок, состоящий из двух субъединиц — α и β либо γ и δ, представленных на поверхности клетки. Субъединицы закреплены в мембране и связаны друг с другом дисульфидной связью. По своей структуре субъединицы TCR относятся к суперсемейству иммуноглобулинов. Каждая из субъединиц образована двумя доменами с характерной иммуноглобулиновой укладкой, трансмембранным сегментом и коротким цитоплазматическим участком. N-концевые домены являются вариабельными (V) и отвечают за связывание антигена, презентируемого молекулами главного комплекса гистосовместимости. В составе вариабельного домена содержится характерный для иммуноглобулинов гипервариабельный участок (CDR). За счет необычайного разнообразия данных участков, различные Т-клетки способны распознавать широчайший спектр различных антигенов. Второй домен — константный (C) и его структура одинакова у всех субъединиц данного типа у конкретной особи (за исключением соматических мутаций на уровне генов любых других белков). На участке между С-доменом и трансмембранным сегментом имеется остаток цистеина, с помощью которого между двумя цепями TCR образуется дисульфидная связь.
СD4,СD8
В зависимости от особенностей антигенпредставляющей клетки, функ-ционирующей в комплексе с тимоцитами, на их мембране экспрес-сируется либо маркер CD4, комплементарно реагирующий с молекулами МНС-II, ли-бо CD8, связывающийся с собственными МНС-I. В последующем из CD4-лимфоцита в периферических тканях образуются Т-хелперы, а из CD8-тимоцитов образуются цитотоксические Т-лимфоциты.
Таким образом, для CD4- и СD8-Т-лимфоцитов характерно распознавание чужеродного антигена лишь в комплексе с аутологичным мембранным бел-ком, кодируемым главным комплексом гистосовместимости. Подобные клет-ки, способные к одновременному распознаванию чужеродного антигена в комплексе с продуктами собственных МНС-генов, подвергаются положи-тельной селекции в тимусе. Эти клетки мигрируют из тимуса в кровь, а также в ткани. После встречи Т-лимфоцитов в периферических тканях с антигеном начинается 2-й этап дифференцировки Т-лимфоцита-иммуногенез. Контакт лимфоцитов с антигеном может происходить в регионарных лимфатических узлах при проникновении антигена через покровные барьерные ткани, а так-же в селезенке при проникновении антигенов в кровоток. В случае энтераль-ного поступления антигена его взаимодействие с лимфоцитами осуществля-ется в брыжеечных лимфатических узлах. Миграция лимфоцитов из крови в ткани происходит преимущественно через кубовидный эндотелий постка-пиллярных венул при участии адгезивных молекул, экспрессируемых на их поверхности, в частности, L-селектинов.
Основными функциональными субпопуляциями CD4 лимфоцитов явля-ются Т-хелперы (Th0, Th1, Th2, Th3) , выделена также минорная субпопуля-ция цитотоксических лимфоцитов с мембранным маркером CD4.
CD8 Т-лимфоциты распознают чужеродный антиген только в его связи с молекулами МНС-I на поверхности клеток. Антигенпредставляющими клет-ками для CD8Т-лимфоцитов может быть любая клетка, поскольку антигены МНС-I экспрессируются на всех клетках организма с различной степенью интенсивности.
B-лимфоци́ты — функциональный тип лимфоцитов, играющих важную роль в обеспечении гуморального HYPERLINK "http://ru.wikipedia.org/wiki/Гуморальный_иммунитет"иммунитета. У эмбрионов человека и других млекопитающих B-лимфоциты образуются в печени и костном мозге из стволовых клеток, а у взрослых млекопитающих — в красном костном мозге. Экспрессия всеми В-клетками мембранных иммуноглобулинов позволяет осуществляться клональному отбору под действием антигена. При созревании, антиген-стимулировании и пролиферации существенно меняется набор маркеров В-клеток. По мере созревания В-клетки переключаются от синтеза и IgD на синтез IgG, IgA, IgE (при этом у клеток сохраняется способность синтезировать также IgM и IgD- вплоть до трёх классов одновременно). При переключении синтеза изотипов антигенная специфичность антител сохраняется. Различают:
Собственно В-клетки - неактивированные В-лимфоциты, не контактировавшие с антигеном.Полиспецифичны и имеют слабое сродство к многим антигенам.
В-клетки памяти - активированые В-лимфоциты. Являются долгоживущим клоном В-клеток, обеспечивая быстрый иммунный ответ и выработку большого количества иммуноглобулинов при повторном введении того же антигена. позволяют иммунной системе «помнить» антиген на протяжении многих лет после прекращения действия антигена.
Плазматические клетки - являются последним этапом дифференцировки активированных В-клеток, провзаимодействовавшими с антигеном. В отличие от остальных В-клеток несут мало мембранных антител и способны секретировать растворимые антитела. Являются короткоживущими клетками (2-3 дня) и быстро элиминируются при отсутствии антигена, вызвавшего иммунный ответ.
К популяции В-клеток можно отнести две субпопуляции: B-2 и В-1 клетки. В-1— это большая группа В-клеток у человека и мышей. Они могут составлять около 5% от общей популяции B-клеток. Такие клетки появляются в течение эмбрионального периода. На своей поверхности они экспрессируют IgM и небольшое количество (или вовсе не экспрессируют) IgD. Маркером этих клеток является CD5. Однако он не является обязательным компонентом клеточной поверхности. У животных В-1 клетки находятся в лимфоузлах и селезёнке. В эмбриональном периоде В-1 клетки появляются из стволовых клеток костного мозга.
B1–лимфоциты поддерживают свою физиологическую регенерацию в течение всей жизни из отдельной клетки–предшественницы, пул которой у взрослых не пополняется за счёт общей стволовой кроветворной клетки костного мозга. Эта отдельная клетка–предшественница отселяется из кроветворной ткани на свою анатомическую территорию — в брюшную и плевральную полости — ещё в эмбриональном периоде. Итак, место обитания B1–лимфоцитов — прибарьерные полости. B1–лимфоциты значительно отличаются от B2–лимфоцитов по антигенраспознавательным способностям продуцируемых антител. Антитела, синтезированные B1–лимфоцитами, не имеют значительного разнообразия вариабельных участков молекул иммуноглобулинов, но, напротив, ограничены в репертуаре распознаваемых антигенов, и эти антигены — наиболее распространённые соединения клеточных стенок бактерий. Все B1–лимфоциты — как бы один не слишком специализированный, но определённо ориентированный (антибактериальный) клон. Антитела, продуцируемые B1–лимфоцитами, почти исключительно IgM, переключение классов иммуноглобулинов в B1–лимфоцитах не «предусмотрено». Таким образом, B1–лимфоциты — «отряд» противобактериальных «пограничников» в прибарьерных полостях, предназначенных для быстрой реакции на «просачивающиеся» через барьеры инфекционные микроорганизмы из числа широко распространённых. В сыворотке крови здорового человека преобладающая часть иммуноглобулинов — продукт синтеза как раз B1–лимфоцитами, т.е. это относительно полиспецифичные иммуноглобулины антибактериального назначения.
Естественные киллеры, натуральные киллеры— большие гранулярные лимфоциты, обладающие цитотоксичностью против опухолевых клеток и клеток, зараженных вирусами. В настоящее время NK-клетки рассматривают как отдельный класс лимфоцитов. NK выполняют цитотоксические и цитокин-продуцирующие функции. NK являются одним из важнейших компонентов клеточного врождённого иммунитета. NK формируются в результате дифференцировки лимфобластов (общих предшественников всех лимфоцитов). Они не имеют Т-клеточных рецепторов, CD3 или поверхностных иммуноглобулинов, но обычно несут на своей поверхности маркеры CD16 и CD56 у людей или NK1.1/NK1.2 у некоторых линий мышей. Около 80% NK несут CD8.Эти клетки были названными естественными киллерами, поскольку, по ранним представлениям, они не требовали активации для уничтожения клеток, не несущих маркеров главного комплекса гистосовместимости I типа. Основная функция NK - уничтожение клеток организма, не несущих на своей поверхности MHC1 и таким образом недоступных для действия основного компонента противовирусного иммунитета - Т-киллеров. Уменьшение количества MHC1 на поверхности клетки может быть следствием трансформации клетки в раковую или действием вирусов, таких как папилломавирус и ВИЧ.
Иммуноглобулины всех изотипов бифункциональны. Это означает, что иммуноглобулин любого типа
распознает и связывает антиген, а затем
усиливает киллинг и/или удаление иммунных комплексов, сформированных в результате активации эффекторных механизмов.
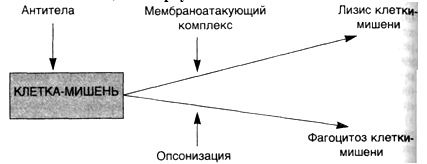
Одна область молекулы антител (Fab) определяет ее антигенную специфичность, а другая (Fc) осуществляет эффекторные функции: связывание с рецепторами, которые экспрессированы на клетках организма (например, фагоцитах); связывание с первым компонентом (C1q) системы комплемента для инициации классического пути каскада комплемента.
IgG является основным иммуноглобулином сыворотки здорового человека (составляет 70-75 % всей фракции иммуноглобулинов), наиболее активен во вторичном иммунном ответе и антитоксическом иммунитете. Благодаря малым размерам (коэффициент седиментации 7S, молекулярная масса 146 кДа) является единственной фракцией иммуноглобулинов, способной к транспорту через плацентарный барьер и тем самым обеспечивающей иммунитет плода и новорожденного. В составе IgG 2-3 % углеводов; два антигенсвязывающих Fab-фрагмента и один FC-фрагмент. Fab-фрагмент (50-52 кДа) состоит из целой L-цепи и N-концевой половины H-цепи, соединённых между собой дисульфидной связью, тогда как FC-фрагмент (48 кДа) образован C-концевыми половинами H-цепей. Всего в молекуле IgG 12 доменов (участки, сформированные из β-структуры и α-спиралей полипептидных цепей Ig в виде неупорядоченных образований, связанных между собой дисульфидными мостиками аминокислотных остатков внутри каждой цепи): по 4 на тяжёлых и по 2 на лёгких цепях.
IgM представляют собой пентамер основной четырехцепочечной единицы, содержащей две μ-цепи. При этом каждый пентамер содержит одну копию полипептида с J-цепью (20 кДа), который синтезируется антителообразующей клеткой и ковалентно связывается между двумя соседними FC-фрагментами иммуноглобулина. Появляются при первичном иммунном ответе B-лимфоцитами на неизвестный антиген, составляют до 10 % фракции иммуноглобулинов. Являются наиболее крупными иммуноглобулинами (970 кДа). Содержат 10-12 % углеводов. Образование IgM происходит ещё в пре-B-лимфоцитах, в которых первично синтезируются из μ-цепи; синтез лёгких цепей в пре-B-клетках обеспечивает их связывание с μ-цепями, в результате образуются функционально активные IgM, которые встраиваются в поверхностные структуры плазматической мембраны, выполняя роль антиген распознающего рецептора; с этого момента клетки пре-B-лимфоцитов становятся зрелыми и способны участвовать в иммунном ответе.
IgA сывороточный IgA составляет 15-20 % всей фракции иммуноглобулинов, при этом 80 % молекул IgA представлено в мономерной форме у человека. Секреторный IgA представлен в димерной форме в комплексе секреторным компонентом, содержится в серозно-слизистых секретах (например в слюне, слезах, молозиве, молоке, отделяемом слизистой оболочки мочеполовой и респираторной системы). Содержит 10-12 % углеводов, молекулярная масса 500 кДа.
IgD составляет менее одного процента фракции иммуноглобулинов плазмы, содержится в основном на мембране некоторых В-лимфоцитов. Функции до конца не выяснены, предположительно является антигенным рецептором с высоким содержанием связанных с белком углеводов для В-лимфоцитов, еще не представлявшихся антигену. Молекулярная масса 175 кДа.
IgE в свободном виде в плазме почти отсутствует. Способен осуществлять защитную функцию в организме от действия паразитарных инфекций, обуславливает многие аллергическиереакции. Механизм действия IgE проявляется через связывание с высоким сродством (10−10М) с поверхностными структурами базофилов и тучных клеток, с последующим присоединением к ним антигена, вызывая дегрануляцию и выброс в кровь высоко активных аминов (гистамина и серотонина — медиаторов воспаления). 200 кДа.



 Иммунология
— наука
о
факторах и механизмах , обуславливающих
невоспреимчивость человека и животных
к инфекционным микроорганизмам.
Иммунология
— наука
о
факторах и механизмах , обуславливающих
невоспреимчивость человека и животных
к инфекционным микроорганизмам.
Иммунология — это наука о строении и закономерностях функционирования иммунной системы, её заболеваниях и способах иммунотерапии.
Иммунология изучает
Строение иммунной системы;
Закономерности и механизмы развития иммунных реакций;
Механизмы контроля и регуляции иммунных реакций;
Болезни иммунной системы и её дисфункции;
Условия и закономерности развития иммунопатологических реакций и способы их коррекции;
Возможность использования резервов и механизмов иммунной системы в борьбе с инфекционными и неинфекционными заболеваниями;
Иммунологические проблемы трансплантации органов и тканей.
Иммунитет — невосприимчивость, сопротивляемость организма инфекциям и инвазиям чужеродных организмов, а также воздействию чужеродных веществ, обладающих антигенными свойствами. Иммунные реакции возникают и на собственные клетки организма, измененные в антигенном отношении
Имму́нная систе́ма — подсистема, существующая у позвоночных животных и объединяющая органы и ткани, которые защищают организм от заболеваний, идентифицируя и уничтожая опухолевые клетки и патогены.Конечной целью иммунной системы является уничтожение чужеродного агента, которым может оказаться болезнетворный микроорганизм, инородное тело, ядовитое вещество или переродившаяся клетка самого организма. Этим достигается биологическая индивидуальность организма.
ИММУННАЯ РЕАКЦИЯ, взаимодействие антитела с соответствующим антигеном. Дает возможность идентифицировать антиген (напр., выявить возбудителя болезни), определить степень иммунитета организма.
Иммунный ответ— это сложная многокомпонентная, кооперативная реакция иммунной системы организма, индуцированная антигеном и направленная на его элиминацию. Явление иммунного ответа лежит в основе иммунитета. Иммунный ответ зависит от:
антигена — свойства, состав, молекулярная масса, доза, кратность попадания, длительность контакта); — состояния организма (иммунологическая реактивность);
условий внешней среды
2. Эмпирический этап иммунологии начался в глубокой древности. 3000 лет назад индийские врачеватели одевали здоровых детей в рубахи выздоравливающих оспенных больных; в IХ веке до н. э. в Китае пользовались вдуванием в нос здоровым людям высушенных струпьев оспенных больных.
Древнегреческий историк Фукидид в 5 веке до н. э. отмечал, что при эпидемиях никто из переболевших не заболевал повторно.
Вершиной эмпирического периода явился удачный эксперимент Эдуарда Дженнера по созданию искусственного иммунитета все к той же оспе в 1776 году.
Увертюрой к научной иммунологии явилась работа Луи Пастера по предупреждению куриной холеры путем введения ослабленного штамма возбудителя (вакцинация). Пастер пытался дать теоретическое обоснование своему открытию, но считать это началом иммунологии, как науки нельзя. «Отцами основателями» иммунологии явились Илья Ильич Мечников и группа учеников Р. Коха во главе с Паулем Эрлихом.
В 1882 году И. Мечников формулирует клеточную трактовку иммунитета: в организме имеются специализированные клетки — фагоциты, которые поглощают микробы и уничтожают их. В это же время (80-е годы) немецкие исследователи обнаруживают мощный бактерицидный эффект плазмы крови, справедливо предположив наличие в ней антимикробных факторов (Рудольф Эммерих в 1887 при краснухе, Эмиль Беринг при дифтерии). Эти гипотетические антимикробные факторы Эрлихом были названы антителами.
Около 20 лет происходило напряженное противостояние клеточной и гуморальной теорий иммунитета. Постепенно споры стали стихать: поняли, что единая система иммунной защиты состоит из нераздельных составляющих клеточного и гуморального звена. В 1908 году И. Мечников и П. Эрлих были удостоены Нобелевской премии за выдающийся вклад в разработку теории иммунитета. Интерес к иммунитету никогда не ослабевал, но второе рождение он получил благодаря практическим успехам по пересадки тканей и органов: надо было понять суть отторжения пересаженных тканей. Только в 50-х годах Питер Медавар, установил, что отторжение трансплантатов является иммунологическим процессом и главными «виновниками» отторжения являются лимфоциты (Нобелевская премия совместно с Ф. Бернетом в 1960 году).
Чуть позже Сидней Портер и Джеральд Эдельман установили структуру антител (Нобелевская премия 1972 года). В 60-х годах исследованиями Джека Миллера и Дж. Ф. Митчела была установлена роль и место тимуса в иммунном процессе.
Последние десятилетия накапливают наши знания в области медиаторов, осуществляющих «связь» внутри системы иммунитета.
3. Вторая половина XX в. характеризуется бурным развитием иммунологии. Иммунная система была определена как комплекс биологических механизмов организма, направленных на поддержание структурного и функционального гомеостаза. Элементы иммунной системы распознают «свои» и «чужие» Аг и удаляют всё генетически отличное от него как чужеродное.
Биологическая цель иммунных реакций — поддержание индивидуальности конкретного организма и отдельного вида; защита его от различных инфекционных и неинфекционных болезней.
В настоящее время иммунология — биомедицинская дисциплина, включающая общие и частные направления.
Общая иммунология изучает молекулярные и клеточные основы иммунных реакций, их регуляцию, генетический контроль, а также принципы наследования клеточных Аг и роль иммунных механизмов в процессах индивидуального развития.Частная иммунология носит прикладной характер; основные направления — вакцинология, иммуноонкология, иммунопатология, аллергология,трансплантационная иммунология.
Вакцинология изучает методы искусственного создания невосприимчивости к инфекционным агентам и принципы разработки новых вакцинных препаратов.
Трансплантационная иммунология изучает иммунную несовместимость тканей, отторжение трансплантатов, условия и способы преодоления несовместимости.Иммуноонкология — наука, изучающая роль иммунной системы в развитии злокачественных заболеваний.Иммунопатология и аллергология изучают нарушения иммунных реакций и механизмы развития извращённых реакций на Аг. Разработка новых методов иммунодиагностики заболеваний, создание средств и способов коррекции иммунных нарушений — не менее актуальные направления современной иммунологии.
задачи иммунологии:
1. выяснение биохимических механизмов иммуногенеза (образование иммунитета и ИКК) 2. исследование структуры, свойств, функций лимфоидных клеток. 3 исследование физ-хим процессов на мембранах клеток.
5. Иммунитет — невосприимчивость, сопротивляемость организма инфекциям и инвазиям чужеродных организмов (в том числе — болезнетворных микроорганизмов), а также воздействию чужеродных веществ, обладающих антигенными свойствами. Иммунные реакции возникают и на собственные клетки организма, измененные в антигенном отношении[1].
Биологический смысл иммунитета — обеспечение генетической целостности организма на протяжении его индивидуальной жизни[2]. Развитие иммунной системы обусловило возможность существования сложно организованных многоклеточных организмов[3].
Врождённый (неспецифический, конституционный) иммунитет обусловлен анатомическими, физиологическими, клеточными или молекулярными особенностями, закрепленными наследственно. Как правило, не имеет строгой специфичности к антигенам, и не обладает памятью о первичном контакте с чужеродным агентом[4]. Например:
Все люди невосприимчивы к чуме собак.
Некоторые люди невосприимчивы к туберкулёзу.
Показано, что некоторые люди невосприимчивы к ВИЧ.
Приобретенный иммунитет делится на активный и пассивный.
Приобретенный активный иммунитет возникает после перенесенного заболевания или после введения вакцины.
Приобретенный пассивный иммунитет развивается при введении в организм готовых антител в виде сыворотки или передаче их новорожденному с молозивом матери или внутриутробным способом.
Также иммунитет делится на естественный и искусственный.
Естественный иммунитет включает врожденный иммунитет и приобретенный активный (после перенесенного заболевания). А также пассивный при передаче антител ребёнку от матери.
Искусственный иммунитет включает приобретенный активный после прививки (введение вакцины) и приобретенный пассивный (введение сыворотки)
6. Под естественной резистентностью организма понимается иммунологически неспецифическая реакция распознавания и подавления размножения одноклеточных и многоклеточных паразитов, клеток (нормальных, повреждённых, мутантных, стареющих, опухолевых, инфицированных вирусами), микробов, вирусов и др.
Наряду с иммунитетом организм человека обладает неспецифической сопротивляемостью, которая зависит от многочисленных факторов. К ним относится непроницаемость здоровой кожи и слизистых оболочек для микроорганизмов; непроницаемость гистогематических барьеров; наличие бактерицидных веществ в биологических жидкостях организма (слюна, слеза, спинномозговая жидкость, кровь); выделение вирусов почками; фагоцитарная система ( HYPERLINK "http://medbiol.ru/medbiol/immunology/imm-gal/000bd465.htm"макрофаги , нейтрофилы ); гидролитические ферменты ;интерферон ; лимфокины ; система комплемента и др. Неспецифические защитные факторы обеззараживают даже вещества, с которыми организм ранее не встречался. Специфические начинают действовать после первичного контакта с антигеном .
У позвоночных фагоцитоз осуществляется лейкоцитами крови и лимфы, а также фиксированными купферовыми клетками печени, гистиоцитами селезёнки, костного мозга, лимфатических узлов (клетками РГС), эндотелием кровеносных и лимфатических сосудов, гистиоцитами рыхлой соединительной ткани, которые на основании единства их происхождения, морфологии и функции объединены в систему мононуклеарных фагоцитов – СМФ
Главная функция тканевых макрофагов – распознавание чужеродного материала, его поглощение, обезвреживание и переваривание в соответствующих внутриклеточных ультраструктурах.
В распознавании чужеродных частиц и макромолекул важную роль играют рецепторы цитоплазматической мембраны макрофага. Многочисленные рецепторы, выявленные на их поверхности, принимают участие в процессах адгезии, эндоцитоза, межклеточных взаимодействий
К системе мононуклеарных фагоцитов можно отнести и нейтрофилы периферической крови человека и животных, причём по функциональным свойствам. У них, так же как и у макрофагов, на поверхности обнаружены рецепторы для факторов комплемента, иммуноглобулинов и хемотаксически активных пептидов, а также рецепторы для гормонов. Выявлено наличие контактов между лимфоцитами и нейтрофилами. Одновременно показано, что стимулированные эндотоксином моноциты человека, секретируют моноцитарный фактор, стимулирующий случайную миграцию нейтрофилов
Отметим, что уничтожение живых объектов, или завершенный фагоцитоз, - одна из основных функций нейтрофила. Переваривание осуществляется при помощи многочисленных ферментов гранул, которые гидролизуют практически любые биологические структуры – белки, нуклеиновые кислоты, липиды.
Кислородные радикалы вместе с перекисью водорода, миелопероксидазой и галогенами составляют эффекторное звено аппарата цитотоксичности нейтрофила.
Гуморальные факторы ЕР. Естественную резистентность млекопитающих к патогенным микроорганизмам и чужеродным агентам определяют неспецифические клеточные и гуморальные факторы. К этим факторам относят защитные свойства кожи и слизистых оболочек, бактерицидную активность сыворотки крови, слезной жидкости, слюны, молока и других жидкостей организма, которые обеспечиваются наличием в них неспецифических гуморальных факторов – лизоцим, комплемент, пропердин, интерферон, бета – лизин, естественные антитела и другие
Лизоцим – фермент, обладающий свойством лизировать целый ряд, в основном грамположительных, микроорганизмов. Основными продуцентами лизоцима являются гранулоциты и моноциты крови, макрофаги костного мозга и селезёнки. Много его в слёзной жидкости, секретах слизистой ротовой полости и верхних дыхательных путей, то есть в тех органах, которые являются первым барьером на пути проникновения микробов в организм животного.
Комплемент – сложный комплекс белков сыворотки крови глобулиновой природы. В его составе 9 компонентов разных по своему химическому составу, физиологическим и биологическим свойствам. Активным является весь комплемент в целом, а не отдельные его компоненты. Наиболее высокое содержание комплемента выявлено в сыворотке крови морских свинок. Он способствует лизису сенсибилизированных бактерий в присутствии бактериолизинов, лизису сенсибилизированных эритроцитов и опсонизации бактерий к фагоцитозу. В отсутствие комплемента активность некоторых антител полностью утрачивается, поэтому содержание и активность комплемента служит характеристикой состояния естественной резистентности.
Интерферон – рассматривается как один из неспецифических факторов, участвующих в противовирусной защите. Он образуется в клетке сразу после проникновения в нее вируса и является продуктом клетки хозяина. Кроме того, интерферон представляет собой универсальную регуляторную молекулу, способную модулировать чуть ли не все функции мононуклеарных фагоцитов Существуют 3 класса интерферонов – α, β и γ.
При экспозиции с интерфероном мононуклеарные фагоциты выделяют интерлейкин – 1. Это лимфоидный рострегулирующий фактор, участвующий в начальных этапах активации лимфоцитов при воздействии антигенов
Пропердин –Содержится в нормальной сыворотке крови, обладает бактерицидным действием и способен убивать большинство грамположительных и грамотрицательных бактерий.
Точнее следует говорить о действии не самого, а системы пропердина, поскольку активность его проявляется лишь в присутствии других факторов сыворотки – комплемента, а также ионов магния
Бета – лизин – является термостабильным белком с молекулярной массой 6000Д, который обеспечивает лизирующие свойства сыворотки крови в отношение грамположительных микробов. Предполагается, что продуцентами бета – лизинов являются тромбоциты, из которых он переходит в сыворотку во время свёртывания крови
Итак, представления о системе естественной резистентности и составляющих её компонентах претерпели значительную эволюцию: фагоциты перестали считать фактором исключительно противомикробной резистентности. Современная позиция отражает представления более общего плана, согласно которым фагоцитарная система рассматривается как важный эффектор структурного гомеостаза. Фагоцитарная система является филогенетически самой древней системой защиты организма от чужеродных агентов. Все живые организмы на любой ступени эволюции от простейших одноклеточных до млекопитающих способны к фагоцитозу. Основные фагоцитирующие клетки позвоночных – моноциты крови, тканевые макрофаги и нейтрофилы – участвуют в процессах поддержания гомеостаза организма, воспаления и регенерации, в неспецифической противомикробной защите, в иммуногенезе и реакциях специфического иммунитета.Именно поэтому естественной резистентности, эффекторами которой являются макрофаги, нейтрофилы и моноциты, клетки – естественные киллеры и неспецифические гуморальные факторы (комплемент, интерферон, лизоцим и др.) отводится существенная роль в защите организма, включая и противоопухолевую защиту.
7. Нормальная микрофлора — неспецифический стимулятор («раздражитель») иммунной системы; отсутствие нормального микробного биоценоза вызывает многочисленные нарушения в иммунной системе. Другая роль микрофлоры была установлена после того, как были получены безмикробные животные-гнотобионты Было показано, что нормальная микрофлора оказывает постоянное антигенное «раздражение» иммунной системы, а у гнотобионтов его отсутствие вызывает недоразвитие основных иммунокомпетентных органов (например, тимуса, лимфоидной ткани кишечника). Аг представителей нормальной микрофлоры вызывают образование AT в низких титрах. Они преимущественно представлены IgA, выделяющимися на поверхность слизистых оболочек. IgA составляют основу местной невосприимчивости к проникающим возбудителям и не дают возможности комменсалам проникать в глубокие ткани.
Вклад нормальной миклофлорыв в метаболизм
Нормальная кишечная микрофлора играет огромную роль в метаболических процессах организма и поддержании их баланса.
Обеспечение всасывания. Метаболизм некоторых веществ включает печёночную экскрецию (в составе жёлчи) в просвет кишечника с последующим возвратом в печень; подобный печёночно-кишечный круговорот характерен для некоторых половых гормонов и солей жёлчных кислот. Эти продукты экскретируются, как правило, в форме глюкуронидов или сульфатов, не способных в этом виде к обратному всасыванию. Всасывание обеспечивают кишечные бактерии, вырабатывающие глюкуронидазы и сульфатазы. Сульфатазы могут оказывать и неблагоприятное действие, установленное на примере искусственного подсластителя цикла-мата. Фермент конвертирует цикламат в канцерогенный продукт циклогексамин, вызывающий злокачественное перерождение эпителия мочевого пузыря. Обмен витаминами и минеральными веществами. Общепринятый факт — ведущая роль нормальной микрофлоры в обеспечении организма человека ионами Fe2+, Ca2+, витаминами К, D, группы Б (особенно В,, рибофлавин), никотиновой, фолиевой и пантотеновой кислотами.
Кишечные бактерии принимают участие в инактивации токсичных продуктов эндо- и экзогенного происхождения. Кислоты и газы, выделяющиеся в ходе жизнедеятельности кишечных микробов, оказывают благоприятное действие на перистальтику кишечника и своевременное его опорожнение.
8. Гуморальные факторы ЕР. Естественную резистентность млекопитающих к патогенным микроорганизмам и чужеродным агентам определяют неспецифические клеточные и гуморальные факторы. К этим факторам относят защитные свойства кожи и слизистых оболочек, бактерицидную активность сыворотки крови, слезной жидкости, слюны, молока и других жидкостей организма, которые обеспечиваются наличием в них неспецифических гуморальных факторов – лизоцим, комплемент, пропердин, интерферон, бета – лизин, естественные антитела и другие
Лизоцим – фермент, обладающий свойством лизировать целый ряд, в основном грамположительных, микроорганизмов. Основными продуцентами лизоцима являются гранулоциты и моноциты крови, макрофаги костного мозга и селезёнки. Много его в слёзной жидкости, секретах слизистой ротовой полости и верхних дыхательных путей, то есть в тех органах, которые являются первым барьером на пути проникновения микробов в организм животного.
Комплемент – сложный комплекс белков сыворотки крови глобулиновой природы. В его составе 9 компонентов разных по своему химическому составу, физиологическим и биологическим свойствам. Активным является весь комплемент в целом, а не отдельные его компоненты. Он способствует лизису сенсибилизированных бактерий в присутствии бактериолизинов, лизису сенсибилизированных эритроцитов и опсонизации бактерий к фагоцитозу. В отсутствие комплемента активность некоторых антител полностью утрачивается, поэтому содержание и активность комплемента служит характеристикой состояния естественной резистентности.
Интерферон – рассматривается как один из неспецифических факторов, участвующих в противовирусной защите. Он образуется в клетке сразу после проникновения в нее вируса и является продуктом клетки хозяина. Кроме того, интерферон представляет собой универсальную регуляторную молекулу, способную модулировать чуть ли не все функции мононуклеарных фагоцитов. Существуют 3 класса интерферонов – α, β и γ.
При экспозиции с интерфероном мононуклеарные фагоциты выделяют интерлейкин – 1. Это лимфоидный рострегулирующий фактор, участвующий в начальных этапах активации лимфоцитов при воздействии антигенов (Flynn A., Finke I.H., 1983)/
Пропердин – играет важную роль в ЕР животных и человека. Содержится в нормальной сыворотке крови, обладает бактерицидным действием и способен убивать большинство грамположительных и грамотрицательных бактерий.
Точнее следует говорить о действии не самого, а системы пропердина, поскольку активность его проявляется лишь в присутствии других факторов сыворотки – комплемента, а также ионов магния
Бета – лизин – является термостабильным белком с молекулярной массой 6000Д, который обеспечивает лизирующие свойства сыворотки крови в отношение грамположительных микробов. Предполагается, что продуцентами бета – лизинов являются тромбоциты, из которых он переходит в сыворотку во время свёртывания крови.
12. Иммунная система это совокупность органов, тканей и клеток, работа которых направлена непосредственно на защиту организма от различных заболеваний и на истребление уже попавших в организм чужеродных веществ.
К первичным (центральным) относят вилочковую железу и сумку Фабрициуса, обнаруженную только у птиц. У человека роль сумки Фабрициуса выполняет костный мозг, поставляющий стволовые клетки-предшественники лимфоцитов. Оба центральных органа иммунной системы являются местами дифференцировки популяций лимфоцитов. Вилочковая железа поставляет Т-лимфоциты (тимусзависимые лимфоциты), а в костном мозге образуются В-лимфоциты.
К периферическим лимфоидным органам относятся селезенка, лимфатические узлы, миндалины, а также ассоциированная с кишечником и бронхами лимфоидная ткань. К моменту рождения они еще практически не сформированы, поскольку не контактировали с антигенами. Лимфопоэз осуществляется лишь при наличии антигенной стимуляции.
Периферические органы иммунной системы заселяются В- и Т-лимфоцитами из центральных органов иммунной системы, причем каждая популяция мигрирует в свою зону - тимусзависимую и тимуснезависимую. После контакта с антигеном в этих органах лимфоциты включаются в рециркуляцию, поэтому ни один антиген не остается незамеченным лимфоцитами.
Иммунная система обеспечивает защиту организма от инфекций, а также удаление поврежденных, состарившихся и генетически измененных клеток и молекул собственного организма.
Красный костный мозг — центральный орган кроветворения и иммуногенеза. Содержит самоподдерживающуюся популяцию стволовых клеток. Красный костный мозг находится в ячейках губчатого вещества плоских костей и в эпифизах трубчатых костей. Здесь происходит дифференцировка В-лимфоцитов из предшественников. Содержит также Т-лимфоциты.
Тимус — центральный орган иммунной системы. В нем происходит дифференцировка Т-лимфоцитов из предшественников, поступающих из красного костного мозга.
Лимфатические узлы — периферические органы иммунной системы. Они располагаются по ходу лимфатических сосудов. В каждом узле выделяют корковое и мозговое вещество. В корковом веществе есть В-зависимые зоны и Т-зависимые зоны. В мозговом есть только Т-зависимые зоны.
Селезёнка — паренхиматозный зональный орган. Является самым крупным органом иммунной системы, кроме того, выполняет депонирующую функцию по отношению к крови. Селезёнка покрыта капсулой из плотной соединительной ткани, которая содержит гладко-мышечные клетки, позволяющие ей при необходимости сокращаться. Паренхима представлена двумя функционально различными зонами: белой и красной пульпой. Белая пульпа составляет 20 %. Представлена лимфоидной тканью. Здесь имеются В-зависимые и Т-зависимые зоны. И также здесь есть макрофаги. Красная пульпа составляет 80 %. Она выполняет следующие функции:
Депонирование зрелых форменных элементов крови.
Контроль состояния и разрушения старых и повреждённых эритроцитов и тромбоцитов.
Фагоцитоз инородных частиц.
Обеспечение дозревания лимфоидных клеток и превращение моноцитов в макрофаги.
Кровь и лимфа составляют циркуляторное звено иммунной системы. По кровотоку происходит рециркуляция лимфоцитов и миграция клеток из кроветворных в периферические органы. В лимфу лимфоциты проникают из лимфатических узлов и лимфоидной ткани слизистых оболочек, а из лимфы клетки поступают в кровоток. Таким образом, несмотря на анатомическую разобщенность, отдельные компоненты иммунной системы связаны в единую систему посредством крово- и лимфотока, где происходит постоянный процесс миграции и рециркуляции клеток.
Итак, можно сказать, что основной принцип организации иммунной системы органно-циркуляторный. Это означает, что клетки иммунной системы постоянно рециркулируют между органами иммунной системы и нелимфоидными тканями. Такая организация оптимальна для реализации функции иммунологического надзора.
13. Центральными органами иммунной системы называют органы, где происходит формирование и созревание иммуноцитов. К ним относят костный мозг, вилочковую железу (тимус) и сумку Фабрициуса. Периферические органы иммунной системы содержат зрелые лимфоциты. Здесь после антигенного воздействия происходит их дальнейшая пролиферация и дифференцировка, продуцируются антитела и эффекторньш лимфоциты.
Сумка Фабрициуса — своеобразный коллектор лимфоидной ткани. Этот орган располагается на задней поверхности клоаки. Удаление у цыплят сумки Фабрициуса приводит к избирательному выключению способности птиц синтезировать антитела, т. е. блокирует В-систему иммунитета. Способность развивать клеточные иммунные реакции (осуществляемые Т-лимфоцитами) при этом полностью сохраняется. Таким образом, сумка Фабрициуса — второй центральный орган лимфоидной системы, который производит В-лимфоциты. Существует весьма обоснованное предположение, что у млекопитающих вообще отсутствует какой-либо аналог сумки Фабрициуса и что В-система лимфоидных клеток возникает из кроветворных стволовых клеток непосредственно в костном мозге. Это подкрепляется тем, что все костномозговые лимфоциты относятся к В-лимфоцитам и могут выполнять функции предшественников антителообразующих клеток. Даже если это предположение не подтвердится и будет точно установлен аналог сумки Фабрициуса, в котором формируются В-лимфоциты перед тем как заселить костный мозг, этот орган все равно необходимо рассматривать как центральный орган иммунной системы. Дело в том, что в костном мозге находится самоподдерживающая популяция так называемых стволовых клеток — родоначальниц всех остальных клеток крови (эритроцитов, гранулоцитов, моноцитов, тромбоцитов, лимфоцитов). Важнейшим этапом в изучении стволовых клеток стало открытие канадскими учеными Т. Тиллом и Е. Маккуллохом в 1961 г. колониеобразующей способности кроветворных стволовых элементов. Ими было показано, что трансплантация клеток костного мозга смертельно облученным мышам, т. е. мышам с подавленным кроветворением, приводит к появлению в селезенке видимых на глаз кроветворных колоний, состоящих из белых, красных кровяных клеток и тромбоцитов.
тимус, или вилочковая железа, - лимфоэпителиальный орган. Он состоит из долек, каждая из которых содержит корковый и мозговой слой. Клетки-предшественники тимоцитов формируются в костном мозге и через кровь попадают в кору тимуса. Основным элементом коры являются фолликулы Кларка, в которых вокруг приводящего кровеносного сосуда концентрируются эпителиальные и дендритные клетки, макрофаги и лимфоциты. Клетки и их гуморальные продукты (цитокины, гормоны) стимулируют деление незрелых лимфоцитов, поступивших в кору. В процессе деления они созревают. На их поверхности появляются новые структуры, а некоторые стадиоспецифические структуры утрачиваются. Структуры, определяющие особенности клеток иммунной системы, обладают антигенными свойствами. Они получили название «Cluster of differentiation» (показатель дифференцировки) и обозначение CD. Лимфоциты, созревающие в тимусе, - Т-лимфоциты обладают характерными для них молекулами CD2, определяющими их адгезивные свойства и молекулами CD3, являюиимися рецепторами для антигенов. В тимусе Т-лимфоциты дифференцируются на две субпопуляции, содержащие антигены CD4 либо CD8. Лимфоциты CD4 обладают свойствами клеток-помощников - млперов (Тх), лимфоциты CD8 - цитотоксическими свойствами, а также супрессорным эффектом, заключающимся в их способности повалять активность других клеток иммунной системы.
За одни сутки в тимусе образуется 300-500 млн. лимфоцитов. При тгом на клетках формируются рецепторы как к чужеродным, так и к собственным антигенам. В ходе созревания Т-лимфоциты проходят позитивную селекцию - отбор клеток, обладающих рецепторами для молекул главного комплекса тканевой совместимости (МНС), обеспечивающих возможность последующих контактов Т-лимфоцитов с клетками, представляющими им чужеродный антиген. В корковом слое тимуса происходит и негативная селекция: клетки с рецепторами для собственных антигенов, вступающие в контакт с ними погибают. В результате в мозговой слой тимуса поступает 3-5% клеток сформировавшихся в корковом слое. Это лимфоциты с рецепторами к чужеродным антигенам способны впоследствии после контакта с соответствующим антигеном реализовать специфическую иммунную реакцию. В мозговом слое дифференцировка лимфоцитов завершается формированием CD4+- и С08+-лимфоцитов. Созревание клеток в тимусе длится 4-6 сут., после чего лимфоциты поступают в кровь, лимфу, ткани, во вторичные органы иммунной системы.
Эпителиальные клетки тимуса образуют пептидные гормоны и гормоноподобные пептиды: тимулин, альфа и бета-тимозин, тимопоетин, способствующие созреванию и дифференцировке Т-лимфоцитов в тимусе и вне него. Выделение этих гормонов и создание их синтетических аналогов производится для создания лекарственных средств, регулирующих иммунологические функции. Тимус начинает функционировать у шестинедельного эмбриона человека, к рождению его масса достигает 10-15 г, к началу полового созревания - 30-40 г. Далее происходит постепенная инволюция тимуса с утратой до 3% активной ткани ежегодно. Инволюция тимуса сопровождается снижением продукции Т-лимфоцитов. Их уровень в организме поддерживается за счет долгоживущих клеток, внетимусного созревания части клеток под действием цитокинов. Предполагают, что последствия инволюции тимуса входят в число причин старческой патологии и определяют продолжительность жизни человека.
Костный мозг, общая масса которого у человека достигает 3 кг, выполняет несколько иммунологических функций. Как уже упоминалось, костный мозг служит местом происхождения всех клеток иммунной системы. Здесь же происходит созревание и дифференцировка В-лимфоцитов. Костный мозг функционирует и как вторичный орган иммунной системы. Макрофаги костного мозга обладают фагоцитарной активностью, а В-лимфоциты дифференцируются в плазматические клетки, которые продуцируют антитела. Направления дифференцировки стволовых клеток костного мозга определяются клетками стромы костного мозга, макрофагальными клетками, лимфоцитами и образуемыми ими цитокинами. Клетки костного мозга продуцируют гормоноподобный пептидный фактор, способствующий активации В-лимфоцитов.
16. К периферическим органам относятся селезенка, лимфатические узлы, скопления лимфоидной ткани под слизистыми поверхностями желудочно-кишечного, дыхательного, мочеполового трактов (групповые лимфатические фолликулы, тонзиллы, пейеровы бляшки). .
Селезёнка. Клетки селезенки отвечают на антигены, поступающие через кровоток, и осуществляют преимущественно адаптивный гуморальный иммунный ответ (антителообразование). Удаление данного органа в связи с ее травмой, в итоге обычно приводит к очень серьезным имунным нарушениям у пациентов, поэтому здоровье селезенки и забота об этом здоровье весьма и весьма важны.
Формирование гуморального ответа на антигены, содержащиеся в крови, связано главным образом с селезенкой. Она расположена в левом верхнем квадрате брюшной полости и покрыта капсулой, от которой в паренхиму отходят трабекулы, несущие сосуды. Размеры селезенки у взрослого человека составляют приблизительно 10x15 см. Масса селезенки составляет 200-250 г. В эмбриогенезе данный орган выявляют после 2-го месяца развития, и вначале она представлена стромой, которую затем заселяют клетки иммунной системы. В селезенке плода происходит гемопоэз, который прекращается после рождения. У грызунов после рождения гемопоэтическая функция органа сохраняется.
Рассматривая селезенку как периферический орган иммунной системы, следует иметь в виду, что она состоит из красной и белой пульпы с совершенно разными иммуноопосредованными свойствами.
Белая пульпа данного органа представлена лимфоидной тканью, связанной с артериолами селезенки, обозначаемой как периартериальные лимфоидные муфты с Т- и В-клеточными зонами.
Т-клетки окружают центральную артериолу и формируют тимусзависимую зону селезенки. В-клеточные фолликулы расположены ближе к краю муфты и образуют скопления первичных или вторичных фолликулов с зародышевыми центрами и клетками памяти.
По данным анатомии человека красная пульпа состоит из венозных синусов и клеточных тяжей. В синусах наряду с форменными элементами крови расположены губчатые скопления ткани, в которой имеются макрофаги, Т-лимфоциты, покидающие селезенку через венозные синусы, и плазматические клетки — конечная стадия дифференцировки В-лимфоцитов, вышедших из зародышевых центров белой пульпы. В селезенке создаются оптимальные условия для развития адаптивного гуморального иммунного ответа (антителогенез).
Особую роль в реализации иммунных функций данного органа играет так называемая маргинальная зона, окружающая белую пульпу и содержащая уникальные оседлые клетки (В-лимфоциты, ДК, макрофаги).
Помимо выполнения иммунных функций, селезенка депонирует тромбоциты, эритроциты и гранулоциты. В красной пульпе разрушаются старые тромбоциты и эритроциты, которые затем фагоцитируются макрофагами.
Лимфатические узлы - скопления лимфоидной ткани, расположенные по ходу лимфатических и кровеносных сосудов. У человека имеется 500-1000 лимфатических узлов, а также более мелкие скопления лимфоидной ткани под слизистыми поверхностями и в коже. Лимфатические узлы обеспечивают неспецифическую резистентность организма, выполняя функции барьеров и фильтров, удаляющих из лимфы и крови чужеродные частицы. Вместе с тем лимфатические узлы служат местом формирования антител и клеток, осуществляющих клеточные иммунные реакции.
Кожа, эпителиальные и паренхиматозные органы содержат многочисленные лимфатические капилляры, собирающие тканевую жидкость, именуемую лимфой. Лимфа поступает далее в лимфатические сосуды, по ходу которых последовательно располагается множество лимфатических узлов, строма которых служит фильтром, удаляющим из лимфы практически все чужеродные частицы, в том числе и вирусы, и до 2% растворимых антигенных молекул. В лимфоузлах иммунного организма задерживаются практически все водорастворимые антигены.
Лимфатический узел покрыт соединительнотканной капсулой, от которой внутрь узла отходят трабекулы, разделяющие его на доли, в которых содержится корковое и мозговое вещество, а между ними лежит паракортикальный слой. Основной структурой коркового вещества являются скопления лимфоидных фолликулов, содержащих лимфоциты, преимущественно В-группы, дендритные клетки и макрофаги. Лимфоидные фолликулы могут быть первичными и вторичными. Первичные фолликулы преобладают в покоющемся лимфоузле, содержащиеся в них клетки малоактивны, митозы встречаются редко. В случаях формирования реакции на антиген первичные фолликулы превращаются во вторичные фолликулы, называемые также зародышевыми центрами.
Функции периферических органов иммунной системы выполняют также лимфоидные структуры глоточного кольца, кишечника, мочеполовых органов, кожи, бронхов и легких. Структуры, обеспечивающие защиту слизистых, получили название - лимфоидная ткань, ассоциированная со слизистыми - MALT (Mucosa-associated lymphoid tissue). В состав MALT входят GALT, BALT - лимфоидные ткани, «ссоциированные с кишечником, с бронхолегочной системой. К ним примыкают лимфоидные структуры кожи-SALT (Skin associated lymphoid tissue). Клеточные структуры этих лимфоидных образований, а также лимфоциты, находящиеся в тканях, имеют то же происхождение, что и структуры других периферических органов иммунной системы.
22.Т- лимфоциты.
Локализация.
Обычно локализуются в так называемых Т- зависимых зонах периферических лимфоидных органов (периартикулярно в белой пульпе селезенки и паракортикальных зонах лимфоузлов).
Функции.
Т- лимфоциты распознают процессированный и представленный на поверхности антиген- представляющих ( А ) клеток антиген. Они отвечают за клеточный иммунитет, иммунные реакции клеточного типа. Отдельные субпопуляции помогают В- лимфоцитам реагировать на Т- зависимые антигены выработкой антител.
Происхождение и созревание.
Родоначальницей всех клеток крови, в том числе лимфоцитов, является единая стволовая клетка костного мозга. Она генерирует два типа клеток- предшественников- лимфоидную стволовую клетку и предшественника клеток красной крови, от которой происходят и клетки- предшественники лейкоцитов и макрофагов.
Образование и созревание иммунокомпетентных клеток осуществляется в центральных органах иммунитета (для Т- лимфоцитов- в тимусе). Клетки- предшественники Т- лимфоцитов попадают в тимус, где пре- Т- клетки (тимоциты) созревают, пролиферируют и проходят дифференцировку на отдельные субклассы в результате взаимодействия с эпителиальными и дендритными клетками стромы и воздействия гормоноподобных полипептидных факторов, секретируемых эпителиальными клетками тимуса ( альфа1- тимозин, тимопоэтин, тимулин и др.).
При дифференцировке Т- лимфоциты приобретают определенный набор мембранных CD- маркеров. Т-клетки разделяют на субпопуляции в соответствии с их функцией и профилем CD- маркеров.
Т- лимфоциты распознают антигены с помощью двух типов мембранных гликопротеинов- Т- клеточных рецепторов (семейство Ig- подобных молекул) и CD3, нековалентно связанных между собой. Их рецепторы, в отличие от антител и рецепторов В- лимфоцитов, не распознают свободно циркулирующие антигены. Они распознают пептидные фрагменты, представляемые им А- клетками через комплекс чужеродных веществ с соответствующим белком главной системы гистосовместимости 1 и 2 класса.
Выделяют три основные группы Т- лимфоцитов- помощники (активаторы), эффекторы, регуляторы.
Первая группа- помощники (активаторы), в состав которых входят Т- хелперы1, Т- хелперы2, индукторы Т- хелперов, индукторы Т- супрессоров.
1. Т- хелперы1 несут рецепторы CD4 (как и Т- хелперы2) и CD44, отвечают за созревание Т- цитотоксических лимфоцитов (Т- киллеров), активируют Т- хелперы2 и цитотоксическую функцию макрофагов, секретируют ИЛ-2, ИЛ-3 и другие цитокины.
2. Т- хелперы2 имеют общий для хелперов CD4 и специфический CD28 рецепторы, обеспечивают пролиферацию и дифференцировку В- лимфоцитов в антителпродуцирующие (плазматические) клетки, синтез антител, тормозят функцию Т- хелперов1, секретируют ИЛ-4, ИЛ-5 и ИЛ-6.
3. Индукторы Т- хелперов несут CD29, отвечают за экспрессию антигенов HLA класса 2 на макрофагах и других А- клетках.
4. Индукторы Т- супрессоров несут CD45 специфический рецептор, отвечают за секрецию ИЛ-1 макрофагами, активацию дифференцировки предшественников Т- супрессоров.
Вторая группа- Т- эффекторы. В нее входит только одна субпопуляция.
5. Т- цитотоксические лимфоциты (Т- киллеры). Имеют специфический рецептор CD8, лизируют клетки- мишени, несущие чужеродные антигены или измененные аутоантигены (трансплантант, опухоль, вирус и др.). ЦТЛ распознают чужеродный эпитоп вирусного или опухолевого антигена в комплексе с молекулой класса 1 HLA в плазматической мембране клетки- мишени.
Третья группа- Т-клетки- регуляторы. Представлена двумя основными субпопуляциями.
6. Т- супрессоры имеют важное значение в регуляции иммунитета, обеспечивая подавление функций Т- хелперов 1 и 2, В- лимфоцитов. Имеют рецепторы CD11, CD8. Группа функционально разнородна. Их активация происходит в результате непосредственной стимуляции антигеном без существенного участия главной системы гистосовместимости.
7. Т- контсупрессоры. Не имеют CD4, CD8, имеют рецептор к особому лейкину. Способствуют подавлению функций Т- супрессоров, вырабатывают резистентность Т- хелперов к эффекту Т- супрессоров.
23. Антигенраспознающие Рц Т-лимфоцитов — TCR принадлежат к надсемейству иммуноглобулинов. Выступающий над поверхностью клетки Аг-распознающий участок TCR — гетеродимер (т.е. состоит из двух разных полипептидных цепей) — аналог одного Fab-фрагмента Ig. Известны два варианта TCR, обозначаемые как TCRaP и TCRyb; эти варианты различаются составом полипептидных цепей Аг-распознающего участка. Каждый Т-лимфоцит несёт только один вариант Рц. ТаB стали известны раньше и изучены подробнее, чем Туb; поэтому строение Рц Т-лимфоцитов для Аг удобнее описывать на примере TCRap. Полностью трансмембранно расположенный TCR состоит из 8 или 10 (одна или две пары a + (3 плюс комплекс «2е + 5 + у + 2С») полипептидных цепей.• Трансмембранные цепи аир TCR. Это 2 примерно равновеликие полипептидные цепи — а (молекулярная масса 40-60 тыс., кислый гликопротеин) и р (молекулярная масса 40—50 тыс., нейтральный или основный гликопротеин). Каждая из этих цепей имеет по два гликозилированных домена во внеклеточной части Рц, гидрофобную (положительно заряженную за счёт остатков лизина и аргинина) трансмембранную часть и короткий (из 5—12 остатков АК) цитоплазматический участок. Внеклеточные части обеих цепей соединены одной дисульфидной связью. ♦ У-область. Наружные внеклеточные (дистальные) домены обеих цепей имеют вариабельный АК-состав. Они гомологичны V-области молекул Ig, это V-область TCR. Именно V-области а- и Р-цепей вступают в связь с комплексом «МНС-I/II—пептид». ♦ С-область. Проксимальные домены обеих цепей гомологичны константным областям Ig, это С-области TCR. ♦ Короткий цитоплазматический участок (как а-, так и B-цепи) не может самостоятельно обеспечить проведение сигнала внутрь клетки. Для этого служат 6 дополнительных полипептидных цепей: у , 5, две s и две С. • Комплекс CD3. Цепи у, b, e (вместе их называют комплексом CD3) необходимы для экспрессии а- и B-цепей, их стабилизации и, вероятно, проведения сигнала внутрь клетки. Комплекс CD3 состоит из внеклеточной, транс мембранной (отрицательно заряженной ипотому электростатически связанной с трансмембранными участками а- и В-цепей) и цитоплазматической частей. ♦ C-Цепи соединены между собой дисульфидным мостиком и, будучи по большей частью расположены в цитоплазме, осуществляют проведение сигнала внутрь клетки. ♦ ITAM-последовательности. Цитоплазматические участки полипептидных цепей у, b, е и С, содержат АК-последовательности ITAM (1 в у- и b8-цепях, 2 в e-цепях, 3 в каждой C-цепи), которые взаимодействуют с тирозинкиназами цитозоля (активация этих ферментов и составляет начало биохимических peaкций по проведению сигнала). В связывании Аг участвуют ионные, водородные, ван-дер-вааль-совы и гидрофобные силы, конформация Рц при этом существенно изменяется. Каждый TCR потенциально способен связывать порядка 105 разных Аг, причём не только родственные по строению (перекрёстно реагирующие), но и не имеющие гомологии в структуре.
24. Корецепторные молекулы CD4 и CD8 Помимо самого TCR, каждый зрелый Т-лимфоцит экспрессирует одну из так называемых корецепторных молекул — CD4 или CD8, которые также вступают в связь с молекулами МНС на АПК или клетках-мишенях. Каждая из них имеет цитоплазматический участок, связанный с тирозинкиназой Lck, и, вероятно, вносит свой вклад в проведение сигнала внутрь клетки при состоявшемся распознавании Аг. • CD4 вступает в связь с инвариантной частью (Р2-доменом) молекулы MHC-II. CD4 имеет молекулярную массу 55 тыс. и 4 домена во внеклеточной части. При активации Т-лимфоцита одну молекулу TCR «обслуживают» две молекулы CD4 (вероятно, происходит димеризация молекул CD4). • CD8 связывается с инвариантной частью (а3-доменом) молекулы MHC-I. CD8 — гетеродимер цепей аиB, соединённых дисульфиднойсвязью. В некоторых случаях обнаруживают гомодимер из 2-х а-цепей, который также может взаимодействовать с MHC-I. Во внеклеточной части каждая из цепей имеет по одному иммуноглобулиноподобному домену.
Иммуноглобулины всех изотипов бифункциональны. Это означает, что иммуноглобулин любого типа
распознает и связывает антиген, а затем
усиливает киллинг и/или удаление иммунных комплексов, сформированных в результате активации эффекторных механизмов.
Одна область молекулы антител (Fab) определяет ее антигенную специфичность, а другая (Fc) осуществляет эффекторные функции: связывание с рецепторами, которые экспрессированы на клетках организма (например, фагоцитах); связывание с первым компонентом (C1q) системы комплемента для инициации классического пути каскада комплемента.
IgG является основным иммуноглобулином сыворотки здорового человека (составляет 70-75 % всей фракции иммуноглобулинов), наиболее активен во вторичном иммунном ответе и антитоксическом иммунитете. Благодаря малым размерам (коэффициент седиментации 7S, молекулярная масса 146 кДа) является единственной фракцией иммуноглобулинов, способной к транспорту через плацентарный барьер и тем самым обеспечивающей иммунитет плода и новорожденного. В составе IgG 2-3% углеводов; два антигенсвязывающих Fab-фрагмента и один FC-фрагмент. Fab-фрагмент (50-52 кДа) состоит из целой L-цепи и N-концевой половины H-цепи, соединённых между собой дисульфидной связью, тогда как FC-фрагмент (48 кДа) образован C-концевыми половинами H-цепей. Всего в молекуле IgG 12 доменов (участки, сформированные из β-структуры и α-спиралей полипептидных цепей Ig в виде неупорядоченных образований, связанных между собой дисульфидными мостиками аминокислотных остатков внутри каждой цепи): по 4 на тяжёлых и по 2 на лёгких цепях.
IgM представляют собой пентамер основной четырехцепочечной единицы, содержащей две μ-цепи. При этом каждый пентамер содержит одну копию полипептида с J-цепью (20 кДа), который синтезируется антителообразующей клеткой и ковалентно связывается между двумя соседними FC-фрагментами иммуноглобулина. Появляются при первичном иммунном ответе B-лимфоцитами на неизвестный антиген, составляют до 10 % фракции иммуноглобулинов. Являются наиболее крупными иммуноглобулинами (970 кДа). Содержат 10-12% углеводов. Образование IgM происходит ещё в пре-B-лимфоцитах, в которых первично синтезируются из μ-цепи; синтез лёгких цепей в пре-B-клетках обеспечивает их связывание с μ-цепями, в результате образуются функционально активные IgM, которые встраиваются в поверхностные структуры плазматической мембраны, выполняя роль антиген распознающего рецептора; с этого момента клетки пре-B-лимфоцитов становятся зрелыми и способны участвовать в иммунном ответе.
IgA сывороточный IgA составляет 15-20 % всей фракции иммуноглобулинов, при этом 80 % молекул IgA представлено в мономерной форме у человека. Секреторный IgA представлен в димерной форме в комплексе секреторным компонентом, содержится в серозно-слизистых секретах (например в слюне, слезах, молозиве, молоке, отделяемом слизистой оболочки мочеполовой и респираторной системы). Содержит 10-12% углеводов, молекулярная масса 500 кДа.
IgD составляет менее одного процента фракции иммуноглобулинов плазмы, содержится в основном на мембране некоторых В-лимфоцитов. Функции до конца не выяснены, предположительно является антигенным рецептором с высоким содержанием связанных с белком углеводов для В-лимфоцитов, еще не представлявшихся антигену. Молекулярная масса 175 кДа.
IgE в свободном виде в плазме почти отсутствует. Способен осуществлять защитную функцию в организме от действия паразитарных инфекций, обуславливает многие аллергические реакции. Механизм действия IgE проявляется через связывание с высоким сродством (10−10М) с поверхностными структурами базофилов и тучных клеток, с последующим присоединением к ним антигена, вызывая дегрануляцию и выброс в кровь высоко активных аминов (гистамина и серотонина - медиаторов воспаления). 200 кДа.
Иммунодефициты — это нарушения нормального иммунного статуса, обусловленные дефектом одного или нескольких механизмов иммунного ответа. Различают первичные, или врожденные (генетические), и вторичные, или приобретенные, иммунодефициты. В качестве первичных выделяют такие состояния, при которых нарушение иммунных гуморальных и клеточных механизмов связано с генетическим блоком, т. е. генетически обусловлено неспособностью организма реализовывать то или иное звено иммунологической реактивности. Расстройства иммунной системы могут затрагивать как основные специфические звенья в функционировании иммунной системы, так и факторы, определяющие неспецифическую резистентность. Возможны комбинированные и селективные варианты иммунных расстройств. В зависимости от уровня и характера нарушений различают гуморальные, клеточные и комбинированные иммунодефициты. Причинами врожденных иммунодефицитов могут быть удвоение хромосом, точечные мутации, дефектферментов обмена нуклеиновых кислот, генетически обусловленные нарушения мембран, повреждения генома в эмбриональном периоде и др. Как правило, первичные иммунодефициты проявляются на ранних этапах постнатального периода и наследуются по аутосомно-рецессивному типу. Проявляться первичные иммунодефициты могут в виде недостаточности фагоцитоза, системы комплемента, гуморального иммунитета (В-системы), клеточного иммунитета (Т-системы) или же в виде комбинированной иммунологической недостаточности. Вторичные иммунодефициты в отличие от первичных развиваются у лиц с нормально функционировавшей от рождения иммунной системой. Они формируются под воздействием окружающей среды на уровне фенотипа и обусловлены нарушением функции иммунной системы в результате различных заболеваний или неблагоприятных воздействий на организм. При вторичных иммунодефицитах могут поражаться Т- и В-системы иммунитета, факторы неспецифической резистентности, возможны также их сочетания. Вторичные иммунодефициты встречаются значительно чаще, чем первичные. Вторичные иммунодеф, как правило, преходящие и поддаются иммунокоррекции, т. е. восстановлению нормальной деятельности иммунной системы. Вторичные иммунодефицита могут быть: после перенесенных инфекций (особенно вирусных) и инвазий (протозойные и гельминтозы); при ожоговой болезни; при уремии; при опухолях; при нарушении обмена веществ и истощении; при дисбиозах; при тяжелых травмах, обширных хирургических операциях, особенно выполняемых под общим наркозом; при облучении, действии химических веществ; при старении, а также медикаментозные, связанные с приемом лекарств. По клиническому течению выделяют компенсированную, субкомпенсированную и декомпенсированную формы вторичных иммунодефицитов. Компенсированная форма сопровождается повышенной восприимчивостью организма к инфекционным агентам, вызывающим оппортунистические инфекции. Субкомпенсированная форма характеризуется склонностью к хронизации инфекционных процессов. Декомпенсированная форма проявляется в виде генерализованных инфекций, вызванных условно-патогенными микробами (УПМ) и злокачественными новообразованиями. Известно разделение вторичных иммунодефицитов на: Физиологические, новорожденные, пубертатного периода, беременности и лактации, старения, биоритмичности, экологические, сезонные, эндогенные интоксикации, радиационные, СВЧ, патологические, постинфекционные, стрессовые, регуляторно-метаболические, медикаментозные, онкологические.
65. Опухоли (новообразования) возникают, когда по каким-либо причинам наблюдается неконтролируемая избыточная пролиферация клеток. Обычно во всех органах и тканях поддерживается баланс между процессами гибели клеток и их новообразованием.
Главной отличительной особенностью опухолевых клеток от нормальных является способность к неограниченному росту и потеря механизмов аутокринной и паракринной регуляции. Для злокачественных клеток также характерна инвазия окружающих тканей и метастазирование в отдаленные участки организма. Распространение опухолевых клеток происходит по лимфатическим путям и через кровоток.
Опухоли способны возникать спонтанно, без видимых на то причин, а также могут быть индуцированы. У человека, как правило, появляющиеся опухоли – это спонтанные, хотя отличить спонтанно возникшую опухоль от индуцированной чрезвычайно трудно.Индуцировать канцерогенез способны различные химические вещества (метилхолантрен, бензпирен, афлатоксин В1), физические факторы (ультрафиолетовый свет, ионизирующая радиация), вирусы (папова-, герпес-, адено- и ретровирусы). У человека 3 типа вирусов тесно связаны с опухолями, это вирус Эпштейна-Барр (лимфома Беркита), цитомегаловирус (саркома Капоши) и вирус папилломы. Опухолеспецифические антигены являются уникальными молекулами для организма и не присутствуют ни в один из периодов развития, в том числе и эмбриональный, на нормальных клетках организма. Полагают, они являются результатом мутаций в геноме опухолевых клеток, приводящих к формированию новых клеточных белков, которые, подвергаясь процессингу в цитозоле клетки, дают начало опухолевым пептидам, представленным на клеточной поверхности в комплексе с молекулами HLA-1 класса. Опухолеассоциированные белки (антигены), в свою очередь, не являются строго специфическими для опухолевых клеток, и, как правило, являются белками, которые были экспрессированы на нормальных клетках в эмбриональный период или являются молекулами, которые экспрессированы обычно на нормальных клетках, но в очень малых количествах, а при злокачественной трансформации клеток экспрессируются в высокой плотности. Реэкспресия эмбриональных генов или чрезмерная активация регуляторных генов в нормальных зрелых клетках, вероятно, является результатом тех изменений, которые происходят в геноме при злокачественной трансформации клеток.
Опухолеассоциированные белки (антигены) не являются уникальными для опухолевых клеток. Они представлены антигенами двух типов. Представителями первого типа являются раково-эмбриональные антигены. Из них наиболее изучены альфа-фетопротеин (АФП) и раковоэмбриональный антиген (РЭА). Эти антигены (белки) появляются в норме в эмбриональном периоде развития индивидуума и участвуют как регуляторные белки в дифференцировке тканей и развитии органов.
Альфа-фетопротеин впервые был обнаружен в фетальной сыворотке теленка. Он вырабатывается преимущественно гепатоцитами, а также клетками желудочно-кишечного тракта. Представляет собой гликопротеин м.м. 70 кD. У плода человека его концентрация составляет 3000 мкг/мл, у взрослого 0,02 мкг/мл. Повышение содержания АФП в сыворотке больного в 80 % случаев свидетельствует о первичном раке печени.
Раково-эмбриональный антиген (РЭА) является мембранным гликопротеином. Экспрессируется в норме на гастроинтестинальных клетках и клетках печени плода на 2-6 месяце внутриутробного развития. У взрослых в норме не выявляется. Его появление в сыворотке свидетельствует с 90% вероятностью о карциноме толстой кишки, а также карциноме поджелудочной железы.
66. Аутоиммунные заболевания — это класс разнородных по клиническим проявлениям заболеваний, развивающихся вследствие патологической выработки аутоиммунных антител или размножения аутоагрессивных клонов киллерных клеток против здоровых, нормальных тканей организма, приводящих к повреждению и разрушению нормальных тканей и к развитию аутоиммунного воспаления. Возможные причины:1.инфицирование организма таким инфекционным агентом, антигенные детерминанты (эпитопы) важнейших белков которого напоминают антигенные детерминанты нормальных тканей организма хозяина.2.вызванной инфекционным агентом деструкцией или некрозом тканей, или изменением их антигенной структуры так, что патологически изменённая ткань становится иммуногенной для организма хозяина.3.нарушение целостности тканевых (гисто-гематических) барьеров, в норме отделяющих некоторые органы и ткани от крови и, соответственно, от иммунной агрессии лимфоцитов хозяина. При этом, поскольку в норме антигены этих тканей в кровь вообще не попадают, тимус в норме не производит негативной селекции (уничтожения) аутоагрессивных лимфоцитов против этих тканей. Но это не мешает нормальному функционированию органа до тех пор, пока цел тканевой барьер, отделяющий данный орган от крови.4. гипериммунное состояние (патологически усиленный иммунитет) или иммунологический дисбаланс с нарушением «селекторной», подавляющей аутоиммунитет, функции тимуса или со снижением активности T-супрессорной субпопуляции клеток и повышением активности киллерных и хелперных субпопуляций.
